含硅藻土负载香芹酚复合体的明胶基缓释抗菌膜的制备与性能
李 森,马 灵,李 婷,彭 炉,李莎莎,李庆业,周 曼,吴贺君
(1.四川农业大学食品学院,四川 雅安 625014;2.四川农业大学理学院,四川 雅安 625014)
明胶(gelatin,G)是一种由废弃动物骨头、皮肤和结缔组织中的胶原蛋白水解产生的高分子蛋白质[1],因其良好的成膜性、气体阻隔性、耐油性以及资源丰富、成本低廉等优势,成为塑料包装的一种潜在替代品[2-3]。明胶膜的易吸水性导致其易受到细菌和霉菌的污染,且生物活性低,因此应用受到限制[4]。香芹酚(carvacrol,C)是一种挥发性单萜酚,天然存在于牛至、百里香、冬季香薄荷等唇形科植物中,具有非特异性的抗氧化、抗细菌、真菌等功效[5-6],Kavoosi等[7]将香芹酚添加至明胶膜后得到的复合膜表现出优异的功能活性,可用于制备广谱高效的抗菌活性食品包装材料。然而,香芹酚的快速挥发致使其存在抑菌时效短、利用率低的问题[8]。
为了抑制香芹酚活性成分的挥发,目前有研究将其封装于埃洛石纳米管等无机矿物制备抗菌复合体中,提升其长效抗菌效果[9-11]。然而埃洛石纳米管对于细胞的潜在毒性可能会限制其在食品包装中进一步应用[12-13]。硅藻土(diatomite,D)是硅藻遗骸经地质作用形成的硅质多孔沉积岩,其具有无毒、孔隙率高(高达80%,孔径50~200 nm)、比表面积大、吸附性强以及价格低廉等优点[14-15]。已有研究人员用硅藻土负载牛至精油[16]、百里酚[17]等制备包封效果好并具有缓释特性的新型抗菌复合体。然而目前将这种硅藻土负载植物精油的新型抗菌复合体用于制备缓释活性包装膜的研究还相对较少。基于此,本研究将硅藻土/香芹酚(D/C)复合体与明胶复合,探究D/C复合体添加量对明胶膜结构与性能的影响并验证其缓释效果,为促进含香芹酚等植物精油的明胶基抗菌复合膜的应用提供参考。
1 材料与方法
1.1 材料与试剂
明胶(化学纯)、硅藻土(纯度99%、堆积密度0.47 g/cm3)、乙醇(分析纯)(化学纯) 成都科隆化学品有限公司;香芹酚(分析纯) 上海瑞永生物科技有限公司;丙三醇(分析纯) 成都金山化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 南京都莱生物技术有限公司;营养肉汤、营养琼脂 杭州微生物试剂有限公司;金黄色葡萄球菌(Staphylococcusaureus)(ATCC29215)、大肠杆菌(Escherichia coli)(ATCC25922) 四川农业大学食品微生物学实验室;实验用水均为去离子水。
1.2 仪器与设备
85-2A型恒温磁力搅拌器 天津赛德利斯实验分析仪器制造厂;SHZ-DIII型循环水式真空泵 北京市永光明医疗器械有限公司;SU-1510型扫描电子显微镜 日本日立公司;Nicolet iS10型傅里叶变换红外光谱仪、Varioskan Flash型全波长多功能荧光酶标仪 美国赛默飞世尔科技公司;Rise-2006型激光粒度分析仪 济南润之科技有限公司;CM2300D型色差仪 日本柯尼卡美能达投资有限公司;WGW型光电雾度仪 上海仪电物理光学仪器有限公司;HD-A821-1型电子拉力试验机东莞市海达仪器有限公司;DSX-280B型手提式压力蒸汽灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 D/C复合体的制备
D/C复合体的制备参考文献[18]的方法并稍作修改。取一定质量(m1/g)硅藻土混合足够量的香芹酚,加入到抽滤瓶中,磁力搅拌10 min。再通过真空抽滤增大瓶内内部压力,将硅藻土表面香芹酚压入硅藻土的孔洞中,同时排出硅藻土孔洞中的空气。以上抽滤操作重复6 次,每次40 s。抽滤结束后,将混合物加入至已称质量的离心管(m2/g)中,4 000 r/min离心10 min,回收离心游离香芹酚(上清液)于抽滤瓶中,重复上次操作,进行二次离心。再次称量含有混合物的离心管总质量(m3/g)。将离心出来的游离部分香芹酚回收至广口瓶,可重复利用。硅藻土和香芹酚在D/C复合体中的相对含量分别按公式(1)、(2)计算。
1.3.2 D/C复合体的表征
1.3.2.1 外观观察
使用数码相机拍摄硅藻土负载香芹酚前后的照片,观察它们的颜色变化。
1.3.2.2 扫描电子显微镜观察
将硅藻土和经过40 ℃干燥12 h后的D/C复合体用导电树脂固定在青铜桩上,在离子溅射镀膜机上溅射金2 min,再利用SU-1510型扫描电子显微镜在20 kV下进行拍照观察。
1.3.2.3 红外光谱测定
采用溴化钾压片法,利用Nicolet iS10型傅里叶变换红外光谱仪对香芹酚、硅藻土和D/C复合体进行分析。分辨率为4 cm-1,测量记录的波数范围为650~4 000 cm-1,平均扫描32 次。
1.3.2.4 粒径测定
采用Rise-2006激光粒度分析仪测定硅藻土负载香芹酚前后的粒径。
1.3.3 明胶基抗菌复合膜的制备
根据文献[19]的方法制备明胶基复合膜,具体步骤如下:首先称取10 g明胶与2.5 g甘油,添加100 mL蒸馏水,在60 ℃恒温水浴中磁力搅拌50 min后形成膜液;继续冷却搅拌降温至40 ℃后,向膜液加入一定量D/C复合体,持续搅拌10 min,用胶头滴管吸出多余气泡;将膜液倒入自制230 mm×230 mm塑料成膜板,流延均匀后置于常温环境(25 ℃)下进行自然风干,1 d后揭膜;将薄膜置于温度(23±2)℃、相对湿度(55±5)% 的恒温恒湿箱中平衡24 h得到成品。
在制备含D/C复合体的复合膜时,复合体添加量分别为胶干质量的0%、10%、20%、30%,分别记作空白组G-K、G-D/C1、G-D/C2、G-D/C3。在明胶膜中分别单独添加与G-D/C3组等添加量的香芹酚和硅藻土制备复合膜作为对照,记作G-C和G-D。
1.3.4 明胶基抗菌复合膜的表征
1.3.4.1 扫描电子显微镜观察
采用SU-1510型扫描电子显微镜观察G-K、G-C、G-D/C3薄膜样品截面以及表面的微观形貌,加速电压15 kV。
1.3.4.2 红外光谱测定
从各组分薄膜上剪取一小块样品,利用Nicolet iS10型傅里叶变换红外光谱仪在ATR模式下直接测定,扫描范围650~4 000 cm-1、分辨率2.0 cm-1、累加32 次。
1.3.4.3 厚度测定
根据GB/T 6672—2001《塑料薄膜和薄片厚度测定 机械测量法》,用螺旋测微器在被测膜上随机取点,测量5 次取平均值,以μm为单位。
1.3.4.4 色泽测定
薄膜颜色由CM2300D型色差仪测定薄膜的颜色指数(L、a、b)。L值代表亮度;a值代表红绿色度,正值表示红色程度,负值表示绿色程度;b值代表黄蓝色度,正值表示黄色程度,负值表示蓝色程度。总色差值(ΔE)按公式(3)计算。
式中:L*、a*、b*为标准白色板的色泽指数(L*=99.76、a*=-0.02、b*=-0.40)。
1.3.4.5 透光率测定
参照GB/T 2410—2008《透明塑料透光率和雾度的测定》,将膜裁成正方形(50 mm×50 mm),采用WGW型光电雾度仪测定入射光通量(T1)和通过试样的总透射光通量(T2),每组5 个平行,取平均值,按照公式(4)计算透光率(TS)。
1.3.4.6 力学性能的表征
参照GB/T 1040.1—2018《塑料 拉伸性能的测定第1部分:总则》,将薄膜剪成70 mm×15 mm尺寸的样条,采用HD-A821-1型电子拉力试验机测定样品的拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB),设置初始间距为40 mm,拉伸速率为60 mm/min,测3 次取其平均值。
1.3.4.7 含水率和水溶性的测定
根据文献[20]的方法测定薄膜含水率和水溶性,将膜样(20 mm×20 mm)在室温下称质量(m0/g),然后在105 ℃条件下干燥至恒质量(m1/g)。将干燥后样品放入装有50 mL蒸馏水的离心管中,于25 ℃条件下浸泡24 h,并定时搅动。将未溶解的膜取出,用滤纸吸干膜表面水分,于105 ℃干燥至恒质量(m2/g)。根据公式(5)、(6)分别计算含水率和水溶性。
1.3.4.8 水蒸气透过率测定
根据GB/T 1037—2021《塑料薄膜与薄片水蒸气透过性能测定 杯式增重与减重法》,并略作修改后测定水蒸气透过率。将4 mm×4 mm的薄膜预先放置在含直径27.5 mm填充硅胶(相对湿度0%)的离心管口,并用橡胶圈密封,以确保湿度只通过薄膜迁移。将离心管储存在一个含有饱和KNO3溶液的干燥器中,控制温度为40 ℃、相对湿度为90%。每12 h检测离心管质量增加情况,连续测定7 d。所有分析均重复3 次,根据公式(7)计算水蒸气透过率(water vapor permeation,WVP)。
式中:Δm表示每12 h的质量差/g;d为样品平均厚度/cm;A为离心管管口面积/cm2;Δt为测量间隔时间/s;ΔP为40 ℃下纯水通过样品的水蒸气压差/Pa。
1.3.4.9 氧气透过率测定
根据文献[21]的方法测定薄膜的氧气透过率,取3 g脱氧剂加入到50 mL离心管,用薄膜封口后称初始质量(m1/g),然后将离心管放入盛有饱和氯化钡溶液(相对湿度85%)的干燥器中48 h后称质量(m2/g)。每组测试重复3 次求平均值,根据公式(8)计算氧气透过率(oxygen permeability,OP)。
式中:t为测定时间/h;A为离心管管口面积/m2。
1.3.4.10 抗氧化性测定
根据文献[22]的方法测定DPPH自由基清除率。取25 mg膜样于5 mL无水乙醇中浸泡过夜得到提取液。将每份提取液(0.1 mL)与3.9 mL 0.01 mmol/L DPPH溶液混合,剧烈摇晃后,在环境温度下黑暗中静置30 min,然后使用Varioskan Flash型全波长功能酶标仪在517 nm波长处测定吸光度。用无水乙醇代替提取液制备对照样品。每组样品3 个平行。DPPH自由基清除率按公式(9)计算。
式中:Aα为对照样品的吸光度;Aβ为测试样品的吸光度。
1.3.4.11 抗菌性测定
参考文献[17]采用琼脂抑菌圈扩散法测定薄膜的抗菌性能。选用2 种细菌(大肠杆菌、金黄色葡萄球菌)作为测试菌种涂布于LB培养基上,将各明胶薄膜裁剪为直径为15 mm的圆形膜样品,浸入戊二醛中交联1 min后,在去离子水中浸泡30 s,用滤纸吸干多余水分,将膜片贴附于培养基表面,在37 ℃培养24 h后,拍照并测量抑菌圈直径。
1.3.4.12 香芹酚的释放率测定
根据文献[23]的方法测定香芹酚的释放率。对复合膜中香芹酚在4 ℃、相对湿度50%条件下贮藏18 d过程中的释放率进行测定。首先,将薄膜裁剪成20 mm×20 mm正方形片,称质量后加入装有20 mL 95%乙醇溶液的60 mL封顶瓶中。室温25 ℃下振荡提取12 h,取0.1 mL提取液,进行梯度稀释,利用VarioskanFlash型多模酶标仪测定提取液在282 nm波长处的吸光度。将不同质量浓度香芹酚溶解在95%乙醇溶液制备标准品并绘制标准曲线,根据标准曲线方程确定香芹酚质量浓度。按公式(10)计算香芹酚的释放率。
式中:ρ为释放达到终点时香芹酚的质量浓度/(mg/mL);ρt为测试样品t时间点释放出的香芹酚质量浓度/(mg/mL)。
1.4 数据统计与分析
采用SPSS 27.0软件对数据进行统计分析,结果表示为平均值±标准偏差,使用方差分析和邓肯多重范围检验对数据进行显著性分析(P<0.05),以Origin 2017软件绘图。
2 结果与分析
2.1 D/C复合体的表征
如图1A所示,数码照片显示硅藻土为白色无机黏土,而负载香芹酚后,所得复合体粉末变为淡黄色,Lei Hong等[24]通过坡缕石负载生姜精油前后的颜色变化确定了精油的成功负载;此外,扫描电子显微镜结果直接证实负载香芹酚后,硅藻土的多孔结构被吸入孔洞的香芹酚完全覆盖。由图1B粒径分布曲线可以看出,硅藻土、D/C复合体两组样品均为单峰分布,平均粒径约在30 μm左右;而相对于硅藻土,复合体由于负载香芹酚后平均粒径略微增加且分布略微变宽。上述表征结果共同说明多孔性的硅藻土成功负载了香芹酚。并由公式(1)、(2)计算出硅藻土和香芹酚在复合体中的相对含量分别约为32.56%和67.44%。

图1 硅藻土和D/C复合体的结构表征Fig. 1 Structural characterization of diatomite and D/C complex
如图1C所示,香芹酚的特征吸收峰分别由在3 373 cm-1处和2 959 cm-1处羟基(—OH)和甲基(—CH3)的伸缩振动引起;1 250~1 750 cm-1区域出现的吸收峰与C—C键伸缩、—OH键弯曲和C—O键伸缩有关;811 cm-1处的吸收峰可能归因于芳香族—OH的伸缩振动[25]。硅藻土的特征峰分别是在1 085 cm-1处硅氧烷(—Si—O—Si)的强吸收峰,以及在794 cm-1处SiO—H键的振动峰,以上这些特征峰的出现表明硅藻土主要由SiO2组成[26]。对于D/C复合体,香芹酚和硅藻土的主要特征吸收峰均有出现,说明两者之间未发生化学反应。与香芹酚的红外光谱比较,D/C复合体红外光谱在3 100~3 600 cm-1之间的吸收峰(与O—H伸缩振动有关)变宽且强度降低,并向更高的波数转移,表明游离O—H键伸缩程度减弱。这可能是由于香芹酚与硅藻土表面羟基之间的氢键发生相互作用从而使两者的界面结合能力提高[27],机理如图1D所示。
2.2 复合明胶薄膜的表征
2.2.1 薄膜微观结构分析
由图2可知,G-K膜的截面和表面均连续、光滑且致密,无明显缺陷,证实明胶基质成膜性良好。而加入香芹酚后,G-C膜的表面与G-K膜相比变化不大,但横截面明显变得粗糙且厚度增大。这是由于香芹酚的增塑作用增加了明胶基质分子链之间的距离,从而使膜结构的致密性减弱[28-29]。当加入D/C复合体后,G-D/C3薄膜的厚度进一步增大,同时因为复合体中的硅藻土密度较大,在溶液成膜干燥时容易沉积在下表面[17],因此表面更为粗糙。此外,D/C复合体中香芹酚的酚羟基可与明胶基质中的羟基、羧基和氨基等极性基团发生氢键等相互作用,提升了复合体与明胶基质之间的界面相容性[30-31],所以两者结合较为紧密,并未出现明显的界面分离。

图2 G-K(A)、G-C(B)、G-D/C3(C)膜截面和表面的扫描电子显微镜图Fig. 2 SEM images of cross-section and surface of G-K (A), G-C (B)and G-D/C3 (C) films
2.2.2 薄膜红外光谱分析
如图3A所示,纯明胶薄膜3 296 cm-1处的峰对应N—H拉伸和O—H拉伸,2 931 cm-1处的峰对应C—H拉伸振动[32];在大约1 634、1 549 cm-1和1 240 cm-1处的峰分别对应酰胺I带的C=O拉伸、酰胺II带的N—H变形和C—H拉伸,以及蛋白质中酰胺III带的C—H和N—H基团在平面上的振动[33]。掺入硅藻土和香芹酚,G-D/C3薄膜在3 000~3 600 cm-1处的频带强度明显下降。此外,与G-K膜相比,G-D/C3膜的光谱中有明显的酰胺I带(1 690~1 630 cm-1)和酰胺II带(1 655~1 590 cm-1)。由此可见,明胶基复合膜的带位和强度发生了一些变化,但并未有新峰的产生,表明D/C复合体与明胶基质之间没有化学相互作用,只有物理分子间的相互作用[20]。这种作用可能是硅藻土对香芹酚的物理吸附和携带作用,以及蛋白基质极性基团与D/C复合体中香芹酚的酚羟基之间的氢键相互作用[31]。

图3 复合膜的傅里叶变换红外光谱(A)和表观形貌(B)Fig. 3 Fourier transform infrared spectra (A) and apparent images (B)of the composite films
2.2.3 薄膜的厚度、色泽、透光率
由表1可知,G-K膜的厚度仅为84.67 μm,而复合膜的厚度随着D/C复合体添加量的增加而显著上升(P<0.05),膜的厚度主要取决于成膜液中非溶剂成分的含量。如图3B所示,明胶薄膜本身成淡黄色,随着D/C复合体添加量的增加,薄膜黄色逐渐加深,这是由于香芹酚作为添加物质其颜色偏淡黄色,从而导致膜的a值降低、b值增大。此外,复合膜中硅藻土为白色粉末状黏土,因此添加硅藻土的复合膜与G-K相比ΔE降低。复合膜的透过率同样随着薄膜复合体的添加量增加而显著降低(P<0.05),特别是相比于G-K膜,G-D/C3膜的透光率降低了近20%。这是由于硅藻土本身作为无机物质,具有不透明性,在膜中会阻碍光线的透过。Akyuz等[34]发现在壳聚糖薄膜中添加硅藻土同样会显著改善薄膜的光阻隔性能。同时,溶质的量增加导致膜厚度变大,也会进一步阻碍光线的透过。
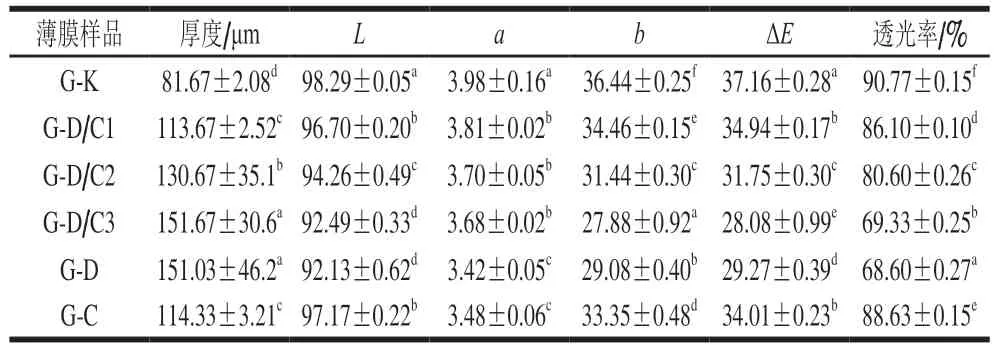
表1 复合膜的厚度、色泽和透光率Table 1 Thickness, color difference and transmittance of the composite films
2.2.4 薄膜力学性能的表征
由图4可知,可以观察到G-C、G-D膜TS均较低。在复合薄膜中,随D/C复合体添加量的增加,TS呈现逐渐降低的趋势,由17.66 MPa(G-K)下降到了13.01 MPa(G-D/C3)。TS降低一方面是因为薄膜中香芹酚的挥发会致使薄膜出现孔洞结构,从而破环薄膜本身完整结构[35];另一方面,过多的复合体则可能会导致其在膜中的分散性降低,使颗粒发生团聚,造成颗粒尺寸增大和周边区域的应力集中[36]。此外,G-C膜相比于G-D膜EAB显著增加,因为香芹酚的存在会对明胶薄膜产生增塑作用,降低明胶单体之间的相互作用,阻碍聚合物的链-链相互作用[37]。最终在复合膜中,EAB由G-K薄膜组的61.06%提升至G-D/C3薄膜组的80.45%。在D/C添加量为20%时,复合膜具备优异的力学性能,其TS为15.13 MPa,EAB为67.43%。总地来说,由于香芹酚的增塑作用,D/C复合体的加入可一定程度改善明胶膜的EAB。
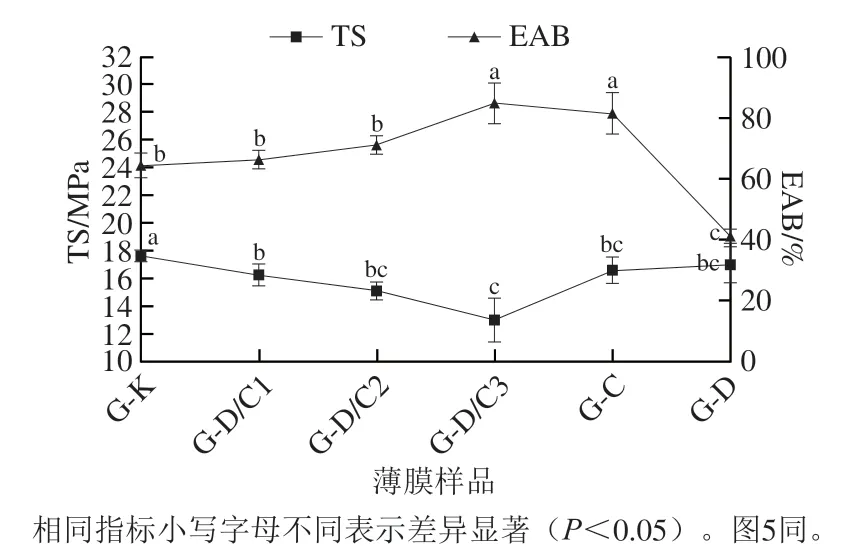
图4 复合膜的力学性能Fig. 4 Mechanical properties of the composite films
2.2.5 含水率、水溶性、水蒸气透过率和氧气透过率
由表2可知,复合膜的含水率和水溶性随着D/C复合体添加量的增加而显著降低,这归因于D/C复合体中硅藻土作为无机填料不溶于水,增加了复合膜中不溶物质的量。此外,香芹酚作为一种疏水性化合物,它的存在也有助于明胶膜的疏水性提升[34,38]。Hosseini等[28]将百里香、丁香、肉桂精油添加至壳聚糖中制备抗菌复合膜并测定其含水率和溶解度,也得到了类似的结果。然而值得注意的是,仅含有香芹酚的G-C膜水溶性最高,这可能是由于G-C膜中的香芹酚容易从明胶基质迁移到浸泡的水中而损失[39]。
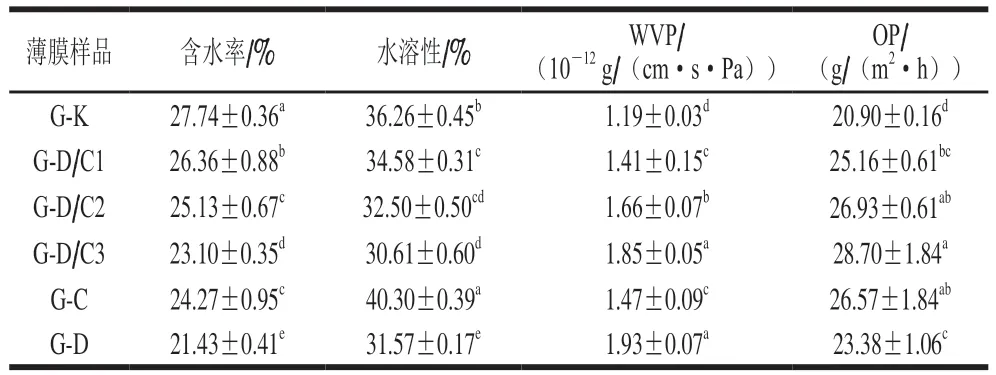
表2 复合膜的含水率、水溶性、WVP和OPTable 2 Water content, solubility, water vapor permeability and oxygen permeability of the composite films
G-C薄膜的WVP相较于G-K显著增加。复合体中香芹酚的存在对明胶膜产生了一定的增塑作用,降低了明胶膜网络内的内聚力,从而导致WVP增加[7]。Kavoosi等[7]同样发现在明胶膜中添加香芹酚可导致WVP的增加。G-D膜的WVP最高,为1.93×10-12g/(cm·s·Pa)。这是由于硅藻土颗粒的高孔隙率和聚集性,有利于水分子通过硅藻土内部孔隙和聚合物基体界面区域的扩散[40-41]。结果表明,D/C复合体的加入会降低复合膜含水率和水溶性,但使其WVP增大。
食品在保存过程中的氧渗透性是影响食品保质期的一个重要因素[21]。如表2所示,G-C薄膜的OP相较于G-K有所增加,这是因为香芹酚的增塑作用导致明胶基质分子间距增大,进而使膜的连续性和紧密结构受到影响;此外,随着D/C复合体添加量的增加,复合膜的OP也呈现逐渐增大的趋势,这是因为复合体中多孔性硅藻土的存在同样会破坏明胶基质致密完整的网络结构,进而促进空气中氧分子的通过,造成复合膜的OP增大。说明与G-K相比,复合膜的阻隔性能有所降低。
2.2.6 薄膜的抗氧化性和抗菌特性
2.2.6.1 抗氧化性
在明胶基质当中添加抗氧化活性物质能够有效抑制食品的氧化反应进而延长食品货架期[42]。如图5所示,G-K、G-D均具有一定DPPH自由基清除效果,这是由于硅藻土本身并不具有抗氧化活性,但明胶中多肽具有一定的抗氧化活性[22,43]。而G-C与G-D/C3均表现出最高的DPPH自由基清除率,且二者无显著性差异(P>0.05)。当D/C复合体在明胶中添加量达到20%时,DPPH自由基清除率为56.33%。这是因为香芹酚具有较强的抗氧化活性,它的抗氧化能力除了取决于其环的空间位阻效应和电子效应外,还与羟基的存在有关,羟基能够提供氢原子与氧原子结合[44]。因此,可以发现随着复合体添加量的增加,复合的DPPH自由基清除率显著提升(P<0.05)。
2.2.6.2 抗菌性
如图6所示,由于明胶本身不具有抗菌活性,G-K组并未产生抑菌圈。随着加入复合体的添加量增加,复合膜样片周围透明的抑菌圈逐渐增大,说明复合膜具有较好的抑菌活性。当D/C复合体在明胶膜中添加量达到20%时,薄膜对金黄色葡萄球菌和大肠杆菌抑菌圈直径可分别达到39.40 mm和23.70 mm(表3)。这主要归因于D/C复合体中香芹酚能快速提高细菌细胞膜通透性及渗透压,造成胞内物质外泄,并且进入细胞内部的酚类物质可改变细菌酶系统,导致微生物死亡[45-46]。此外,复合膜对金黄色葡萄球菌的抑菌性要强于对大肠杆菌的抑菌性。这是因为革兰氏阴性菌细胞壁通常会多一层脂蛋白层或磷脂层和脂多糖层,限制了酚类物质与细菌内部蛋白结合[45]。对比G-D/C3与G-C两组,虽然它们含有等量的香芹酚,但G-D/C3的抑菌效果要略差于G-C。这可能与香芹酚被硅藻土负载后,在D/C复合体的释放速率较为缓慢有关,后续实验将进一步证实此推测。总地来说,D/C复合体的加入成功赋予明胶复合膜优异抗菌活性。

表3 复合薄膜对金黄色葡萄球菌和大肠杆菌的抑菌圈直径Table 3 Inhibition zone diameters of the composite films against S. aureus and E. coli
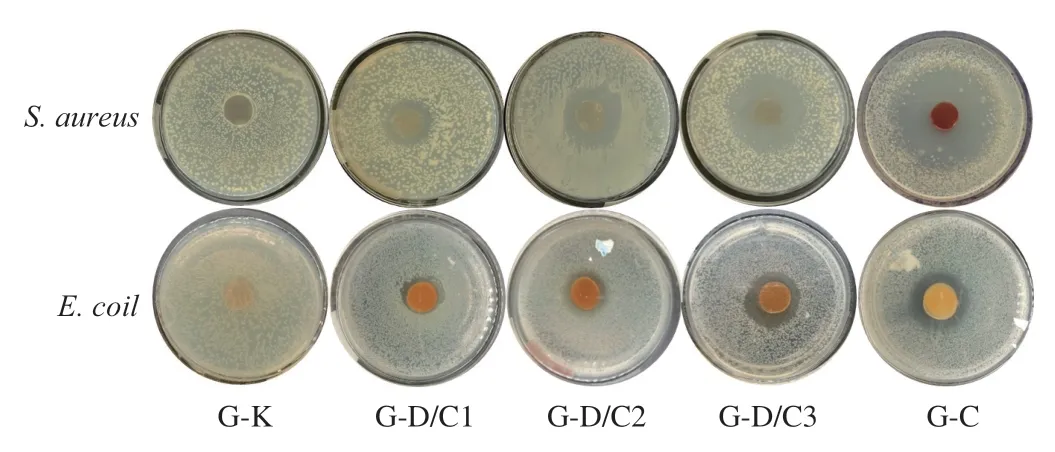
图6 复合膜的抑菌性能Fig. 6 Antibacterial activities of the composite films
2.2.7 复合膜的香芹酚缓释性能
2.2.7.1 G-D/C3和G-C薄膜贮藏过程中香芹酚的释放率
香芹酚在薄膜放置过程中会因挥发而损失,导致复合膜的抗菌时效受到影响。由图7可知,随着贮藏时间的延长,精油香芹酚在G-D/C3复合膜中的释放率始终低于G-C薄膜。G-C复合薄膜中香芹酚在第14天左右便释放完全,而G-D/C3薄膜中香芹酚在第18天才完全释放,比前者延迟了4 d。这是由于在G-D/C3复合膜中,香芹酚的释放可分为两个阶段:第一个阶段为游离精油的挥发释放(与G-C组相似);第二阶段为负载在硅藻土内部精油的迁移挥发[18]。添加D/C复合体后,硅藻土的吸附负载能够减缓香芹酚释放的速率,有效降低其在明胶复合膜成膜和储存过程的损失,有利于延长复合膜的抗菌活性时效[47]。

图7 G-D/C3和G-C膜中香芹酚的释放率Fig. 7 Carvacrol release from G-D/C3 and G-C films
2.2.7.2 G-D/C3和G-C薄膜的抑菌性
基于上述实验结果,进一步测定了G-D/C3和G-C两组复合膜对金黄色葡萄球菌连续培养5 d过程中抑菌圈直径的变化,结果如图8所示。随着培养时间的延长,两组抑菌圈直径均有所减小,这与香芹酚的挥发损失有关。放置4 d后,G-D/C3薄膜抑菌圈直径在不再缩小;而G-C薄膜抑菌圈直径仍在不断缩小。印证了G-D/C3薄膜中香芹酚释放更为缓慢的结论。同时,可以发现在4 d后G-C膜周围出现多个单菌落,而G-D/C3膜中并未观察到有类似明显的变化。在贮藏结束时,G-D/C3薄膜抑菌圈直径由0 d时的45 mm最终降低至37 mm,变化率为17.8%;而G-C薄膜抑菌圈直径由0 d时的59 mm最终降低至44 mm,变化率为25.4%。以上实验结果均有效证明了G-D/C3薄膜相较于G-C薄膜具有更加长效的抑菌效果。

图8 贮藏5 d过程中G-D/C3和G-C膜对金黄色葡萄球菌的抑菌圈直径变化Fig. 8 Change in inhibition zone diameter of G-D/C3 and G-C films against S. aureus during storage for up to five days
3 结 论
本研究利用多孔性的硅藻土负载易挥发的香芹酚制备D/C复合体,并将其加入到明胶膜溶液中,利用流延成膜法制得活性复合膜,探究了不同D/C复合体添加量对复合膜结构与性能的影响。通过扫描电子显微镜观察和傅里叶变换红外光谱分析证实了香芹酚成功物理吸附在硅藻土内部孔洞与表面,且两者之间可能存在氢键等相互作用而有效结合。D/C复合体的加入显著改善了明胶基复合膜的光阻隔性能、水不溶性和EAB,但同时也会使TS、WVP和OP有所降低。更为重要的是,D/C复合体的加入赋予了明胶膜良好的抗氧化性和抑菌性能。此外,与含等量香芹酚的G-C膜相比,硅藻土的负载可以使G-D/C膜中香芹酚具有更缓慢的释放速率,有利于延长复合膜的抗菌时效。本实验研究结果能够为以无机硅藻土负载植物精油制备新型缓释抗菌明胶基复合膜的研发及其在食品包装方面的应用提供一定参考。

