金黄色葡萄球菌拮抗细菌的分离鉴定及拮抗活性分析
郑佩瑶,田 羽,王 娟,邓 丽,肖 丹,刘建蕊,韩雨霏,李 祝*
(贵州大学 生命科学学院,贵州 贵阳 550025)
金黄色葡萄球菌(Staphylococcus aureus)是葡萄球菌属的一种兼性厌氧革兰氏阳性细菌,广泛分布于自然界[1]。金黄色葡萄球菌作为一种食源性病原菌,是多种动物和人类容易感染的常见病原体[2-3],从而造成食品污染。其引起食物中毒的机理是产生大量毒素和酶[4]。因此金黄色葡萄球菌的防治一直是研究人员关注的问题。之前对金黄色球菌感染疾病的治疗药物主要为抗生素[5],如四环素、红霉素和环丙沙星等[5-6]。近年来,抗生素在金黄色葡萄球菌的感染疾病中大量使用,使很多耐药菌产生,其传播已经成为了逐渐严重的全球性问题[7]。金黄色葡萄球菌抗菌素耐药性增强,因此治疗选择变得越来越有限[8]。而用物理方法杀灭金黄色葡萄球菌较为稳妥,但多种方法均因为经济损耗大、操作繁琐等原因,不能作为防治的首选[9]。
如今由于微生物种类多、来源广及成本低,所以越来越多的研究人员开始从微生物代谢产物中寻找新的抗菌药物[10]。如从猪肠道中分离的到一株地衣芽孢杆菌(Bacillus licheniformis)PB-2可以产生抗菌活性物质,对金黄色葡萄球菌的抑制效果十分明显[11],干酪乳杆菌(Lactobacillus casei)的发酵产物也对金黄色葡萄球菌具有拮抗活性[12]。因此,本实验计划从自然发酵荠菜中分离出细菌,通过点接法和牛津杯法筛选得到对金黄色葡萄球菌有拮抗作用的细菌,随后对其进行鉴定和发酵产物粗提物的提取,并对其提取物成分进行气质联用法(gas chromatography-mass spectrometry,GC-MS)分析,以了解其具有拮抗活性的成分,并对筛选菌株在未来的应用提出展望。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
自然发酵芥菜:贵州省毕节市家乡美农业综合开发有限公司;金黄色葡萄球菌(Staphylococcus aureus)PJ-1:由贵州大学生命科学学院微生物实验室分离、筛选、鉴定和保存。
1.1.2 化学试剂
乙醇(分析纯):生工生物工程(上海)有限公司;乙酸乙酯、石油醚、三氯甲烷、二甲基亚砜(dimethyl sulfoxide,DMSO)、氯化钠(均为分析纯):重庆川东化工集团有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
牛肉膏蛋白胨液体培养基:牛肉膏3 g/L,蛋白胨10g/L,NaCl 5 g/L,pH 自然,121 ℃湿热灭菌30 min。固体培养基加琼脂20 g/L。
1.2 仪器与设备
SW-CJ-1FD型单人单面超净工作台:苏州净化设备有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅:上海申安医疗器械厂;Allegra X-30R型离心机:美国贝克曼库尔特有限公司;BIOMATE 3S型紫外分光光度计:美国Thermo Fisher公司;Bio-Rad S1000 型聚合酶链式反应(polymerase chain reaction,PCR)仪:上海菲特科学器材有限公司;RE-5298型旋转蒸发仪:上海亚荣仪器有限公司;DDB303A型电导率仪:上海雷磁仪器厂;7890A/5975C型气相色谱-质谱联用仪(GC-MS):美国Agilent公司;JY300HE型电泳仪:北京君意东方电泳设备有限公司;CAMX PLU型酶标仪:美国Molecular Devices公司;Gel Doc XR+凝胶成像仪:北京赛百奥科技有限公司。
1.3 实验方法
1.3.1 拮抗细菌的分离
将从自然发酵芥菜中分离筛选出的拮抗细菌分别在装有牛肉膏蛋白胨固体培养基的平板上划线,30 ℃恒温培养2 d。
1.3.2 拮抗细菌的筛选
①点接法测定抑菌圈直径:挑取指示菌PJ-1接种于牛肉膏蛋白胨液体培养基中,30 ℃、150 r/min振荡培养24 h,使其OD600nm值控制为0.6~0.8。待牛肉膏蛋白胨固体培养基冷却至50 ℃时,向其中加入为培养基体积1%的PJ-1菌悬液,混匀倒入平板中,待其凝固后在平板上点接拮抗细菌,使拮抗细菌之间的距离为2.5 cm,30 ℃培养2 d测其抑菌圈直径,不接拮抗细菌为空白对照。
②牛津杯法测定抑菌圈直径:分别挑取9株拮抗细菌接种于牛肉膏蛋白胨培养基中,30 ℃、150 r/min振荡培养24 h,使其OD600nm值控制为0.6~0.8。吸取制备好的拮抗细菌菌悬液1 mL接种于装有50 mL牛肉膏蛋白胨培养基的锥形瓶中,30 ℃、150 r/min振荡培养2 d,8 000 r/min离心10 min,取其上清液用0.22 μm的水系滤膜过滤后置于4 ℃冰箱冷藏备用。待牛肉膏蛋白胨固体培养基冷却至50 ℃时,向其中加入培养基体积1%的PJ-1菌悬液混匀,将牛津杯置于平板上,倒入混合液,待其凝固后取去牛津杯,向其孔中分别加入100 μL各拮抗细菌的抗菌发酵液,30 ℃培养3 d测其抑菌圈直径,加无菌水为空白对照。
1.3.3 拮抗细菌的形态学观察与分子生物学鉴定
拮抗细菌的形态学观察:挑取拮抗细菌进行革兰氏染色并观察。
拮抗细菌DNA的提取:分别挑取一环拮抗细菌接种于牛肉膏蛋白胨液体培养基中30 ℃、150 r/min恒温振荡培养24 h,按索莱宝细菌DNA提取试剂盒说明书按步骤进行。
PCR扩增:以DNA为模板,使用细菌通用引物27F和1492R对菌株的16S rDNA基因进行PCR扩增。PCR扩增体系(50 μL)如下:2×TaqPCR Master Mix 15 μL、DNA模板3 μL,上下游引物各2 μL和ddH2O 28 μL。PCR扩增程序为:94 ℃预变性1 min,94 ℃变性1 min,退火到58 ℃保持40 s,72 ℃延伸1 min,终延伸72 ℃、10 min,设置为35个循环,于4 ℃停止。PCR扩增所用引物的序列为27F(5'-AGAGTTTGATCCTGGCTCAG-3),1492R(5'-GGTTACCTTGTTACGACTT-3')。将最终扩增所获得的产物送往上海市生工生物工程有限公司完成检测。
系统发育树的构建:将得到的序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)进行基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)比对查找相似序列,选择相似性>99%的序列下载,用MEGA7.0软件邻接(neighbor-joining,N-J)法构建系统发育树。
1.3.4 拮抗细菌粗提物的制备及拮抗活性测定
粗提物的制备:分别挑取一环由上述实验筛选出具有良好拮抗活性的拮抗细菌接种于100 mL牛肉膏蛋白胨培养基中,30 ℃、150 r/min振荡培养2 d,6 000 r/min离心5 min取上清并过0.22 μm水系滤膜后,选用有机溶剂乙酸乙酯对其发酵液进行萃取,用旋转蒸发仪旋干得各拮抗细菌发酵产物的乙酸乙酯粗提物,准确称取0.15 mg溶解于5 mL二甲基亚砜(DMSO)中备用。
细菌乙酸乙酯粗提物对PJ-1拮抗活性的测定:起主要拮抗作用的为菌株发酵产物,因发酵产物为水相物质,很难得到其干物质,且在用旋转蒸发仪旋干过程中很多活性物质可能会因温度过高而失活,且水相不便用GC-MS进行成分分析,所以采用乙酸乙酯对其发酵产物进行萃取。用生长速率法筛选各拮抗细菌的乙酸乙酯粗提物的拮抗活性,将PJ-1菌悬液以5%的接种量分别接种于装有5 mL牛肉膏蛋白胨液体培养基的试管中,分别加入溶于DMSO中的上述各拮抗细菌的乙酸乙酯粗提物50 μL,30 ℃、150 r/min振荡培养24 h,对照组加50 μL DMSO进行培养。用紫外分光光度计在波长600 nm处测其吸光度值,并用以下公式计算其抑菌率:
1.3.5 拮抗细菌乙酸乙酯粗提物的成分分析
称取萃取旋干后的由1.3.4筛选得到的拮抗细菌的乙酸乙酯粗提物10 mg溶于1 mL甲醇中,超声振荡充分溶解,并用0.22μm有机滤膜过滤,采用GC-MS进行挥发性成分分析。
GC-MS条件[13]:HP-5MS色谱柱(30m×0.25μm,0.25mm),初始温度50℃保持2min,以5℃/min升温至240℃保持15min,运行时间55 min;汽化室温度250 ℃;载气为高纯氦气(He,纯度99.999%);柱前压7.65 psi,载气流量1.0 mL/min,不分流,溶剂延迟时间5.0 min。离子源为电子电离(electron ionization,EI)源,离子源温度230 ℃,四极杆温度150 ℃,电子能量70 eV,发射电流34.6 μA,倍增器电压1 624 V,接口温度280 ℃,质量范围29~500 amu。
定性定量方法:使用Wiley数据库进行化合物的鉴定分析,选出正负匹配度>800的化合物。采用面积归一法定量。
1.3.6 数据分析
使用Office 2016进行数据的处理和图表制作,使用MEGA7.0构建系统发育树,采用DataAnaylysis软件对GC-MS离子图进行谱图解析,用IBM SPSS Statistics 2019进行统计分析,数据显著性均为P<0.05,实验均设3个平行。
2 结果与分析
2.1 拮抗细菌对PJ-1拮抗活性的分离与筛选
2.1.1 菌株分离
从自然发酵芥菜中分离纯化得到33株细菌,筛选得到9株对金黄色葡萄球菌PJ-1有拮抗活性的细菌,分别编号为SC-1~SC-9。
2.1.2 点接法筛选
由图1可知,9株拮抗细菌都对金黄色葡萄球菌PJ-1表现一定的拮抗活性,其中菌株SC-3抑菌圈直径为20.23 mm,SC-9为18.15 mm,SC-4为16.02 mm,SC-8为15.87 mm,SC-5为14.83mm,SC-2 为14.81 mm,SC-6 为12.33 mm,SC-1 为10.83 mm,菌株SC-7对金黄色葡萄球菌PJ-1的拮抗活性最小,抑菌圈直径为9.41 mm。根据点接法筛选结果可以看出,SC-3、SC-9对金黄色葡萄球菌PJ-1的拮抗活性较好,其中菌株SC-3对金黄色葡萄球菌PJ-1的拮抗活性最佳。

图1 9株细菌对金黄色葡萄球菌PJ-1拮抗活性的点接法筛选结果Fig.1 Results of dot junction screening of antagonistic activity of 9 strains against Staphylococcus aureus PJ-1
2.1.3 牛津杯法筛选
牛津杯法可测定过滤菌体后代谢物对病原菌的拮抗活性,抗菌物质主要为拮抗细菌的发酵产物[14]。9株拮抗细菌对金黄色葡萄球菌PJ-1拮抗活性见图2。由图2可知,9株菌株对金黄色葡萄球菌PJ-1的抑菌圈直径均在27.0 mm以上,SC-9对金黄色葡萄球菌PJ-1的拮抗活性最好,抑菌圈直径为49.12 mm,其次为SC-6,抑菌圈直径为42.12 mm,SC-5的抑菌圈直径为41.05 mm,SC-2的抑菌圈直径为39.12 mm,SC-7的抑菌圈直径为38.08 mm,SC-3的抑菌圈直径为37.26 mm,SC-4的抑菌圈直径为37.10 mm,SC-8为36.83 mm。SC-1在该筛选方法中的拮抗活性最小,抑菌圈直径为27.50 mm。筛选结果表明,SC-9,SC-6对金黄色葡萄球菌PJ-1的拮抗活性较好。

图2 9株细菌对金黄色葡萄球菌PJ-1拮抗活性的牛津杯法筛选结果Fig.2 Results of Oxford cup screening of antagonistic activity of 9 strains against Staphylococcus aureus PJ-1
牛津杯法筛选可知所有菌株对金黄色葡萄球菌PJ-1的抑菌圈直径均高于用点接法初筛,由此可推测抗菌物质主要为其代谢产物。并且除SC-1外,所有菌株对金黄色葡萄球菌的抑菌圈直径均高于所报道的31.5 mm[15]。研究报道细菌如芽孢杆菌具有产纤维素酶、淀粉酶、蛋白酶、β-葡聚糖酶和H2O2的能力[16-18]。此外,几乎所有的芽孢杆菌都可产生一种抗菌多肽,称抗菌素[19]。因此推测菌株对金黄色葡萄球菌PJ-1的拮抗活性可能与它们产以上所述物质相关。
2.2 拮抗细菌的鉴定
由上述两种方法筛选出具有良好拮抗活性的3株拮抗细菌,分别为SC-3、SC-6和SC-9。拮抗细菌的菌落均呈乳白色、形状为圆形,细菌菌落边缘粗糙干燥、无光泽,拮抗细菌皆不透明。经染色后镜检发现所有菌株均为革兰氏阳性细菌,呈乳白色,形状均为圆形,其革兰氏染色结果见图3。
图3 不同拮抗细菌的革兰氏染色结果Fig.3 Gram staining results of different antagonistic bacteria
利用MEGA7.0构建3株拮抗细菌的系统发育树,3种菌参与构建的系统发育树见图4。由图4可知,结合形态特征和生理生化鉴定,鉴定菌株SC-3为贝莱斯芽孢杆菌(Bacillus velezensis),菌株SC-6为莫海威芽孢杆菌(Bacillus mojavensis),菌株SC-9为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
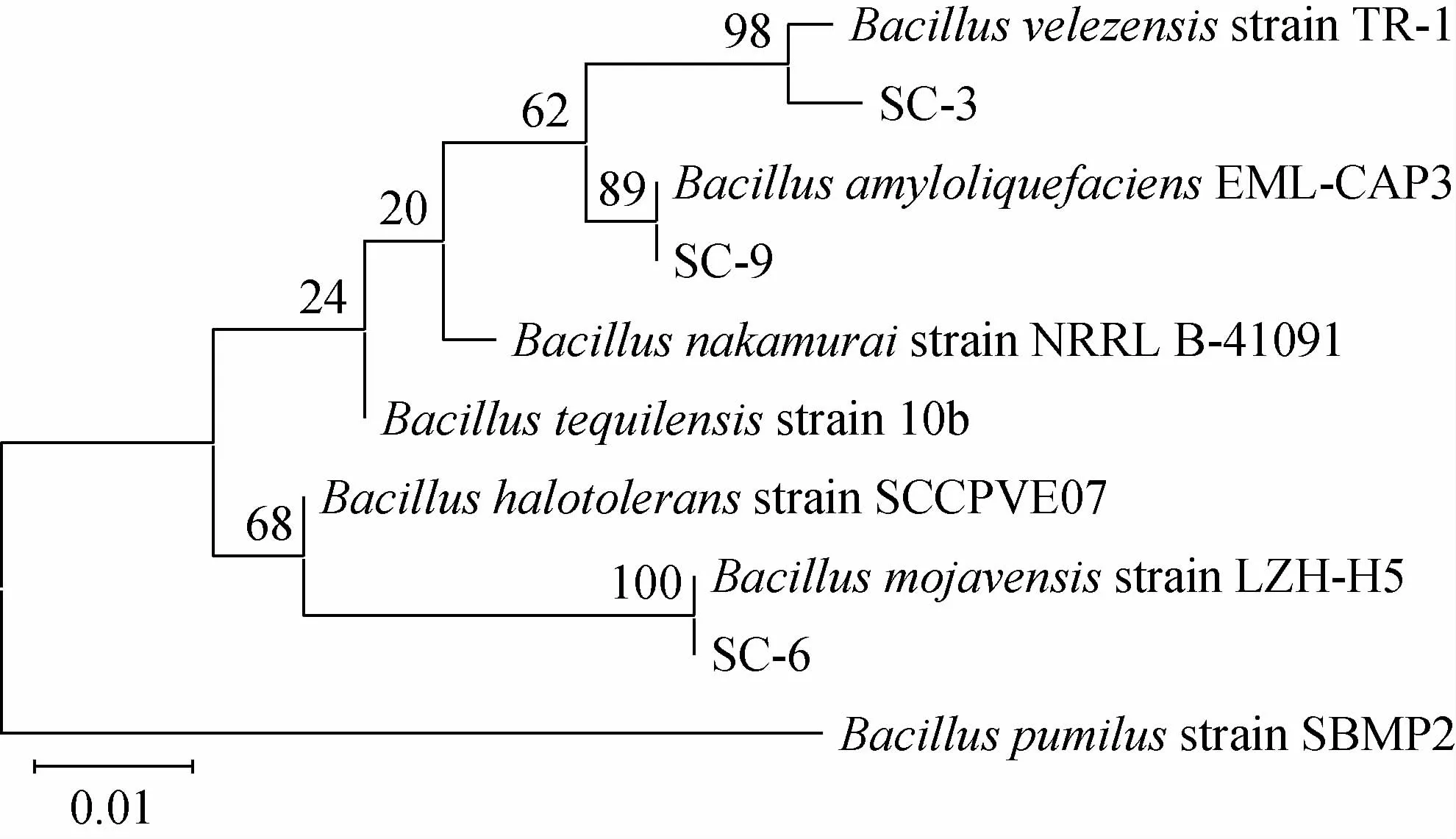
图4 3株拮抗细菌基于16S rDNA基因序列的系统发育树Fig.4 Phylogenetic tree of 3 antagonistic bacteria based on 16S rDNA gene sequence
2.3 拮抗细菌发酵产物的乙酸乙酯粗提物的拮抗活性筛选及成分分析
3株拮抗细菌的发酵产物用乙酸乙酯萃取得到其粗提物对金黄色葡萄球菌PJ-1的拮抗活性见图5。由图5可知,3株拮抗细菌发酵产物的乙酸乙酯粗提物中,贝莱斯芽孢杆菌SC-3对PJ-1的拮抗活性最好,抑菌率为75.04%;莫海威芽孢杆菌SC-6次之,抑菌率为64.93%;解淀粉芽孢杆菌SC-9对PJ-1不具有拮抗活性。因此选用贝莱斯芽孢杆菌SC-3的乙酸乙酯粗提物(AE)作为抗菌粗提物进行以下的机制研究。

图5 3株拮抗细菌乙酸乙酯粗提物对金黄色葡萄球菌PJ-1的拮抗活性Fig.5 Antagonistic activity of crude extracts of three antagonistic strains from ethyl acetate on Staphylococcus aureus PJ-1
2.4 贝莱斯芽孢杆菌SC-3发酵产物的乙酸乙酯粗提物成分分析
贝莱斯芽孢杆菌SC-3发酵产物乙酸乙酯粗提物的GC-MS分析总离子流色谱图见图6。由图6可知,用Data Analysis对各峰图进行分析,确定了AE的主要成分和其百分含量。主要成分见表1。
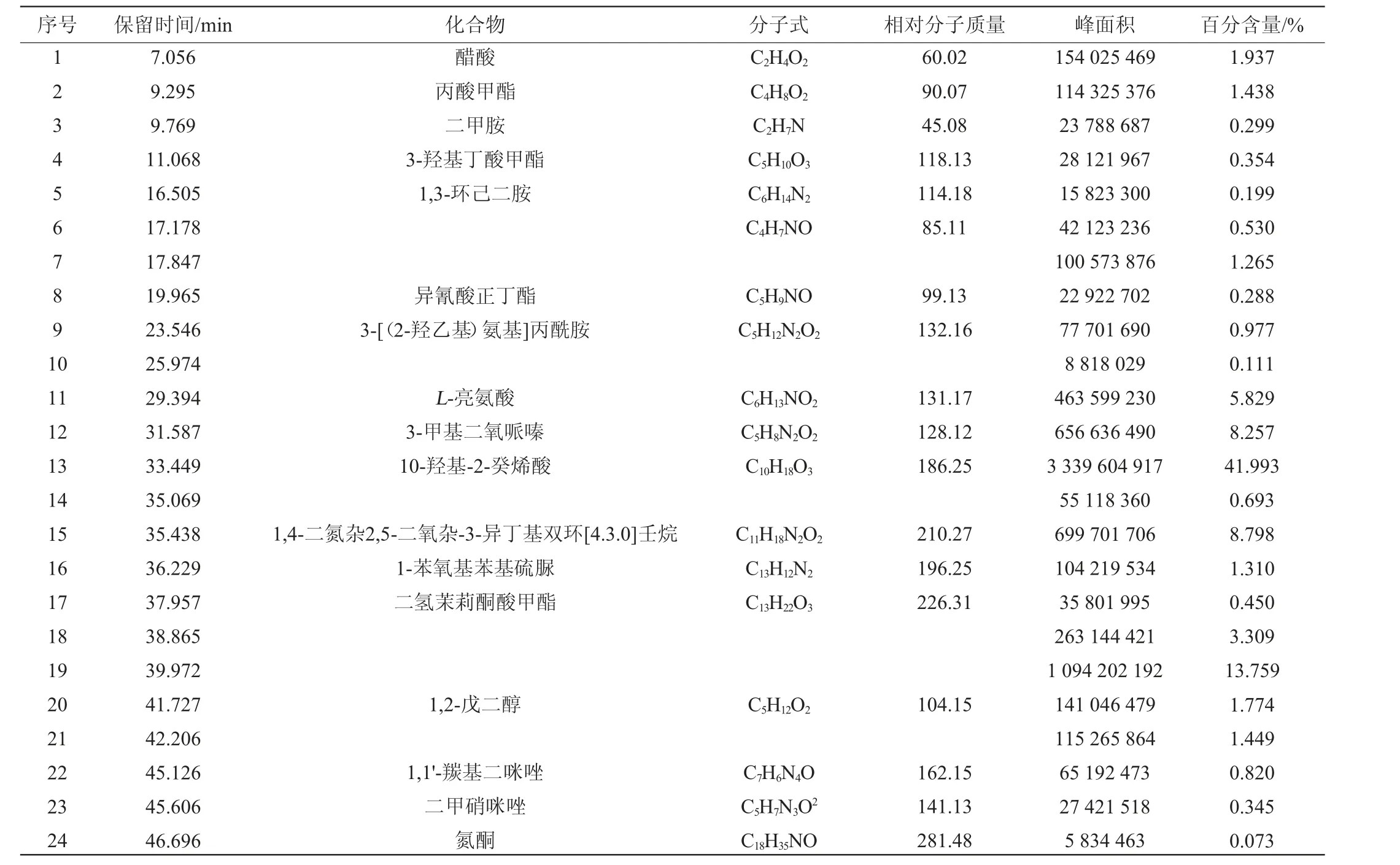
表1 贝莱斯芽孢杆菌SC-3发酵产物乙酸乙酯提取物的主要成分Table 1 Main components of acetate extract of Bacillus velezensis SC-3 fermentation product

图6 贝莱斯芽孢杆菌SC-3发酵产物的乙酸乙酯提取物的GC-MS分析总离子流色谱图Fig.6 Total ion chromatogram of ethyl acetate extract of Bacillus velezensis SC-3 fermentation product analysis by GC-MS
由表1可知,AE共检测出了24种化合物,鉴定出了17种主要成分,主要物质为10-羟基-2-癸烯酸(41.993%)、1,4-二氮杂2,5-二氧杂-3-异丁基双环[4.3.0]壬烷(8.798%)、3-甲基二氧哌嗪(8.257%)、L-亮氨酸(5.829%)、醋酸(1.937%)、1,2-戊二醇(1.774%)和丙酸甲酯(1.438%)等。
其中10-羟基-2-癸烯酸是一种生物活性物质,具有抗菌、抗氧化、提高人体免疫力等功能,可被应用于食品、医疗及日化等多个行业[20]。1,4-二氮杂2,5-二氧杂-3-异丁基双环[4.3.0]壬烷对肺炎克雷伯菌(Klebsiella pneumoniae)生物膜形成具有较强的抑制作用[21]。氧哌嗪类化合物常被用于革兰氏阴性细菌感染的疾病,也可用于球菌等感染的疾病,其抗菌谱广且过敏现象较少[22]。L-亮氨酸是人和动物自身不能合成的必需氨基酸之一,具有抗癌、抗病毒、抑制细菌生长等生物活性功能,人畜无害,常被作为食品添加剂应用于食品生产和加工[23]。一些特定的细菌可生产或分泌醋酸,有研究报道0.5%的醋酸浓度即可对细菌产生抑制作用[24]。1,2-戊二醇主要应用于杀菌剂丙环唑的制备,其次可应用于增塑剂、乳化剂、表面活性剂和婴儿护理产品等领域[25]。丙酸甲酯是一种具有多种用途的酯类原料,常用作萃取剂、食品或化妆品的香料、增塑剂等,具有安全无毒的特性[26]。因此可知AE中主要的物质为具有拮抗活性的安全物质,其具有一定的分离价值,有望作为抗菌药物运用在食源性金黄色葡萄球菌的防治上。
3 结论
本实验从自然发酵芥菜中分离出的细菌中,贝莱斯芽孢杆菌SC-3对PJ-1抑制效果最为显著。对贝莱斯芽孢杆菌SC-3的乙酸乙酯粗提物(AE)进行GC-MS分析得其中的主要物质为10-羟基-2-癸烯酸(41.993%)、1,4-二氮杂2,5-二氧杂-3-异丁基双环[4.3.0]壬烷(8.798%)、3-甲基二氧哌嗪(8.257%)、L-亮氨酸(5.829%)、醋酸(1.937%)、1,2-戊二醇(1.774%)和丙酸甲酯(1.438%)等,都是具有拮抗活性的安全物质,其具有一定的分离价值,有望作为抗菌药物运用在食源性金黄色葡萄球菌的防治上。

