侧柏叶颗粒剂对产气荚膜梭菌Ⅳ型菌毛系统功能的抑制作用及其机制
吴玉臣,朱先鹏,李有志,侯云峰,聂 婧,尚小雷,邓旭明,高 丰,吕强华,6*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.河南牧业经济学院,河南 郑州 450000;3.吉林省柳河县农业综合行政执法大队,吉林 柳河135300;4.山东省饲料兽药质量检验中心,山东 济南 250022;5.山东金铸基药业有限公司,山东 济南 271100;6.山东省农业科学院 畜牧兽医研究所,山东 济南 250100)
产气荚膜梭菌(C.perfringens)是1892年由WELCH等[1]在约翰霍普金斯医院的一起致命性主动脉瘤病例中首次分离得到的,也被称为魏氏梭菌。它是一种厌氧革兰阳性、产芽孢、大型杆状菌,广泛分布于人类和动物的胃肠道、食品和自然环境中[2]。目前,已知该菌产生的外毒素有12种(α、β、ε、ι、γ、δ、η、θ、κ、λ、μ和ν),根据外毒素不同可将其分为A~E 5种血清型[3]。产气荚膜梭菌属于典型的条件致病菌,既可导致地区性流行,又可引起散发性病例,每年都会造成大量人或动物感染和死亡。产气荚膜梭菌感染可引起人类和动物的多种疾病,如气性坏疽(人和动物)、坏死性肠炎(人和动物)、肠毒素血症(动物)、人类食物中毒、抗生素相关性腹泻和散发性非食源性疾病等[4]。在世界范围内,产气荚膜梭菌是引起食源性疾病暴发的重要病原之一,食源性传播是产气荚膜梭菌的主要传播途径,在英国和法国食源性疾病常见病因中位列第三,是美国食源性疾病的第二大常见致病菌[5]。
产气荚膜梭菌可引起鸡的坏死性肠炎,多见于2~6周龄的肉鸡,发病率和病死率都很高,病死率甚至可达50%,严重危害全球养鸡业的发展[6-7]。抗菌药的不合理使用和滥用,引发致病菌对多种抗菌药耐药[8-9],导致临床疗效下降甚至治疗失败。我国农业部于2017和2018年分别制定了《全国遏制动物源细菌耐药行动计划(2017—2020年)》[10]和《兽用抗菌药使用减量化行动试点工作方案(2018—2021年)》[11],禁止在饲料端使用抗菌促生长剂,鸡坏死性肠炎的发病率呈明显上升趋势[12]。随着“减抗和限抗”政策的实施必然对临床鸡坏死性肠炎为代表的产气荚膜梭菌感染造成巨大困扰,寻求新型抗菌药物或抗菌策略对抗耐药菌的感染迫在眉睫。研究表明,产气荚膜梭菌在宿主肠道黏附过程主要依赖于菌体表面的Ⅳ型菌毛系统(type Ⅳ pili,TFP)[13],通过依赖于TFP促进细菌在宿主肠道内的定植、存活和复制增殖[14]。TFP在多种血清型产气荚膜梭菌中保守存在,相比常规抗生素直接杀菌或抑菌的作用机制,以此为靶标的药物研发成为一种理想策略。
在前期研究中,通过以TFP作为药物筛选靶标,建立了产气荚膜梭菌TFP抑制剂的筛选平台,在中药来源的天然化合物中进行大量筛选,最终获得了活性良好的穗花衫双黄酮。结合危害养鸡业的产气荚膜梭菌现状,开发一种安全有效、疗效确切、机制明确和无药残的新型中兽药制剂。查阅大量文献可知,侧柏叶中穗花衫双黄酮含量较高,可作为中药制剂的候选中药材。侧柏叶,为柏科植物侧柏Platycladusorientalis(L.)Franco的干燥枝梢和叶,一般采收于夏、秋两季。侧柏叶颗粒剂作为一种新型中兽药制剂,目前未见抗产气荚膜梭菌感染的报道。接下来,拟在前期基础之上研究侧柏叶颗粒剂对产气荚膜梭菌TFP功能的抑制作用及机制,为临床产气荚膜梭菌感染的防控提供候选“减抗”中兽药制剂和理论依据。
1 材料与方法
1.1 菌株、细胞及主要试剂侧柏叶颗粒剂(批号:202012001),由保定冀中生物科技有限公司中试生产;产气荚膜梭菌ATCC13124菌株,购自美国模式培养物集存库(ATCC);BHI培养基、TSB培养基、厌氧产气包、血红素、维生素K1,购自青岛海博生物技术有限公司;结晶紫试剂,购自Sigma;结肠癌细胞系Caco-2细胞,购自中国科学院上海生命科学院细胞资源中心;RPMI-1640培养基、胎牛血清、胰蛋白酶,购自Gibco;Triton X-100,购自北京鼎国昌盛生物技术有限公司。

A.侧柏叶颗粒对产气荚膜梭菌在半固体培养基上滑动运动的影响;B.滑动运动率统计。NS.P>0.05;*.P<0.05;**.P<0.01。下同
1.2 主要仪器超净工作台(SW-CJ-IF)、恒温培养箱(HPS250)和生物安全柜(HDL2600),购自哈尔滨东联有限公司;恒温振荡器(THZ-82),购自上海跃进医疗器械厂;电子天平(BSA124S/224S-CW),购自德国赛多利斯;全自动样品快速研磨仪(JXFSTPRP-24),购自上海净信生物科技有限公司;免疫荧光显微镜(IX-83),购自日本奥林巴斯;电泳仪(PowerPacBasic)、小型垂直电泳槽(Mini Gel Tank)、半干转转膜仪(170-3940)和荧光定量PCR仪(CFX96),购自美国Bio-Rad;化学发光成像系统(Tanon 4200),购自上海天能科技有限公司;透射电镜(HT8700),购自日本日立。
1.3 侧柏叶颗粒对产气荚膜梭菌TFP表型功能的影响
1.3.1滑动运动试验 产气荚膜梭菌ATCC13124接种至BHI液体培养基,置于2.5 L厌氧培养箱中37℃过夜培养。取1 mL过夜培养菌液,10 000 r/min离心5 min,重悬于100 μL BHI培养基中,将10 μL菌悬液滴至0.7% BHI琼脂平板中央,分别设置为阳性对照组(不含侧柏叶颗粒剂)、侧柏叶颗粒剂组(0.7% BHI琼脂平板中含侧柏叶颗粒,质量浓度为1.3 g/L)和DMSO对照组(0.7% BHI琼脂平板中含等体积的DMSO溶剂),置于2.5 L厌氧培养箱中37℃静置培养72 h后,测定滑动运动数据,并采集图像。
1.3.2生物被膜试验 取1 mL过夜培养菌液6 000 r/min离心10 min,PBS洗涤3次,重悬于TSB培养基中,调至D600 nm=0.1,加入24孔板内,每孔400 μL。分别加入不同体积的侧柏叶颗粒贮存液,使其终质量浓度分别为0,0.65和1.30 g/L,设阳性对照组(不含侧柏叶颗粒)和阴性对照组(不含菌液和侧柏叶颗粒),置于2.5 L厌氧培养箱中30℃静置培养120 h。弃掉培养过后24孔板内上清,PBS洗涤3次,置于37℃电热恒温干燥箱烘干1 h,加入400 μL 结晶紫(0.1%),室温染色1 h,PBS洗涤3次,加入33%乙酸400 μL溶解混匀后取100 μL 置于新96孔板中,测定D570 nm值,根据下列公式计算生物被膜形成率。生物被膜形成率=(D570 nm 样品组-D570 nm 阴性组)/(D570 nm 阳性组-D570 nm 阴性组)×100%,以阳性对照组为100%计算。
1.4 侧柏叶颗粒对产气荚膜梭菌黏附至Caco-2细胞的影响
1.4.1细胞培养 将Caco-2细胞培养于含10%胎牛血清及100 U/mL青霉素和100 U/mL链霉素的1640培养基中,于37℃和5% CO2培养箱培养16 h。
1.4.2菌悬液的制备 产气荚膜梭菌ATCC13124接种至BHI液体培养基中,置于2.5 L厌氧培养箱中37℃过夜培养。次日,用BHI调至D600 nm=0.4备用。
1.4.3LDH法检测侧柏叶颗粒对Caco-2细胞的毒性 将Caco-2细胞接种于96孔培养板中,密度为2×104cells /孔,置于37℃和 5% CO2培养箱过夜培养。弃掉培养基,加入1640培养基,加药,设阳性对照组(0.2% TritonX-100)、阴性对照组(仅含1640培养基)、药物组(侧柏叶颗粒终质量浓度分别为0,0.65,1.30,2.60和5.20 g/L),每组3个重复,置于37℃和5% CO2培养箱培养6 h。1 000 r/min离心10 min,取100 μL上清液至新96孔板,向各孔内加入LDH工作液100 μL,避光孵育30 min。用酶标仪测定各孔D492 nm值,计算样品的LDH释放率。LDH释放率=(D492 nm 处理组-D492 nm 阴性组)/(D492 nm 阳性组-D492 nm 阴性组)×100%,以阳性对照组LDH释放率为100%计算。
1.4.4侧柏叶颗粒对产气荚膜梭菌黏附至Caco-2细胞的影响 Caco-2细胞接种于24孔培养板中,密度为3×105cells/mL,置于37℃和 5% CO2培养箱过夜培养;每孔加入10 μL菌悬液,分为阳性对照组、阴性对照组和药物组。1 000 r/min离心10 min后37℃静置培养2 h;用灭菌PBS洗去未黏附细菌,每孔洗3次,加入1 mL高压灭菌的蒸馏水,震荡5 min充分释放和裂解细胞,倍比稀释涂布于BHI平板,37℃厌氧过夜培养,计数菌落形成单位(CFU)。黏附率=处理组CFU/阳性对照组CFU×100%。
1.5 侧柏叶颗粒对产气荚膜梭菌TFP基因转录和菌毛形态的影响
1.5.1qRT-PCR检测产气荚膜梭菌TFP基因转录 产气荚膜梭菌ATCC13124置于BHI培养基过夜培养,第2天20倍稀释扩培,加入终质量浓度为0和1.30 g/L的侧柏叶颗粒,37℃厌氧培养4 h。使用TRIzol法提取细菌总RNA,使用反转录试剂盒反转录成cDNA,配制RT-PCR反应体系见表1,使用Bio-Rad CFX96荧光定量PCR仪进行检测,qRT-PCR反应条件见表2。引物由上海生工生物科技有限公司合成,序列信息见表3。试验完毕,按照2-△△Ct法对数据进行统计分析。

表1 qRT-PCR反应体系

表2 qRT-PCR反应条件

表3 引物序列信息
1.5.2侧柏叶颗粒对产气荚膜梭菌TFP形态的影响 使用BHI培养基将产气荚膜梭菌过夜培养物的D600 nm调整至0.1,取6 mL调后的菌液,分装至2个试管,每管2 mL,向其中分别加入侧柏叶颗粒贮存液,使其终质量浓度为1.3 g/L,同时等量DMSO的对照组,37℃静置厌氧培养8 h。在4℃和10 000 r/min条件下离心10 min,弃上清,收集菌体,PBS洗涤3次,弃上清。使用负染色法处理样品,在透射电镜(TEM)下观察产气荚膜梭菌菌体TFP的形态。
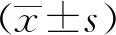
2 结果
2.1 侧柏叶颗粒对产气荚膜梭菌TFP表型功能的影响
2.1.1侧柏叶颗粒抑制产气荚膜梭菌的滑动运动 如图1所示,经37℃厌氧培养72 h后,产气荚膜梭菌ATCC13124在0.7% BHI琼脂平板呈现滑动运动趋势。相比于阳性对照组,侧柏叶颗粒处理组滑动运动半径明显减小,差异显著;DMSO组滑动运动趋势与阳性对照组无统计学差异。结果表明,侧柏叶颗粒显著抑制产气荚膜梭菌的滑动运动。
2.1.2侧柏叶颗粒抑制产气荚膜梭菌生物被膜的形成 如图2所示,与阳性对照组相比,在侧柏叶颗粒的质量浓度范围内(0.65~2.60 g/L),产气荚膜梭菌生物被膜的形成率呈剂量性降低,表明侧柏叶颗粒显著抑制产气荚膜梭菌生物被膜形成。
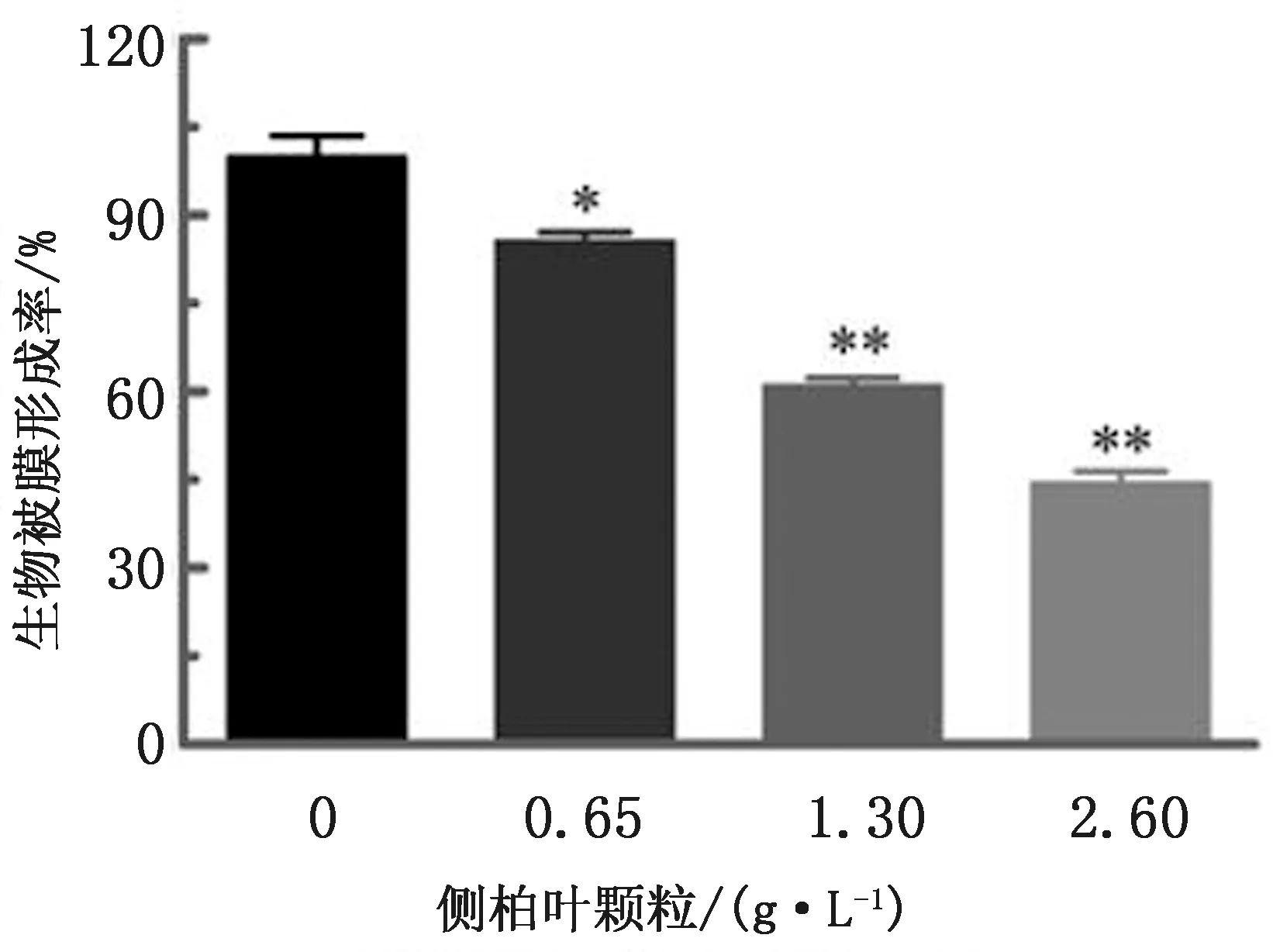
图2 侧柏叶颗粒抑制产气荚膜梭菌生物被膜形成
2.2 侧柏叶颗粒对产气荚膜梭菌黏附至Caco-2细胞的影响
2.2.1侧柏叶颗粒对Caco-2细胞无明显检测毒性 如图3所示,与阴性对照组相比,不同质量浓度的侧柏叶颗粒处理Caco-2细胞后,培养体系中LDH释放率差异并不显著,表明在受试质量浓度范围内(0.65~5.20 g/L),侧柏叶颗粒对Caco-2细胞无可检测细胞毒性。
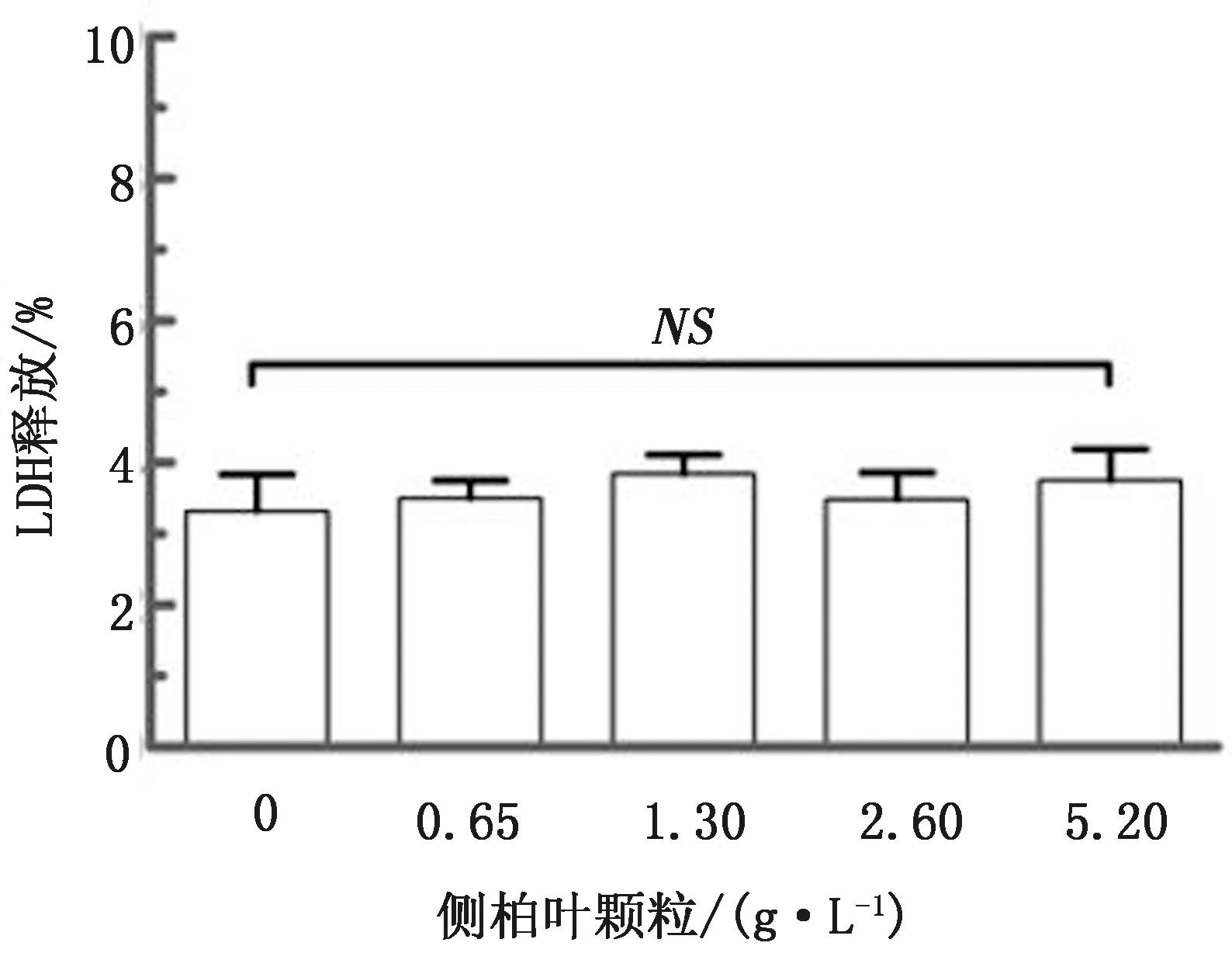
图3 侧柏叶颗粒对Caco-2细胞的细胞毒性
2.2.2侧柏叶颗粒剂抑制产气荚膜梭菌黏附至Caco-2细胞 如图4所示,阳性对照组黏附率为(71.05±3.70)%,不同质量浓度侧柏叶颗粒组的黏附率分别为(51.15±2.23)%和(39.73±2.03)%,相比阳性对照组黏附率显著降低。结果表明,侧柏叶颗粒显著抑制产气荚膜梭菌黏附至Caco-2细胞。
图4 侧柏叶颗粒对产气荚膜梭菌黏附至Caco-2细胞的抑制作用
2.3 侧柏叶颗粒对产气荚膜梭菌TFP基因转录和菌毛形态的影响
2.3.1侧柏叶颗粒对产气荚膜梭菌TFP基因转录的影响 由图5可知,质量浓度为1.3 g/L的侧柏叶颗粒显著降低产气荚膜梭菌TFP相关基因virR、virS、pilA、pilD、pilT、pilC和pilM的mRNA转录。
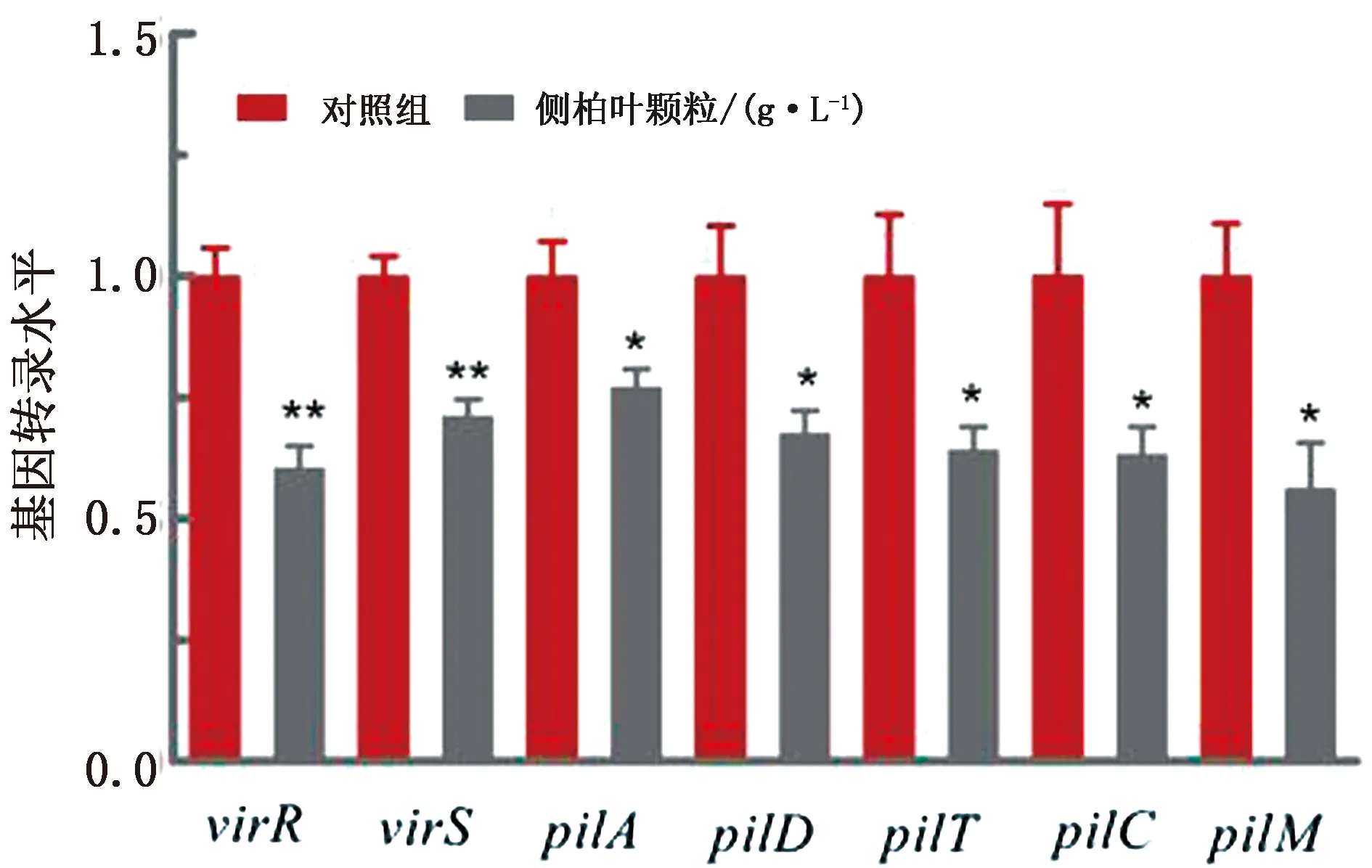
图5 侧柏叶颗粒对产气荚膜梭菌TFP相关基因转录的影响
2.3.2侧柏叶颗粒对产气荚膜梭菌TFP形态的影响 由图6可知,在10 000倍视野中,阳性对照组菌体边缘可见纤维状菌毛存在,菌体周身呈绒毛状;经侧柏叶颗粒(1.3 g/L)处理后,菌体边缘几乎无纤维状菌毛存在,菌体周身光滑。结果表明侧柏叶颗粒可以抑制产气荚膜梭菌TFP菌毛的形态,导致TFP结构缺失。
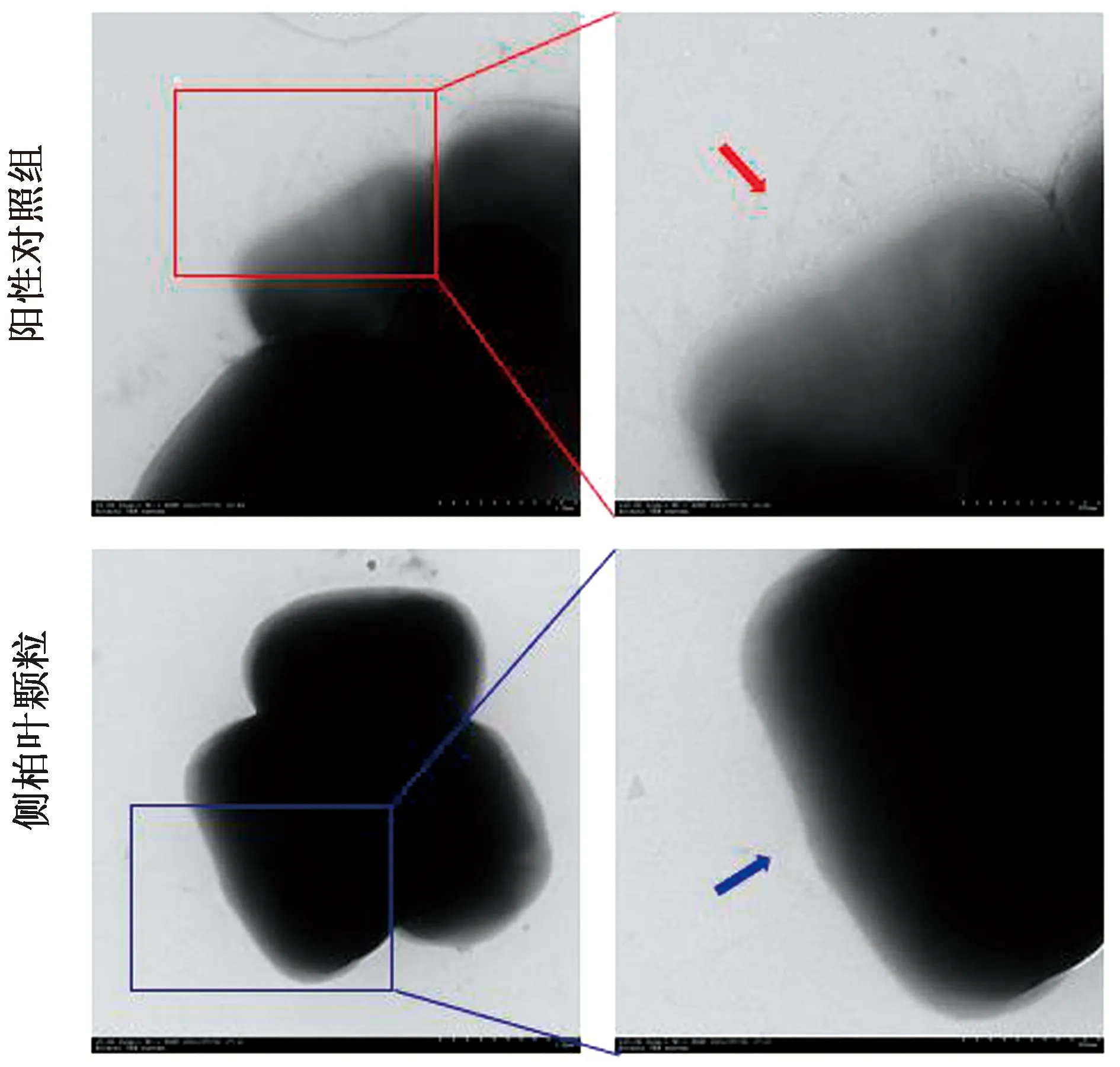
注:左侧图(×5 000);右侧图(×10 000)
3 讨论
“减抗和限抗”的政策法令实施之前,畜牧生产中主要通过在饲料中添加抗生素来预防和控制病原微生物的感染,同时作为促生长剂,提升动物的生产性能,如杆菌肽和维吉尼亚霉素的应用等。随着饲料端禁抗措施的实施,无疑给抗生素的研发、使用和销售及临床畜禽细菌性疾病的防控提出了新的挑战。产气荚膜梭菌导致的鸡坏死性肠炎持续困扰养殖业的健康发展,抗生素的研发周期漫长和投资逐年增加的特点,导致新型抗生素的研发进入困境。开发新型治疗策略或研制抗生素替代药物进行畜禽疾病防控成为公认的思路。相比于传统抗生素直接抑菌/抗菌的作用机制,通过抑制细菌生命过程非必需成分(如溶血素、菌毛、鞭毛和产气荚膜梭菌TFP)为靶标的抗毒力药物研发成为研究热点。近年来,已有许多以细菌毒力因子为靶标的天然化合物和小分子抑制剂陆续被报道出来[15-17],也为新型药物研发提供了科学范例。我国中药资源和应用历史悠久,尤其清热解毒或补中益气等药性的中药及方剂为抗感染药物研发和临床应用奠定了基础。中药具备来源广、活性丰富、成本低、无药物残留和绿色环保等优势,为抗细菌感染新药研发提供了良好的资源宝库。随着如今人们生活水平的提高和环保意识的增强,对绿色健康养殖和动物性产品的安全性要求提出了新的要求,开发新型兽用中药制剂成为抗生素替代药物研发的突破点。本研究正是基于前期研究基础,通过建立靶向产气荚膜梭菌TFP的小分子抑制剂筛选平台,在中药来源的天然化合物中进行筛选,获得了活性良好的穗花衫双黄酮。通过选择成药性良好的侧柏叶作为理想中药材,经过提取工艺、处方工艺和制剂工艺研究制备出适合规模化养鸡场群体给药的侧柏叶颗粒制剂,旨在研发含量较高、活性良好和含量稳定的防治鸡坏死性肠炎的新型兽用制剂。
为了阐明侧柏叶颗粒剂的药理活性和作用机制,在前期研究基础之上进行了后续研究。首先,通过滑动运动和生物被膜测试2种表型验证侧柏叶颗粒对产气荚膜梭菌TFP功能的抑制作用;随后,通过细胞黏附试验测定侧柏叶颗粒抑制产气荚膜梭菌黏附至Caco-2细胞的作用;最后,借助qRT-PCR测定侧柏叶颗粒对TFP相关基因转录的影响,结合透射电子显微镜(TEM)观察侧柏叶颗粒处理对产气荚膜梭菌TFP形态的影响,通过以上研究确证了侧柏叶颗粒对产气荚膜梭菌TFP功能的抑制作用,阐明抑制产气荚膜梭菌TFP介导功能的作用机制。综上所述,该研究为产气荚膜梭菌感染的鸡坏死性肠炎防治提供了新型中兽药制剂,也为侧柏叶颗粒剂的临床开发和应用提供了科学依据。

