不同方法对蒲公英多糖脱色工艺条件优化的研究
周 彤,闫寒汐,朱李想,张 睿,胡佳悦,吴 萧
(宿州学院生物与食品工程学院,安徽 宿州 234000)
0 引言
蒲公英,又名苏叶、野苏、皱苏等,属于一年生直立草本植物,其叶、茎、根等均可入药,是药食两用的60 种中药之一[1]。蒲公英叶又叫苏叶,含有多酚、蒲公英醛、黄酮类、色素类等多种生物活性物质,具有抗炎、治风寒、宜肺止咳、安胎、清热解毒等功能[2]。蒲公英叶多糖中含有许多花色素苷,包括9 种花色素苷及其顺式异构体,其中属丙二酰基蒲公英宁和蒲公英宁含量最多[3],使蒲公英叶多糖提取液呈黑、红紫色,颜色较深,影响其纯度,不利于多糖的研究和应用。
对蒲公英多糖的脱色进行研究。关于多糖的脱色现在大多有物理和化学2 种方法。化学方法是利用物质的强氧化性破坏色素的结构而使其脱色,如次氯酸,但这种方法很容易破坏物质成分。物理方法是利用吸附能力来吸附色素颗粒使其脱色[4],其成本低、影响小。常用的吸附剂有树脂[5-7]和活性炭[8-9]。主要用蒲公英叶多糖提取液为研究对象,以多糖提取液的脱色率和多糖损失率作为指标,在活性炭添加量、加热时间、加热温度、pH 值各单因素基础下,比较粉末状活性炭和LSA-200B 型树脂作为吸附剂的2 种脱色方法,得出蒲公英叶多糖提取液脱色的最佳办法。最后用响应面法[10]优化最佳脱色方法的工艺条件,得出对蒲公英叶多糖提取液的最优脱色工艺。
1 材料与方法
1.1 材料
蒲公英全草,北京同仁堂宿州药店提供;粉末状活性炭,国药集团化学试剂有限公司提供;LSA-200B 型大孔吸附树脂,郑州和成新材料科技有限公司提供。
1.2 试剂
葡萄糖标准品、浓硫酸,国药集团化学试剂有限公司提供;苯酚,麦克林有限公司提供;盐酸,上海振企化学试剂有限公司提供;PBS 缓冲液,生工生物工程股份有限公司提供。
1.3 试验方法
1.3.1 蒲公英多糖提取液的提取及脱色工艺流程
(1) 工艺流程。
蒲公英全草→粉碎→过筛→提取→提滤→蒲公英多糖提取液→活性炭、树脂脱色→蒲公英多糖脱色液。
(2) 操作要点。将干燥的蒲公英全草用多功能粉碎机粉碎,过80 目筛,得到蒲公英粉,在密封干燥的条件下保存备用。精确称取2.0 g 粉末,按一定比例加入蒸馏水,采取超声波法[11]提取蒲公英多糖,保持超声温度为60 ℃,提取时间为2 h,抽滤得到蒲公英多糖提取液,分别添加粉末状活性炭、LSA-200B 型树脂进行脱色处理,得到蒲公英多糖脱色液。
1.3.2 标准曲线的绘制
准确称取葡萄糖标准品0.005 g 置于烧杯中,加入蒸馏水溶解,转入容量瓶中,再加蒸馏水定容至50 mL,摇匀,得到质量浓度为100 μg/mL的葡萄糖标准溶液。分别吸取0,1,2,3,4,5,6 mL 上述葡萄糖标准溶液于7 支试管中,加蒸馏水至10 mL,分别得到质量浓度为0,10,20,30,40,50,60 μg/mL的葡萄糖标准品溶液。各取2 mL 的葡萄糖标准品溶液放入试管,向每只试管加入质量分数为6%的苯酚溶液1 mL,之后再加入浓硫酸溶液5 mL,摇匀,室温反应30 min。将反应液于波长490 nm 处,用零号管作空白对照,测定溶液吸光度。每组做3 次平行试验,取平均值。多糖含量为横坐标,吸光度为纵坐标,绘制标准曲线,拟合出回归方程。
1.3.3 蒲公英叶多糖脱色率的计算
(1) 蒲公英叶多糖提取液吸收峰的检测。将蒲公英叶多糖提取液经全波段扫描,设置参数:中速扫描、波长间隔1.0 nm、波长范围190.0~1 100.0 nm。结果显示,在波长330 nm 处有吸收峰,故以该波长作为检测波长[4]。
(2) 多糖脱色率公式。
式中:A0——脱色前吸光度;
A1——脱色后吸光度[5]。
1.3.4 蒲公英叶多糖损失率的计算
样品多糖含量测定用苯酚- 硫酸法[12]。按下式计算多糖损失率。
式中:m0——原样品多糖含量,g;
m1——脱色处理后多糖含量,g。
1.3.5 单因素试验
(1) 脱色剂添加量对蒲公英多糖脱色工艺的影响。在蒲公英多糖提取液的稀释液(调整pH 值至6.5) 中分别添加粉末状活性炭、LSA-200B 型树脂。其添加量分别为0.25%,0.50%,0.75%,1.00%,1.25%,2.00%。置于40 ℃水浴锅中加热20 min。之后对其抽滤,测定吸光度,3 组平行取平均值,计算蒲公英多糖提取液的脱色率和多糖损失率。
(2) 加热时间对蒲公英多糖脱色工艺的影响。粉末状活性炭、LSA-200B 型树脂添加量为0.75%。分别在40 ℃水浴锅中加热5,10,15,20,25,30 min。其余步骤同1.3.5(1)。
(3) 温度对蒲公英多糖脱色工艺的影响。粉末状活性炭、LSA-200B 型树脂添加量为0.75%。分别于30,40,50,60,70,80 ℃水浴锅中加热20 min。其余步骤同1.3.5(1)。
(4) pH 值对蒲公英多糖脱色工艺的影响。用缓冲液调整蒲公英多糖提取液的pH 值分别为5.0,5.5,6.0,6.5,7.0,7.5,粉末状活性炭、LSA-200B型树脂添加量为0.75%。分别于40 ℃水浴锅中加热20 min。其余步骤同1.3.5(1)。
1.3.6 响应面分析
根据上述在活性炭添加量、加热时间、加热温度、pH 值各单因素试验下,比较粉末状活性炭和LSA-200B 型树脂作为吸附剂的2 种脱色方法,得出粉末状活性炭对多糖进行脱色是蒲公英多糖提取液的最佳脱色方法,用响应面法[10]进一步优化粉末状活性炭脱色方法的工艺条件。
响应面因素与水平设计见表1。

表1 响应面因素与水平设计
2 结果与分析
2.1 葡萄糖标准曲线的测定结果
按照上述1.3.2 方法,测出试验数据,绘出标准曲线。
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线
由图1 可知,葡萄糖的标准曲线的回归方程为:Y=0.011 2X-0.073(相关系数R2=0.994 9)。
2.2 单因素试验结果
2.2.1 脱色剂添加量对蒲公英多糖脱色工艺的影响
脱色剂添加量对蒲公英多糖脱色率和损失率的影响。根据上述1.3.5(1) 方法,测出其吸光度,根据试验数据绘出曲线。
脱色剂添加量对蒲公英叶多糖脱色率的影响见图2,脱色剂添加量对蒲公英多糖的多糖损失率的影响见图3。
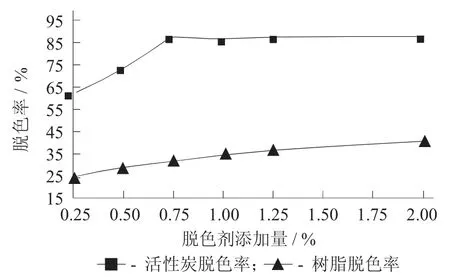
图2 脱色剂添加量对蒲公英叶多糖脱色率的影响
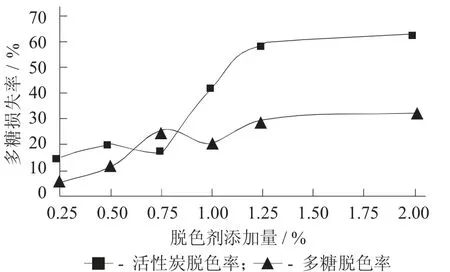
图3 脱色剂添加量对蒲公英多糖的多糖损失率的影响
由图2 可知,当活性炭添加量达到0.75%时,其脱色率最大,达到了86.7%。在相同的条件下,树脂的脱色率最高仅为40%。
由图3 可知,当活性炭添加量为0.75%时多糖损失率最低,仅为18%。在相同的条件下,树脂的多糖损失率总体要比活性炭中损失的小。
综合图2,图3 来看,相同条件下,活性炭对蒲公英多糖脱色效果比树脂好。当活性炭添加量为0.75%时,多糖脱色率为86.2%,多糖损失率仅为18%,此时活性炭脱色效果最佳。
2.2.2 加热时间对蒲公英多糖脱色工艺的影响
加热时间对蒲公英多糖脱色率和损失率的影响。根据上述1.3.5(2) 方法,测出其吸光度,根据试验数据绘出曲线。
加热时间对蒲公英叶多糖脱色率的影响见图4,加热时间对蒲公英叶多糖损失率的影响见图5。

图4 加热时间对蒲公英叶多糖脱色率的影响

图5 加热时间对蒲公英叶多糖损失率的影响
由图4 可知,当加热20 min 时,活性炭脱色率最好,为93.3%。在相同的条件下,树脂的脱色率最高为12.7%。
由图5 可知,当加热20 min 时,多糖损失率最小,仅为18.6%。在相同的条件下,树脂的多糖损失率总体比在活性炭中损失的小。
综合图4,图5 来看,相同条件下,活性炭对蒲公英叶多糖脱色效果比树脂好。当加热时间为20 min时,多糖脱色率为93.3%,多糖损失率仅为18.6%,此时活性炭脱色效果最佳。
2.2.3 加热温度对蒲公英多糖脱色工艺的影响结果
加热温度对蒲公英多糖脱色率和损失率的影响。根据上述1.3.5(3) 方法,测出其吸光度,根据试验数据绘出曲线。
加热温度对蒲公英叶多糖脱色率的影响见图6,加热温度对蒲公英叶多糖损失率的影响见图7。

图6 加热温度对蒲公英多糖脱色率的影响

图7 加热温度对蒲公英叶多糖的多糖损失率的影响
由图6 可知,当加热温度为60 ℃时,活性炭脱色率最高,达到94.3%。在相同的条件下,树脂的脱色率最高只达到了8.7%。
由图7 可知,当加热温度在60 ℃时,活性炭的多糖损失率最小,仅为20.4%。在相同的条件下,树脂的多糖损失率总体比在活性炭中损失的小。
综合图6,图7 来看,相同条件下,活性炭对蒲公英叶多糖脱色效果比树脂好。当加热温度为60 ℃时,多糖脱色率为94.3%,多糖损失率仅到20.4%,此时活性炭脱色效果最佳。
2.2.4 pH 值对蒲公英多糖脱色工艺的影响
pH 值对蒲公英多糖脱色率和损失率的影响。根据上述1.3.5(3) 方法,测出其吸光度,根据试验数据绘出曲线。
pH 值对蒲公英多糖脱色率的影响见图8,pH 值对蒲公英多糖损失率的影响见图9。
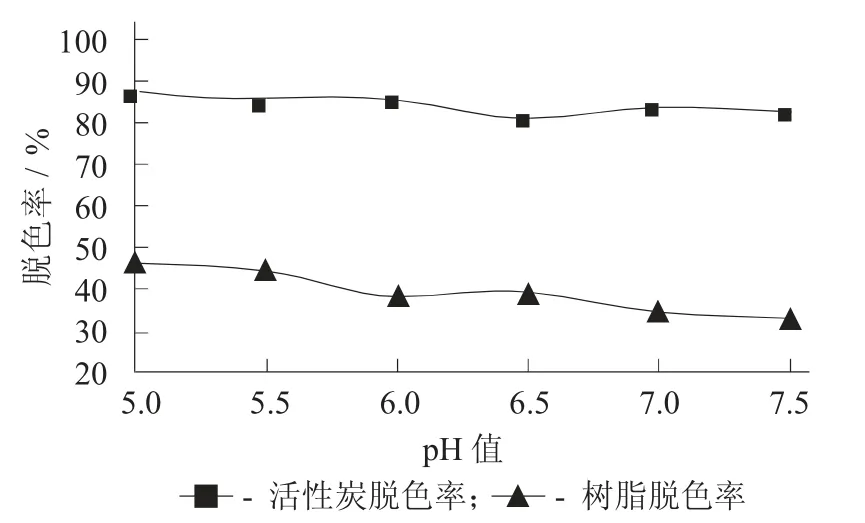
图8 pH 值对蒲公英多糖脱色率的影响

图9 pH 值对蒲公英多糖损失率的影响
由图8 可知,当pH 值为5 时,活性炭脱色率最高,达到87.1%。在相同的条件下,树脂的脱色率最高只达到了14.3%。
由图9 可知,当pH 值为5.5 时,活性炭多糖损失率最小,仅为20.5%。在相同的条件下,树脂最小多糖损失率为26.7%。
综合图8,图9 来看,相同条件下,活性炭对蒲公英叶多糖脱色效果比树脂好。当pH 值为5.5 时,多糖脱色率为85.6%,多糖损失率仅到20.5%,此时活性炭脱色效果最佳。
综合加热时间、活性炭添加量、加热温度、pH值4 个单因素下蒲公英多糖脱色率和多糖损失率来看,用活性炭脱色比用树脂脱色的效果好。因此,采用响应面法对活性炭脱色的方法做进一步的条件优化的研究。
2.3 响应面试验结果与分析[14-16]
2.3.1 响应面试验设计与结果
以活性炭添加量、加热时间、加热温度、pH 值4 个因素进行单因素响应面试验设计与分析。
响应面设计与分析见表2。

表2 响应面设计与分析
2.3.2 模型回归的拟合
多元回归分析后,得到的二次多项方程式分别为:
由方程可知,加热温度与pH 值之间的交互效果对多糖脱色率的作用最大,活性炭添加量与加热温度之间的交互效果对多糖脱色率的作用最小;加热时间与pH 值之间的交互效果对多糖损失率的作用最大,活性炭添加量与pH 值之间的交互效果对多糖损失率的作用最小。
2.3.3 模型有效性的检验
为检验模型的有效性,对响应面法模型进行方差分析。
蒲公英叶多糖提取液脱色率的回归模型方差分析与系数显著性检验见表3,蒲公英叶多糖提取液的多糖损失率的回归模型方差分析与系数显著性检验见表4。
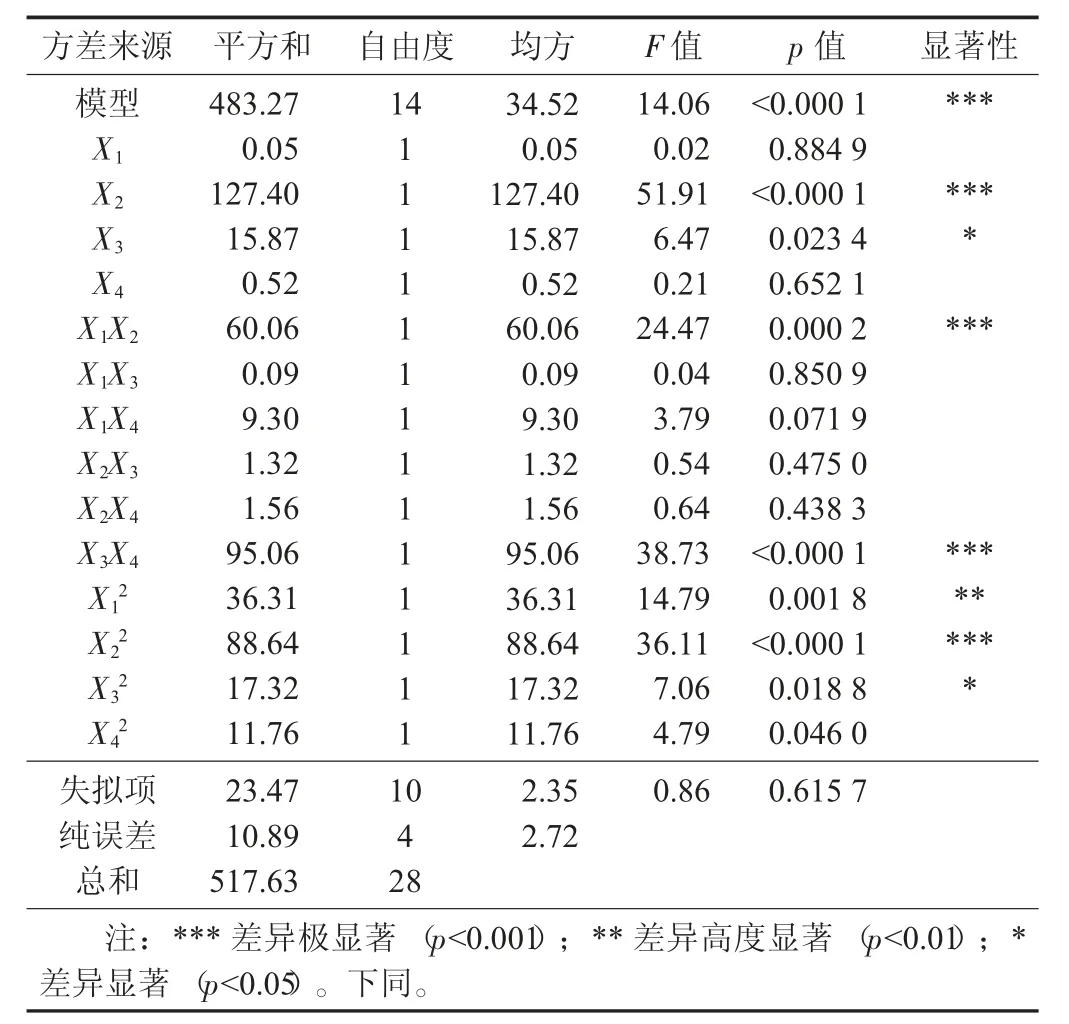
表3 蒲公英叶多糖提取液脱色率的回归模型方差分析与系数显著性检验
由表3 可知,模型显著性p<0.000 1,模型极显著,则该模型有效;并且失拟差p=0.615 7>0.05,即不显著,所以回归方程模型与真实的试验数值差别较小。相关系数为R2=0.933 6,表明该回归方程模型的拟合度良好,该试验误差少,模型可用于分析每个影响因素对蒲公英叶多糖提取液的脱色率的影响情况。
由表4 可知,回归方程的模型显著性p<0.000 1,模型极显著,则该模型有意义;并且失拟差p=0.215 9>0.05,即不显著,所以回归方程模型与实际的试验数值差异较小。相关系数为R2=0.939 6,说明该回归方程模型有良好的拟合程度,试验误差少,此模型可用于分析每个影响因素对蒲公英叶多糖提取液的多糖损失率的影响情况。
2.3.4 响应面分析
活性炭添加量和加热时间对蒲公英叶多糖脱色效果的交互作用见图10,活性炭添加量和加热温度对蒲公英叶多糖脱色效果的交互作用见图11,活性炭添加量和pH 值对蒲公英叶多糖脱色效果的交互作用见图12,加热时间和加热温度对蒲公英叶多糖脱色效果的交互作用见图13,加热时间和pH 值对蒲公英叶多糖脱色效果的交互作用见图14,加热温度和pH 值对蒲公英叶多糖脱色效果的交互作用见图15。

图10 活性炭用量和加热时间对蒲公英叶多糖脱色效果的交互作用

图11 活性炭用量和加热温度对蒲公英叶多糖脱色效果的交互作用

图12 活性炭添加量和pH 值对蒲公英叶多糖脱色效果的交互作用

图13 加热时间和加热温度对蒲公英叶多糖脱色效果的交互作用
由图10(a) 可知,蒲公英叶多糖提取液的脱色率随活性炭添加量的增加先缓慢上升然后趋于稳定;蒲公英叶多糖提取液的脱色率随加热时间的增加明显增加,曲线变化较为陡峭,说明加热时间对多糖提取液的脱色率作用十分明显。观察等高线图得出两者的交互效果极显著,说明脱色率主要受活性炭添加量和加热时间的共同影响。由图10(b) 可知,活性炭添加量对蒲公英叶多糖提取液的多糖损失率的作用明显,而多糖损失率伴随加热时间的增加先增大后降低,说明对多糖损失率的影响也显著。但是,观察等高线图得出两者的交互效果不显著,说明多糖损失率主要受用量影响。
由图11(a) 可知,活性炭添加量的变化对多糖提取液的脱色率作用明显,而脱色率随着加热时间的增加没有显著的变化。观察等高线图得出两者的交互效果不显著,说明脱色率主要受用量影响。由图11(b) 可知,活性炭添加量和加热温度对多糖损失率的作用显著,且观察等高线图得出两者的交互效果显著。说明多糖损失率主要受用量和温度的共同影响。
由图12(a) 可知,活性炭添加量的升高和pH 值的上升都使脱色率有所提高。观察等高线图得出两者的交互效果不显著,说明脱色率主要受单因素影响。由图12(b) 可知,活性炭添加量的增加和pH 值的上升使得多糖损失率的作用显著。观察等高线图得出两者的交互效果不显著,说明多糖损失率主要受活性炭添加量影响。
由图13(a) 可知,加热时间的上升使脱色率明显提高,而加热温度对脱色率的影响不明显。观察等高线图得出两者的交互效果不显著,说明脱色率主要受时间影响。由图13(b) 可知,活性炭添加量的增加与pH 值的增加都使多糖损失率的变化显著。观察等高线图得出两者的交互效果不显著,说明多糖损失率主要受时间影响。
由图14(a) 可知,加热时间的增加使蒲公英叶多糖提取液的脱色率显著提高,但是pH 值对脱色率的作用不突出。观察等高线图得出两者的交互效果不显著,说明脱色率主要受加热时间影响。由图14(b) 可知,加热时间的增加和pH 值的增加都使蒲公英叶多糖提取液的多糖损失率的变化明显,且观察等高线图得出两者的交互效果显著,说明多糖损失率主要受加热时间和pH 值的共同影响。
由图15(a) 可知,加热温度和pH 值的增加使得脱色率显著升高。观察等高线图得出两者的交互效果显著,说明脱色率主要受加热温度和pH 值的共同影响。由图15(b) 可知,加热温度的增加和pH 值的增加都使多糖损失率有所增加。观察等高线图得出两者的交互效果不显著,说明多糖损失率主要受加热温度影响。
2.3.5 验证试验
试验得出蒲公英叶多糖的最佳脱色工艺参数为活性炭添加量0.50%,加热时间25 min,加热温度70 ℃,pH 值5.0,此时蒲公英叶多糖脱色率为99.39%,蒲公英叶多糖损失率仅达到8.05%。在此最佳脱色工艺条件下进行试验验证,做3 次平行试验,取其平均值。得出蒲公英叶多糖脱色率为98.86%,多糖损失率仅达到8.63%,与模型预测值差别不大。
3 结论
在单因素试验的前提下,比较得出粉末状活性炭对蒲公英叶多糖提取液的脱色效果比树脂有效很多,具备高脱色率、低多糖损失的特征,而且操作方便、节省费用,应用响应面法优化粉末状活性炭对蒲公英叶多糖提取液脱色的工艺条件。结果表明,蒲公英叶多糖脱色的最优工艺条件为活性炭添加量0.50%,加热时间25 min,加热温度70 ℃,pH 值5.0,此时蒲公英叶多糖脱色率为99.39%,蒲公英叶多糖损失率仅达到8.05%。对最优脱色条件进行试验验证,得到蒲公英叶多糖脱色率为98.86%,多糖损失率仅达到8.63%,与响应面优化结果相差无几。
蒲公英叶多糖提取液因为含有花色素苷,使其颜色较深,极大地阻碍了对蒲公英多糖功效的开发研究。因此,对蒲公英叶多糖进行脱色方面的研究价值较大,得出了蒲公英叶多糖的最优脱色条件,提高了多糖的纯度与质量,更有利于对蒲公英叶多糖更深层次的研究。

