曲妥珠单抗结合帕妥珠单抗治疗HER2阳性乳腺癌的疗效及对血清miR-375 miR-30d表达变化的影响
唐友琼, 张 棋, 谭道富, 张思波, 吴 谦
(湖北省恩施土家族苗族自治州中心医院, 湖北 恩施 445000)
最新数据显示,乳腺癌是妇女恶性肿瘤死因之首,且其发病人群还有年轻化趋势,已逐步成为我国重大的公共健康问题。人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)具有酪氨酸蛋白激酶活性,可通过多种途径使细胞增殖和调亡,促进肿瘤细胞的转移,近三成乳腺癌患者HER2过表达,故此类患者癌细胞扩展快,容易出现远处转移,常规放化疗药物治疗效果较差,靶向治疗抗药性较强[1]。因此,探寻有效治疗方法,提高生活质量,延长生命,是临床关注重点和难点。针对HER2基因自身特点,临床将其作为靶向治疗的战略目标。曲妥珠单抗、帕妥珠单抗是不同类型的HER2抗体,分别作用于HER2的不同表位,对HER2阳性乳腺癌疗效已被大量研究证实[2]。二者联合使用是否具有协同抗肿瘤活性仍有待进一步研究,为此,本研究观察了曲妥珠单抗联合帕妥珠单抗对HER2阳性乳腺癌患者的临床疗效,结果如下:
1 资料与方法
1.1研究对象:将2020年2月至2023年2月我院收治的139例HER2阳性乳腺癌患者采用简单随机数字表及随机数余数分组法分为联合组(n=70,妥珠单抗联合帕妥珠单抗治疗)与对照组(n=69,曲妥珠单抗治疗)。纳入标准:①符合乳腺癌的诊断标准[3],有乳腺肿块、乳头溢液、皮肤改变等临床表现,影像学、组织病理学检查可确诊,TNM分期为Ⅰ~Ⅱ期者;②经免疫组化或荧光原位杂交确定肿瘤细胞内HER2阳性表达;③初诊,且存在可测量的实体瘤病灶,且肿瘤直径≥2cm;④无重要脏器严重原发病;⑤对本次研究知情同意。排除标准:①合并其他恶性肿瘤;或有远处转移者;②乳房切除术,或放化疗史者;③治疗依从性差者;④对本研究使用的药物过敏。两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
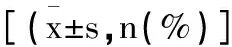
表1 两组一般资料比较
1.2方法:两组患者均符合治疗方案适应症,无禁忌症。适应症:①HER2阳性乳腺癌患者;②肿瘤体积>5cm2。禁忌症:对治疗药物过敏。对照组给予曲妥珠单抗[Roche Pharma (Schweiz) AG,分装批准文号:国药准字J20180073]治疗,首次治疗以8mg/kg静滴(滴注时间<1.5h),之后均为6mg/kg。紫杉醇注射液135~175mg/m2,卡铂0.3 g/m2,静滴(30min<滴注时间<1h),紫杉醇给药前6h、12h均给予地塞米松20mg口服。每隔21d给药1次为1个疗程,治疗4个疗程。联合组在对照组基础上给予帕妥珠单抗(德国Roche Diagnostics GmbH,批准文号S20180029)治疗,首次剂量840mg静脉滴注,每隔21d给药1次为1个疗程,2个疗程后剂量改为420mg,共治疗4个疗程。
1.3观察指标:①临床疗效:根据患者各项临床检查结果,肿瘤大小等,将其评为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)、客观缓解(objective response,OR)=CR+PR。②肿瘤相关指标:于治疗前、后分别采集两组患者晨起空腹血样,经化学发光免疫分析法检测两组患者癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)125、CA153水平;采用免疫磁珠技术检测循环肿瘤细胞(circulating tumor cells,CTC)个数(阳性判定标准:CTC>2个/3.2mL)。③T淋巴细胞亚群水平:使用红细胞花环法检测患者T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平。④血清miR-375、miR-30d表达量:用蛋白质印迹法检测血清微小RNA-375(miR-375)、微小RNA-30d(miR-30d)水平。⑤生活质量:以癌症患者生命质量测定量表(QLQ-C30)评估,该量表共5个部分,分别评分0~100分,评分越高则生活质量越好。⑥不良反应:比较两组胃肠反应、白细胞减少、心悸、味觉改变、失眠、肌肉或骨头疼痛等不良反应发生率差异。

2 结 果
2.1两组临床疗效比较:治疗期间两组患者均无死亡病例。治疗4个疗程后,联合组患者临床总有效率高于对照组(P<0.05),见表2。

表2 两组临床疗效比较n(%)
2.2两组肿瘤相关指标比较:治疗前,两组各项血清肿瘤标志物水平及CTC阳性率差异均无统计学意义(P>0.05),治疗后,两组各项血清肿瘤标志物水平较治疗前均降低(P<0.05),联合组治疗前、后差值均高于对照组(P<0.05),两组治疗前、后CTC阳性率差异无统计学意义(P<0.05),见表3。

表3 两组肿瘤相关指标比较
2.3两组T淋巴细胞亚群水平比较:治疗前两组CD3+、CD4+、CD4+/CD8+差异无统计学意义(P>0.05),治疗后,两组CD3+、CD4+、CD4+/CD8+均升高(P<0.05),两组CD8+较治疗前降低(P<0.05),联合组治疗前、后各项T淋巴细胞亚群水平差值均高于对照组(P<0.05),见表4。
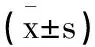
表4 两组T淋巴细胞亚群水平比较
2.4两组血清miR-375、miR-30d表达量比较:治疗前,两组血清miR-375、miR-30d表达量差异无统计学意义(P>0.05),治疗后,两组血清miR-375、miR-30d表达量均降低(P<0.05),联合组血清miR-375、miR-30d表达量差值均高于对照组(P<0.05),见表5。
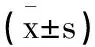
表5 两组患者血清miR-375 miR-30d表达量比较
2.5两组生活质量比较:治疗前,两组各项QLQ-C30评分差异无统计学意义(P>0.05),治疗后两组各项QLQ-C30评分降低(P<0.05),联合组两组各项QLQ-C30评分差值均高于对照组(P<0.05),见表6。

表6 两组QLQ-C30评分比较分)
2.6两组不良反应比较:治疗期间,两组均未发生严重不良反应,所有不良反应经对症处理后均缓解。联合组心悸发生率高于对照组(P<0.05);两组胃肠反应、白细胞减少、味觉改变、失眠、肌肉或骨头疼痛发生率比较差异无统计学意义(P>0.05),见表7。

表7 两组不良反应比较n(%)
3 讨 论
HER2受体可促使肿瘤细胞的转移,乳腺癌HER2过度表达患者快速复发和转移发生率均较高[4]。临床中,化疗虽然能有效杀死癌细胞,但对正常细胞亦能造成损伤,降低免疫功能,甚至出现化疗不耐受等,降低化疗效果。而且受HER2基因自身特点的影响,HER2阳性患者采用常规化疗效果并不明显。因此需寻找针对性强、效果佳的治疗方法。
随着乳腺癌研究的不断深入,抗HER2精准靶向疗法逐步在HER阳性乳腺癌患者中应用广泛,并在改善患者预后中取得了满意效果。曲妥珠单抗在HER2阳性乳腺癌中应用广泛,通过与HER2胞外结构域Ⅳ结合,后阻断下游信号,抑制肿瘤增殖[5]。帕妥珠单抗的抗肿瘤机制与曲妥珠单抗相似,二者区别仅在于其在HER2受体的作用位点不同。本次研究显示,联合组临床OR率高于对照组。与马善义等[6]研究结果一致。分析原因可能是曲妥单抗联合帕妥珠单抗HER2下游的信号通路的抑制作用更强,且二者联用能够增强免疫协同作用,故临床OR率更高。
CA125、CA153、CEA均是乳腺癌患者常用血清肿瘤标志物,可有效评估患者病情及预后[7]。CTC检测对临床判断肿瘤远处转移具有一定参考意义。本次研究中,观察组肿瘤相关指标改善程度优于对照组。考虑因素是,曲妥单抗联合帕妥珠单抗可增强HER2下游信号的传导阻断效应,杀灭肿瘤细胞,患者从双重靶向治疗中获益更多;抗肿瘤药物的长期应用导致患者免疫功能降低,而T淋巴细胞亚群可有效反映患者免疫功能。本研究中,联合组T淋巴细胞亚群水平优于对照组。分析原因是曲妥单抗与帕妥珠单抗联合应用能增强免疫的协同效应。
虽然曲妥单抗联合帕妥珠单抗已广泛应用于HER2阳性乳腺癌患者的治疗,且取得了不错的疗效,但患者5年生存率依然不容乐观。近年来的研究表明microRNA在多种肿瘤的发生和发展过程中起到重要的作用,包括肿瘤的耐药过程[8]。叶星明等[9]研究指出,miR-375可通过靶向Yes相关蛋白1参与上皮价值转化,进而作用于乳腺癌细胞的曲妥珠单抗耐药性。肿瘤患者中miR- 30d 表达也显著低于正常组织[10]。本研究中,联合组血清miR-375、miR-30d表达量均低于对照组。提示曲妥珠单抗与帕妥珠单抗联合可显著下调患者血清miR-375、miR-30d表达水平,但其具体机制尚需进一步研究。本次研究联合组QLQ-C30评分较高,表明联合用药可显著改善患者临床症状和生活质量,提高临床疗效。不良反应是肿瘤放化疗、靶向治疗等常见不良反应,其水平高低既可反映患者对药物耐受情况,又可反映药物安全性。本研究中两组心血管不良反应比较差异显著,提示曲妥珠单抗具有明显的心血管不良反应,而加用帕妥珠单抗联合治疗后相关心血管反应反而降低,可能与联合用药能提高集体免疫功能有关。
综上所述,曲妥珠单抗联合帕妥珠单抗能有效提高HER2阳性乳腺癌患者免疫功能,降低肿瘤标志物水平及miR-375、miR-30d表达,改善生活质量,且安全性较高,临床疗效显著。但本研究也存在一定的不足,未对患者远期疗效进行评估,后期应对患者进行远期随访,提高研究准确性。

