腹型过敏性紫癜患儿Hp感染消化道出血和脏器损害症状分布及其相关影响因素分析
吴坤卫, 李 敏, 吴奇发
(1.海南省琼海市人民医院儿科, 海南 琼海 571400 2.海南省海口市妇幼保健院儿科, 海南 海口 570102)
过敏性紫癜又称为“亨-舒综合征(henoch-schonlein purpura,HSP),是一种好发于儿童的弥漫性、血管炎症性疾病,其临床分型包括皮肤型、腹型、关节型、肾型、混合型等。腹型HSP可引起为腹痛、呕吐、腹胀、腹泻、消化道出血等症状,严重者甚至出现胃肠穿孔、出血性休克等不良后果,需要接受输血及外科手术处理[1]。由于其早期症状缺乏典型性,如腹痛症状出现于皮肤紫癜症状之前,易发生漏诊或误诊[2]。因此临床上一直在寻找与疾病相关的危险因素和诊断指标。基础研究认为,感染是腹型HSP发病的重要诱因之一,幽门螺杆菌(Helicobacter pylori,Hp)感染可引起自身免疫应答异常,与腹型HSP患儿胃黏膜损伤程度有关[3]。消化道黏膜病变可引起肠道内环境改变,影响肠道菌群生长,导致肠道菌群失调、肠道免疫紊乱,甚至可引起消化道出血。本研究分析腹型HSP患儿Hp感染、消化道出血和脏器损害症状分布以及相关影响因素。
1 资料与方法
1.1一般资料:选取我院2018年7月至2021年7月入院治疗的145例腹型HSP患儿作为研究对象,根据患儿消化道是否出血分为消化道出血组和非消化道出血组。消化道出血组68例,非消化道出血组77例。两组患儿性别、年龄、病程比较,差异无统计学意义( P>0.05) ,具有可比性。见表1。纳入标准:①患儿年龄5~15岁;②患者符合Ankara 2008 标准中腹型HSP诊断标准[4],患儿出现双下肢对称的瘀点或紫癜同时伴有以下四个标准之一:任意部位组织病理学活检有IgA 沉积⒑伴有消化道症状⒑伴有关节痛或关节炎⒑出现肾脏受累;③无血液疾病患儿;④患儿临床资料完整。排除标准:①其他原因引起的紫癜;②其他原因导致的脏器损伤;③自身免疫性疾病患儿;④依从性差的患儿。
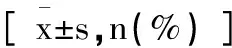
表1 两组患儿一般资料对比
1.2观察指标和检测方法:①对两组患儿的肠道菌群进行比较:所有患儿的入院当日或次日留取新鲜粪便样本1g,置于无菌EP管中,并冻存于-70℃冰箱。使用 QIAGEN 公司 QIAamp DNA Stool 试剂盒提取样本的总 DNA,对其进行 16Sr DNA 高通量测序,并计算其中的乳酸杆菌和大肠杆菌含量,单位为MPN/g。②对比两组患儿的炎症因子和免疫功能,所有患儿在入院当日均取肘静脉血10mL,分为四份进行检测。其中一份通过血细胞分析仪(深圳迈瑞医疗电子股份有限公司,型号:BC-760 CS)进行检测,包括白细胞(WBC)计数、淋巴细胞百分比(L%)、中性粒细胞百分比(N%)、血红蛋白(Hb)、嗜酸性粒细胞百分比(E%)、血小板(PLT)计数、PLT体积。另一份通过魏氏法检测红细胞沉降率。第三份离心后取血清,通过酶联免疫吸附法检测D-二聚体、细胞间粘附分子-1(ICAM-1)、免疫球蛋白A(IgA)、IgG、IgM、白细胞介素-6(IL-6)、IL-8、肿瘤坏死因子-α(TNF-α),使用试剂盒为上海研一生物科技有限公司,检测仪器为酶标仪(深圳迈瑞医疗电子股份有限公司,型号:RT-96A)。第四份血液样本通过流式细胞术检测CD3+、CD4+、CD8+T细胞亚群,使用检测仪器为流式细胞仪(美国贝克曼-库尔特公司,型号:CytoFLEX)。一份采用流式细胞术检测CD3+、CD4+、CD8+T细胞亚群,检测仪器:流式细胞仪(美国贝克曼-库尔特公司,型号:CytoFLEX)。③对比两组患儿脏器损害损伤、关节症状情况。

2 结 果
2.1两组患儿肠道菌群和炎症因子比较:对于消化道出血组和非消化道出血组的患儿进行比较,结果显示消化道出血组患儿的乳酸杆菌含量低于非消化道出血组,两组差异具有统计学意义(P<0.05)。同时,消化道出血组患儿的大肠杆菌、IL-6、IL-8、TNF-α水平较非消化道出血组更高,两组差异具有统计学意义(P<0.05)。见表2。
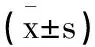
表2 两组患儿肠道菌群和炎症因子比较
2.2两组患儿辅助检查指标对比:两组患儿N%、Hb、E%、PLT计数、PLT体积、红细胞沉降率、D二聚体异常、胸腹部B超阳性、胸腹片阳性比例比较,差异无统计学意义(P>0.05),消化道出血组患儿WBC计数高于非消化道出血组,差异有统计学意义(P<0.05),消化道出血组患儿L%低于非消化道出血组,差异有统计学意义(P<0.05)。见表3。
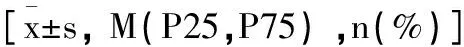
表3 两组患儿辅助检查指标比较
2.3两组患儿免疫功能指标对比:两组患儿ICAM1比较,差异无统计学意义(P>0.05),消化道出血组患儿IgA、IgG、IgM、CD3+、CD4+较非消化道出血组更低,差异有统计学意义(P<0.05),消化道出血组患儿CD8+明显高于非消化道出血组,差异有统计学意义(P<0.05)。见表4。
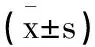
表4 两组患儿免疫功能指标对比
2.4比较两组患儿脏器损害损伤、关节症状情况:两组患儿心脏病变情况比较,差异无统计学意义( P>0.05) ,消化道出血组患儿肾脏病变、多脏器受累、关节症状比例显著高于非消化道出血组,差异有统计学意义(P<0.05)。见表5。
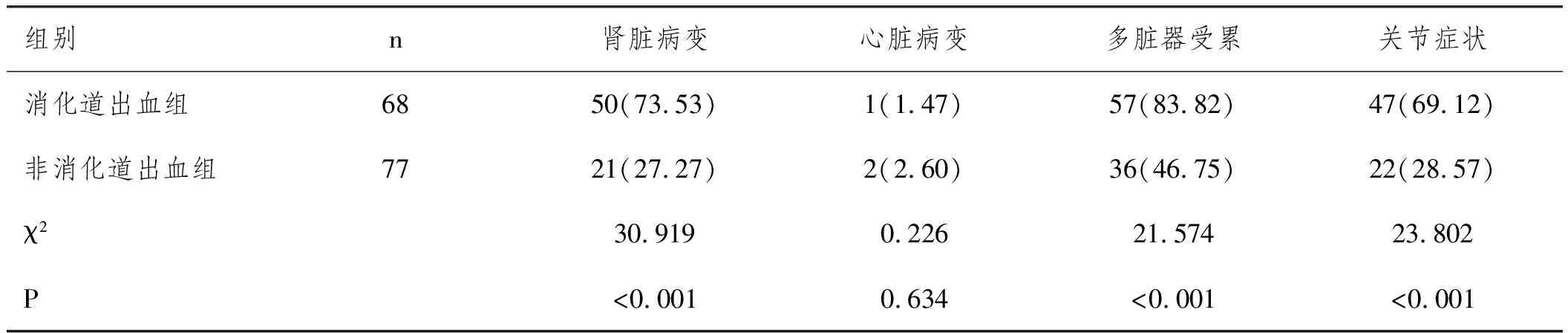
表5 两组患儿脏器损害损伤关节症状情况比较n(%)
2.5多因素分析结果:将乳酸杆菌、大肠杆菌、IL-6、IL-8、TNF-α、WBC计数、L%、IgA、IgG、IgM、CD3+、CD4+、CD8+、是否肾脏病变作为自变量,腹型HSP是否发生消化道出血作为因变量(腹型HSP消化道不出血赋值0,腹型HSP消化道出血赋值1),进行Logistic回归分析,分析结果:TNF-α、IgA、IgM、肾脏病变是腹型HSP发生消化道出血的影响因素(P<0.05)。见表6。
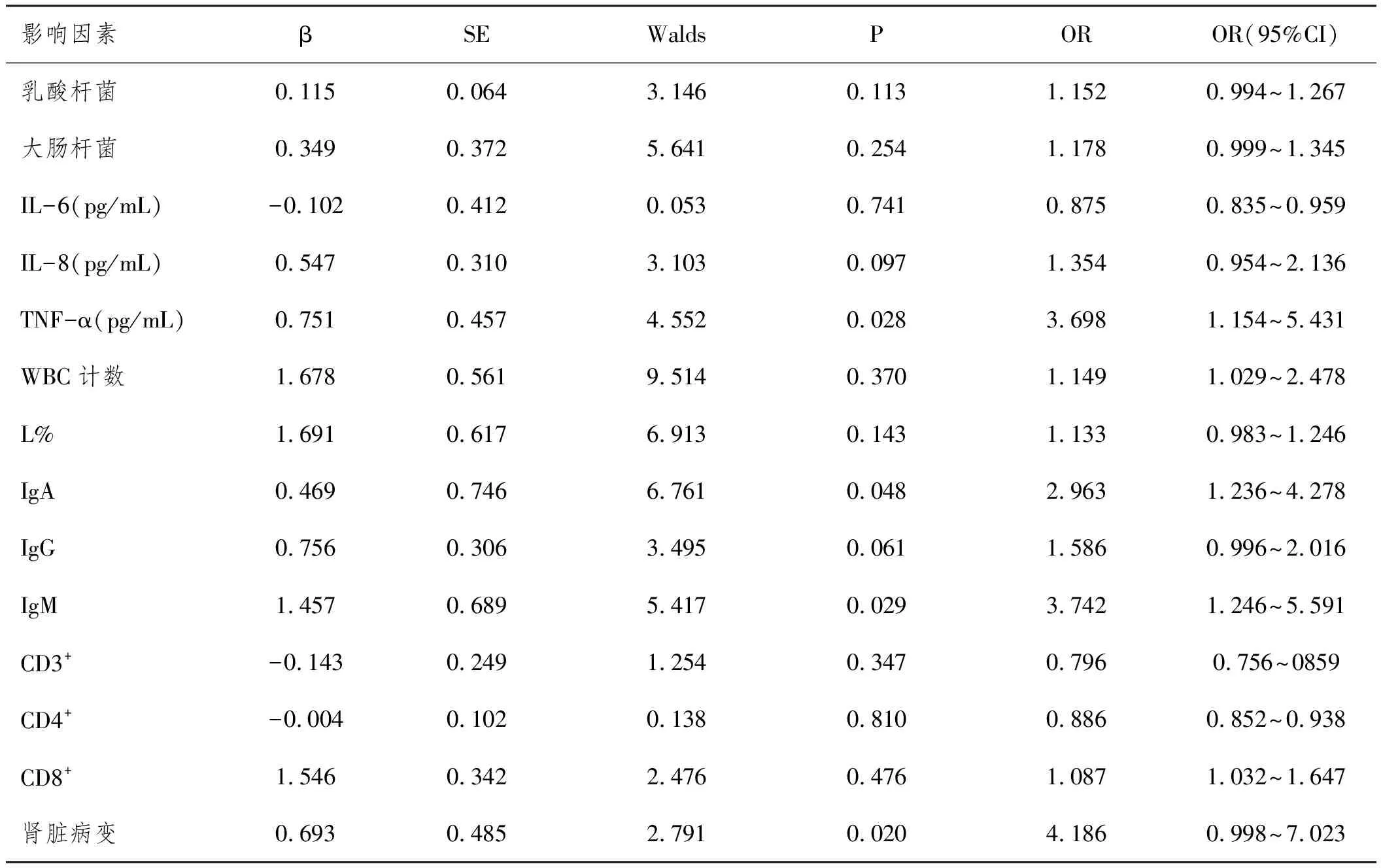
表6 多因素分析结果
3 讨 论
HSP属于血管变态反应性疾病,好发于3~10岁儿童,尤以男孩较多见,多在春、秋二季发病,某些药物、食物及花粉均可致病[5]。相关病理学研究认为,HSP患儿小血管发生炎性损伤、小动脉内微血栓形成,伴大量炎症细胞浸润,当病变累及消化道黏膜时则发生腹型HSP[6]。流行病学调查发现,随着HSP病程进展,约有18%~50%患儿会发生消化道出血。而14%~36%患儿的胃肠道症状发生于皮肤紫癜出现之前[7]。
有研究认为,肠道菌群平衡是维持消化道健康的重要因素,肠道菌群失衡可引起局部及全身炎症反应[8]。本研究对比两组患儿肠道菌群和炎症因子发现,消化道出血组患儿乳酸杆菌低于非消化道出血组,大肠杆菌、IL-6、IL-8、TNF-α水平高于非消化道出血组。这一结果提示,腹型HSP消化道出血患儿较非消化道出血患儿肠道有益菌减少,有害菌增加,机体炎症反应更加严重。这是由于乳酸杆菌属于肠道益生菌,其水平降低可导致肠道菌群紊乱,大肠杆菌等有害菌大量增殖,影响肠黏膜屏障功能,并能激活炎症反应[9]。TNF-α、IL-6两种促炎细胞因子相互促进,趋化炎症细胞向血管壁黏附,引起血管内膜损伤和炎症[10]。IL-8可趋化中性粒细胞,在血管损伤发生后还可促进血管生成[11]。
Hp感染后可引起机体免疫炎症反应并导致自由基大量释放,从而加重血管内皮损伤。本研究通过检测两组患儿血常规发现,消化道出血组患儿WBC计数高于非消化道出血组,L%低于非消化道出血组。这一结果提示,腹型HSP消化道出血患儿较非消化道出血患儿机体免疫紊乱状态更加严重。这是由于HP感染可促进毒素因子分泌,刺激炎症介质释放而引起持续性炎症反应。
体液免疫和细胞免疫对于维持机体免疫平衡具有重要作用。在B细胞分化和免疫球蛋白分泌过程中,T细胞发挥着重要作用。最近的研究表明,患有热休克蛋白(HSP)的患儿体内CD3+、CD4+T淋巴细胞亚群以及CD4+/CD8+比值较低,这可能与自身免疫紊乱有关[12]。本研究发现,消化道出血组患儿IgA、IgG、IgM、CD3+、CD4+低于非消化道出血组, CD8+明显高于非消化道出血组。这一结果提示,腹型HSP消化道出血患儿较非消化道出血患儿免疫紊乱状态更加严重。这是由于免疫紊乱状态下,免疫细胞活化、抗体大量生成,介导血管变态反应性损伤。
HSP患儿的长期预后取决于是否发生肾损伤及肾脏受累程度。本研究发现,消化道出血组患儿肾脏病变、多脏器受累、关节症状比例显著高于非消化道出血组。这一结果提示,腹型HSP消化道出血患儿较非消化道出血患儿肾脏病变比例更高。随着HSP病程进展,毛细血管及小动脉免疫性病变越来越严重,血管壁纤维素样坏死、血管周围见炎症细胞浸润,可引起肾区血流灌注减少而致肾损伤。
本研究将乳酸杆菌、大肠杆菌、IL-6、IL-8、TNF-α、WBC计数、L%、IgA、IgG、IgM、CD3+、CD4+、CD8+、是否肾脏病变作为自变量,是否发生消化道出血作为因变量,进行Logistic回归分析,发现双歧杆菌、TNF-α、IgA、IgM、肾脏病变是腹型HSP发生消化道出血的影响因素。在今后的临床工作中,可通过检测肠道菌群、血中TNF-α、IgA、IgM及肾脏病变来预测HSP患儿消化道出血的发生风险。
综上所述,腹型HSP消化道出血患儿较非消化道出血患儿肠道有益菌减少,有害菌增加,免疫功能降低,炎症反应程度更高,肾脏病变比例更高,肾脏病变是腹型HSP消化道出血的影响因素。

