表面等离子体共振技术及其在蛋白质活性浓度绝对定量中的应用
罗世闻, 武利庆, 杨 彬, 刘亚辉
(中国计量科学研究院,北京 100029)
1 引 言
蛋白质是生物体中广泛存在的一类生物大分子,它是由核酸编码的α氨基酸通过α氨基和α羧基形成肽键,并连接成肽链,再经翻译后加工生成了具有特定立体结构和活性的大分子[1]。生物体中的蛋白质通过与其他分子的相互作用表现出其活性,并在细胞中发挥着催化、免疫、传导、调控等重要功能[2]。蛋白质是生命的物质基础,是构成细胞的基本有机物,是生命活动的主要承担者。蛋白质具有复杂的高级结构和翻译后修饰,即使具有相同的一级结构,也会因不同的折叠形成的高级结构以及翻译后修饰的不同而导致活性的不同。蛋白质功能的发挥往往仅依赖其具有活性的部分,因此,正确测定蛋白质的活性浓度对于更好地了解与评价蛋白质功能,提升和控制蛋白类生物技术产品质的量显得尤为重要[3]。
传统的蛋白质分析技术,如凯氏定氮法、紫外分光光度法、双缩脲法、Lowry法、BCA法、考马斯亮蓝染色法[4]等,都依据蛋白质的一级结构进行定量,测定出的蛋白质浓度是蛋白质的理化浓度而不是活性浓度。即使目前发展起来的蛋白质定量潜在计量基准方法,如同位素稀释质谱法、定量核磁法、高效液相色谱-圆二色光谱联用法、电喷雾-差分电迁移-颗粒计数法[5,6]等,也是依据蛋白质的一级结构进行定量。这种方法虽然可以准确测定出蛋白质的理化浓度,但是该浓度与广为关注的蛋白质活性浓度之间没有必然的关系。
蛋白质作为一类复杂的生物大分子,多肽链在一级结构的基础上可进一步盘旋折叠并与其他蛋白质亚基结合,从而形成不同的二级、三级或四级结构,同时经过翻译后修饰的加工才具有最终的生理功能。具有正确高级结构以及翻译后修饰的蛋白质只是存在相同氨基酸序列,是蛋白质中的一部分,但只有这部分蛋白质才具有生理活性,因此需对这部分活性蛋白浓度的测定更为关注。酶联免疫吸附测定法(ELISA)、数字酶联免疫吸附法[7]等各种免疫分析方法,虽然通过抗原与抗体之间的相互作用可以反映出部分蛋白质高级结构与翻译后修饰等对蛋白质浓度测量的影响,但是这类方法一般都是相对测定法。需通过活性蛋白绘制标准曲线才能对样品中的蛋白进行活性测定。然而目前还未研制出蛋白质活性浓度标准物质,从而使得通过免疫分析测定蛋白质活性浓度的方案也不可行。
迫于蛋白质功能评价表征以及蛋白制品活性指标质量控制对蛋白质活性浓度测量和计量的需求,近年来研究人员提出并逐步发展了基于表面等离子体共振光谱(surface plasmon resonance,SPR)的无校准浓度分析技术(calibration free concentration analysis,CFCA)[8,9],成功实现了在无需标准品的情况下,对蛋白质活性浓度的绝对测定,并逐步在蛋白质纯化、疫苗开发、临床检验、蛋白类生物制品质量控制、标准物质研制等众多领域进行应用。该技术已经引起国际国内计量界的广泛关注,CFCA有望成为蛋白质活性浓度计量的基准方法。故此,本文对该技术的测量原理、应用领域、存在不足以及未来可能地发展方向等进行了综述和展望。
2 表面等离子体共振技术的基本原理
表面等离子体共振的概念早已出现[10],是一种由隐失波引发金属表面疏密电子振荡的物理学现象。当光从光密介质进入光疏介质时会产生一束反射光和一束折射光,折射光的角度与两种介质的折射率有关,且符合菲涅尔公式:
n1sinθ1=n2sinθ2
(1)
当入射角增大到临界点时,折射光将彻底消失,只存在反射光,这一现象被称为全反射[11]。在这一过程中入射光并不是在刚接触界面时产生反射光,而是先进入光疏介质沿着界面流过波长量级再返回光密介质,其中经过光疏介质的光称为消逝波[12]。这时如果介质中存在一层具有等离子波的金属膜,2种波相遇可能发生共振,导致入射光的部分能量转移到表面等离子波中,使得反射光的强度大幅度减弱。使反射光完全消失的入射角就被称为SPR角。SPR角通常与金属表面折射率相关,而金属表面折射率又和其表面捕获的分子质量成正比,所以通过检测SPR角的改变可以获得分子间相互作用的信息[13,14]。
从1902年首次观察到表面等离子体共振现象到1983年首次引入气体传感和生物传感器,SPR技术在纳米技术,光学技术,流体技术和光源技术的支持下得到了迅速发展[15]。近几十年来,表面等离子体共振技术在蛋白质组学、临床诊断、环境监测、药物研发、材料开发等方面被广泛应用,覆盖了医药、环境、生物和材料等多个领域[16,17]。SPR技术具有样本需求量小、检测速度快、耗材成本低和操作简单等优点[18],无需对生物分子进行荧光或放射性标记就可以直接测量分子间相互作用的亲和力及动力学常数[19],可应用于各类分子间相互作用的实时动态监测[20],如抗体-抗原、蛋白质-蛋白质、酶-底物、蛋白质-DNA、受体-药物、蛋白质-多糖、蛋白质-病毒[21,22]等。
3 蛋白质活性浓度测量原理
基于SPR的蛋白质活性浓度绝对测量技术,即无校准浓度分析技术(calibration free concentration analysis,CFCA)的概念最早于1993年提出,随后被逐步完善和发展。使用CFCA时,需将分析物在层流条件下注入传感器表面,传感器的表面上要固定有分析物的受体或抗体。溶液中分析物首先通过扩散来到传感器的表面,随后表面附近分析物中具有的活性分子将与固定在传感器表面的受体或抗体结合,从而引起传感器表面质量变化,而这种变化将引起SPR产生响应,整个过程如图1所示。
当分析物在层流条件下注入传感器表面且传感器表面偶联的受体或抗体足够多、分子之间的结合反应足够快的时候,整体的扩散与结合反应速率就仅受到分析物扩散速率的影响,即处于传质限制(mass transferlimited,MTL)条件下,此时溶液中的分析物与传感器表面的分析物浓度之间存在下式中的化学平衡。
(2)
式中:Abulk代表溶液中分析物的浓度,g/L;Asurface代表传感器表面分析物的浓度,g/L。根据质量作用定律,可以写下式:
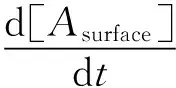
(3)
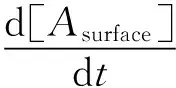
(4)
式中:D代表分析物的扩散系数,m2/s;f代表流动池中溶液的流速,m3/s;H、w和l分别流动池的几何尺寸即高度、宽度和长度,m。扩散系数D取决于分析物的分子量和粘度等常数[23],如下所示:
(5)
式中:M代表分析物的分子量,Da;ηrel代表溶剂的相对粘度(20 ℃下)。
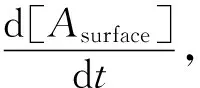
4 蛋白质活性浓度测量的应用
4.1 在蛋白质活性计量中的应用
Su[24]等建立了测定转基因蛋白G2-EPSPS活性浓度的CFCA方法,研究发现该方法日内精密度为3.26%~4.59%,日间精密度为8.36%。在1.5~8 nmol/L 的浓度范围内,该方法的回收率为97.46%~104.34%。通过与同位素稀释质谱测定的理化浓度进行比较,发现G2-EPSPS的比活性仅为0.18,证明针对选择的抗体,大部分蛋白没有活性,同时反映出如果采用理化浓度替代活性浓度计算亲和常数或对蛋白质的活性进行质控,将引起较大的误差。
Hu[25]等以人肌红蛋白为研究对象,进一步采用3种经过筛选的不同单克隆抗体建立CFCA方法对肌红蛋白的活性浓度进行测定,结果分别为2.985、2.912和3.032 mg/mL,不仅不同抗体获得的活性浓度结果一致,而且与通过同位素稀释质谱法测得的理化浓度2.851 mg/mL接近,比活性为 1.02~1.06,证明所用蛋白活性良好。Hu认为该方法可能成为蛋白质活性浓度测定的基准方法并用于蛋白质活性标准物质的研制。
Ludmilla[26]等使用Biacore 2000设备和胺偶联试剂盒测定了重组RVG的活性浓度。通过将p75NTR中可溶解的伯胺基团与CM5传感器芯片的羧甲基化葡聚糖基质共价连接得到共振单元,然后将稀释液以7种不同流速在CM5(p75)表面上流动 5 min 并与空白CM5芯片进行对照,最后使用BIA-CONC程序分析初始结合率以测定重组RVG的活性浓度。
4.2 在蛋白质标准物质研制中的应用
虽然目前还没有直接采用CFCA方法研制蛋白质活性浓度标准物质的例子,但是中国计量科学研究院的Wu[27]等研究发现,CFCA的蛋白质活性浓度测定技术可用到蛋白质标准物质的互换性评价中。Wu等分别采用CFCA和同位素稀释质谱测定候选蛋白质标准物质的活性浓度与理化浓度,当活性浓度与理化浓度在不确定度范围内相等时,说明2种方法识别的被测量一致,因此用同位素稀释质谱方法定值的蛋白质标准物质将在免疫学方法中具有良好的互换性,且相关的研究工作和技术已经获得专利授权[27]。
4.3 在临床检验中的应用
Grover[28]等使用CFCA方法直接测定患有不同传染病和非传染病患者血清样品中的蛋白质生物标志物丰度。对近100个血清样品中β2-微球蛋白(β2M)和血清淀粉样蛋白A(SAA)的浓度进行测定,发现CFCA都具有很好的重复性、准确性和灵敏度。在血清稀释度为1 000的检测中可测到低至 13 ng/mL 的β2M,说明该方法可用于检测体液中的低丰度蛋白质生物标志物。应用CFCA方法,患病受试者的血清SAA与健康组相比,丰度存在显著差异,这与蛋白质组学研究结果一致。该研究使得CFCA在快速监测血清样品中的多种蛋白质标志物方面迈出了重要一步。
Ray[29]等通过使用Biacore T200系统的CFCA方法对SAA进行定量,将每个血清样品连续稀释至1/100和1/200进行浓度分析,并在25 ℃下以 5 μL/min和100 μL/min的流速通过活性和参考流动池,然后使用Biacore T200系统的软件分析结合率数据从而确定SAA浓度,最终实验结果结果表明SAA的血清丰度随感染的严重程度依次增加。
Aniol-Nielsen[30]等提出了一种用于抗药抗体(ADA)定量的CFCA方法,该方法是一种用于确定药物特异性抗体比例的方法,它允许在基于流动的系统中直接确定由配体定义的活性抗体浓度。在研究中,他们使用针对内源性人胰岛素、德谷胰岛素和凝血因子的多克隆阳性对照抗体进行开发和验证,发现CFCA的方法可以精准地测量出药物特异性抗体的浓度,精密度为±10%,与单抗阳性对照抗体的预期值回收率为90%~112%。
4.4 在蛋白类生物制品研发与质控中的应用
Karlsson[31]等将CFCA技术应用于温度应激TNF-α抗体的质量控制中,结果发现通过CFCA测定的活性浓度与抗体效价之间存在良好的相关性,Karlsson认为基于SPR的剂量响应曲线、传感图的比较和CFCA技术的组合可以增强抗体相对效价评估的可信度,并表明SPR技术可用于生物药物质量控制中并替代效价测定。
Pol[8]等采用CFCA方法测定了贝伐单抗、利妥昔单抗、干扰素a-2a等活性浓度,在优化的实验条件下,CFCA方法具有良好的精密度和准确度。在干扰素α-2a纯化制备过程中,通过CFCA测定样品和参考物质的活性浓度计算相对效价对产品进行评价和质量控制,发现比CFCA测定单一活性浓度的方法更加可靠。
4.5 在基础科研中的应用
Pol[9]等通过使用Biacore X100进行实时分析,探索了牛半胱氨酸蛋白酶抑制剂胱抑素B与木瓜蛋白酶的催化失活形式之间的相互作用。他们使用CFCA的方法确定了每个半胱氨酸蛋白酶抑制剂B变体特异性结合浓度,并将获得的值与A(280 nm)确定的总蛋白浓度进行比较。结果说明在结构功能的研究中使用CFCA的方法有助于获得可靠的结果以及正确解释相互作用机理。
Stefan[32]等在研究YpdB基因如何启动脉冲基因表达时,使用SPR技术分析测量了原生型YpdB和磷酸化变体型YpdB-D53E与yhjX启动子区的结合动力学。通过使用CFCA的方法在2种不同的流速下测量蛋白质的初始结合速率,然后通过Biacore系统的扩散常数计算程序算出YpdB-D53E的扩散系数,从而得到YpdB-D53E的活性浓度,最后后将所得活性蛋白浓度用于计算动力学结合常数,获得了更加准确的值。
Yasmina[33]等在研究FcRn/Fc相互作用的过程中,使用了Biacore公司的SPR生物传感器进行了CFCA分析,在传质限制条件下对每种分析物的活性浓度进行了测定。测试数据显示,FcRn/IgG的相互作用可以在相反的检测方向上进行研究,这样可以最大限度地减少表面伪影,并得到与溶液测量接近的亲和力常数。
5 蛋白质活性浓度测量的不足
目前相对较为成熟的蛋白质活性浓度测定方法均是基于SPR的CFCA方法。虽然该方法在蛋白质计量、临床检验、蛋白类生物制品质量控制等领域逐渐被应用,并且可以不依赖标准用于绝对活性浓度测定,但通常可能会产生15%~30%的误差。受限于该方法的测量原理,目前还存在以下不足与亟待解决的问题。
1) 该方法要求在传质限制(MTL)条件下进行,因此要求芯片表面具有较高的受体或抗体偶联密度,同时蛋白质与抗体或受体结合的反应速率要足够快,但是这些要求不是每个研究体系都能符合,如果不能满足测量原理的要求,则不能通过这种方式测定蛋白质活性浓度。一般来说,只有当目标蛋白的分子量大于5 000时,才能获得比较好的分析效果。虽然后续有研究工作将该方法扩展到在部分传质限制条件下的活性浓度测定,并给出了描述生物分子复合物形成的微分方程的解析,但是模型的准确性有待更多实验数据的验证。
2) 计算模型中的流通池几何尺寸、分析扩散系数、流速、1 RU对应的单位面积质量等若干常数或参数均为经验估算值或系统平均值,用于特定体系的计算可能会产生一定的误差。当SPR信号从传感器表面呈指数衰减传导时,远离传感器表面的分子比靠近传感器表面的分子其单位质量响应低也会造成转换系数的误差。
3) CFCA计算模型通常采用1:1模型进行计算,如果分析物具有多个相同的结合位点,则不能直接确定单个结合位点的活性浓度。
6 展望与总结
随着生物产业的发展,尤其是蛋白质药物等蛋白类生物制品的不断上市,对蛋白质活性浓度准确可比测量的需求也不断攀升,解决蛋白质活性浓度计量问题、建立蛋白质活性浓度量值溯源传递体系变得尤为迫切。国际计量局物质的量咨询委员会(CCQM)蛋白质分析工作组于2018年专门成立了蛋白质活性焦点工作组,专门研究蛋白质活性的测量与量值溯源问题,本课题组有成员担任了该工作组的召集人。2019年CCQM成立25周年纪念大会上,专门邀请中国计量科学研究院的专家介绍了基于SPR的蛋白质活性浓度计量研究成果。2021开始国家科技部的质量基础(NQI)重点研发计划等项目指南中,也对蛋白质活性浓度计量技术研究提供经费支持。蛋白质活性浓度计量研究在我国已经全面铺开。未来一段时间,CFCA方法凭借不依赖标准品直接测定出蛋白质活性浓度的优点,依然是蛋白质活性浓度计量方法研究的重点。CFCA方法将进一步朝着提高方法准确度和扩大适用范围的方向发展。例如,通过改善部分传质限制条件下传质参数和数学模型的准确度提高测量结果的准确度;通过仪器参数的校准和有关常数的准确测定提高准确度,及不同仪器间的可比性;通过采用捕获模式等实验设计,解决无法通过共价固定在传感器芯片上的配体进行活性浓度测定的问题[34]。总之,相信不久的将来,基于SPR的CFCA方法将在蛋白质活性浓度计量与蛋白质活性标准物质研制中发挥巨大的作用[35]。

