宁夏云雾山典型草原灌丛化过程中植被和土壤演变特征
姬秀云,李美慧,拓行行,李 伟
(1 宁夏云雾山国家级自然保护区管理局,宁夏固原 756000;2 西北农林科技大学 草业与草原学院,陕西杨凌 712100;3 西北农林科技大学 水土保持研究所,陕西杨凌 712100)
灌丛化(灌木扩张)指在干旱半干旱区天然草地中草本植物逐渐被原有木本植物所取代,木本植物在群落中的密度、盖度及生物量等逐渐增大的现象[1]。干旱、全球变暖、降水改变、CO2浓度的升高、过度放牧和火烧等均能引起灌丛化的发生[2]。全球的草地生态系统中10%~20%的干旱和半干旱草地已经发生了灌丛化,北美灌丛化草地面积达3.3亿hm2,南非约有1 300万hm2的稀树草原发生了灌丛化[3]。在中国,青藏高原地区从1990年至2009年至少有39%的高寒草甸转化为高寒灌丛[4];内蒙古地区已有超过510万hm2的草原受到锦鸡儿属灌木入侵的影响[5]。灌丛化能够显著改变植被特性(组成、多样性和生产力等)[6-7],土壤特性(土壤C、N、P和土壤呼吸等)[8-9]以及土壤微生物群落结构和多样性[10-11]。天然草地的灌丛化严重制约了草地生态产品的供给和服务功能,并影响区域社会经济的可持续发展[12-14]。但也有研究表明,天然草地中的灌丛化对生态系统可产生积极作用,比如有利于土壤水分的下渗,增加生态系统水分储存、养分的转化功能以及增加生产力和碳的固定[15-16]。因此,深入研究草地灌丛化过程中生态系统结构和功能的影响,对准确预测灌丛化的发生和发展过程以及干旱半干旱区天然草地的管理有重要的理论和实践意义。
有研究表明, 围栏封育可有效降低食草动物对草地的啃食和破坏,有利于草地的稳定及生产力的自然恢复,被认为是恢复退化草地最简单易行的方法[17]。但也有研究表明,长期围封可能引起物种组成改变,降低物种多样性和土壤固碳能力,不利于草地生态系统生态和生产功能的发挥[18-19]。尽管灌丛化在全球干旱半干旱区的天然草地已普遍发生,且形成了一种新的植被景观[12-13],国内外学者也对灌丛化的过程和机制进行了较为深入的研究[5,20-21],但关于长期围栏封育导致草地发生灌丛化的研究还相对较少。其次,在群落演替研究方法上常以空间尺度代替时间尺度[22-23],对固定样地长时间动态观测的研究较少,且不同的演替序列之前的土地利用历史和环境背景并不完全一致,因此以空间换时间的方法并不能揭示群落真正的演替轨迹,得到的结果也可能存在偏差[24-25]。此外,灌丛化可能会引起草地生态系统的地上-地下过程发生联动效应,但目前主要集中在对地上部分或地下部分单一层面的研究[2,22],而对灌丛化驱动的植被和土壤变化进行整体性考虑的研究较少,在半干旱黄土区典型草地的相关研究更是少见。
鉴于此,试验以宁夏云雾山典型草原为研究对象,系统分析了不同时间(2010年、2016年和2021年)灌丛化草地的植被和土壤响应特征,旨在为黄土高原长期封育草地灌丛化的准确预测和控制以及后续适应性和可持续管理提供参考依据。
1 材料和方法
1.1 研究区概况
研究区位于西北农林科技大学宁夏云雾山草原生态系统国家长期科研基地(106°24′-106°28′E,36°13′-36°19′N),其海拔高度为1 800~2 150 m,该区域属于中温带半干旱气候,年平均温为7.01 ℃,年平均日照时间为2 300~2 500 h,年平均降水量为425.5 mm,降水季节分配不均,全年60%~75%的降水集中在6-9月,土壤类型为山地灰褐土和黑垆土,其pH值为7.9~8.2[26]。植被属温带典型草原,草本植物优势种和建群种主要有本氏针茅(Stipabungeana)、大针茅(S.grandis)、甘青针茅(S.przewalskyi)和冷蒿(Artemisiafrigida),伴生种以猪毛蒿(A.scoparis)、干生苔草(Carexaridula)和星毛委陵菜(Potentillaacaulis)为主[27]。灌木植物主要为矮脚锦鸡儿(Caraganabrachypoda),半灌木植物主要为白莲蒿(A.sacrorum)。近年来,在长期封育草地发现有灌丛化现象,灌木矮脚锦鸡儿和半灌木白莲蒿呈团块状散布在草地上,且分布面积呈现逐年增大的趋势[28-29]。
1.2 试验设计
试验以宁夏云雾山草原生态系统国家长期科研基地的长期定位观测样地为研究对象,于2010年4月底在定位观测样地内随机设置15个20 m×10 m的小区,小区之间至少相距50 m,每个小区分成两部分:一部分长×宽为10 m×8 m,用于植被调查和土壤采样;另一部分长×宽为12 m×10 m,用于植物个体采样。
1.3 研究方法
1.3.1 样品采集与测定
分别于2010年8月中旬、2016年8月中旬和2021年8月中旬,在每个定位小区的10 m×8 m(长×宽)部分,随机选取3个1 m×1 m的样方进行地上植被调查,为避免边缘效应,样方距边缘的距离大于0.5 m[29]。调查内容包括群落总盖度、高度以及各物种的植株高度、密度以及盖度。将样方中所有植物按种分类,对地上部分进行地面刈割,按物种装入纸袋封袋编号,在65 ℃条件下将物种地上部分烘干至恒重,称其干重,所有物种干重之和即为群落地上总生物量。此外,将地上植物按功能群分为禾本科(Gramineae)、菊科(Asteraceae)、豆科(Leguminous)和杂类草(forbs)4类。
在每个样方处清理地表凋落物(地上植物已采集)后,在样地中随机挖出1个深度为100 cm,长度和宽度均为50 cm的土壤剖面,用容积为100 cm3的环刀按照土层深度0-20 cm、20-40 cm、40-60 cm、60-80 cm和80-100 cm自上而下采集5层土壤样品,每层取3环刀原状土,装入已知质量的铝盒中,用于土壤容重测样,再用直径5 cm土钻取0-100 cm土层的土壤样品,每20 cm为一层,每层3个重复,同层混合为1份土壤样品。每份土壤样品分为两部分:一份用于测定土壤含水量;另一份用于测定土壤化学性质。土壤含水量和土壤容重测定采用经典烘干法(105 ℃,12 h),其余土壤样品带回实验室置于阴凉处,自然风干后依次过2 mm和0.25 mm筛。过2 mm筛后部分样品采用pH计测定土壤pH值;过0.25 mm筛后样品用于分析土壤有机质、全氮和全磷等指标。土壤有机碳(SOC)测定采用重铬酸钾-浓硫酸外加热法,其中重铬酸钾0.8 mol/L、硫酸亚铁0.2 mol/L;全氮(TN)测定选用半微量开氏法,浓硫酸消煮时加固体催化剂催化;全磷(TP)通过高氯酸-硫酸消煮后钼锑抗比色法测定[30]。
1.3.2 数据处理及分析
计算样方内的α多样性[20](包括Patrick丰富度指数、Simpson优势度指数,Shannon-Wiener多样性指数和Pielou均匀度指数),计算过程中选用植株相对高度、相对盖度、相对密度和相对生物量作为计算重要值[31]的指标。统计分析采用R软件完成,统计检验的概率显著性水平为P=0.05。为反映土壤储水量[32]的大小,以5个层次分别进行计算,计算公式为:
Q=dhc
(1)
式中:Q为某土层储水量(mm),反映的是某土层单位面积内储水折合的高度;d为土壤平均容重(g/cm3);h为土层厚度(mm);c为土层平均含水率。
2 结果与分析
2.1 灌丛化草地群落组成结构和生物量变化
12年的演替过程中,灌木矮脚锦鸡儿已逐渐取代了草本植物本氏针茅成为群落的优势种。2010年封育草地地上植物共有32种,2016年有35种,2021有25种(表1)。12年内新增物种只有3种,主要是菊科和杂类草的一些低矮植物猪毛蒿、蚓果芥(Torulariahumilis)和牻牛儿苗(ErodiumstephanianumWilld.)。而消失物种则高达10种,除豆科植物物种数未发生变化,其余功能群物种均有减少,其中杂类草和禾本科物种减少最为明显。2010年时,本氏针茅的重要值最高,为0.216 8,其次是披碱草(Elymusdahuricus),为0.102 3;2021年时,灌木矮脚锦鸡儿的重要值最高,达到0.326 2,其次是白莲蒿,为0.192 1。而披碱草、赖草(Leymussecalinus)、茅香(Anthoxanthumnitens)、北方还阳参(Crepiscrocea)、飞廉(Carduusacanthoides)、细叶沙参(Adenophoracapillaris)等物种从群落中彻底消失。
12年的演替过程中,灌木生物量和总地上生物量显著增加(P<0.05)。样地中灌木的生物量占比由原来的10.60%提高至69.52%,地上总生物量也显著增加(P<0.05),说明矮脚锦鸡儿扩张对地上生物量有显著影响。此外,群落高度和总盖度都显著增大(P<0.05),而密度虽有降低,但并不显著(表2)。

表2 不同封育年限地上植被特征变化
2.2 灌丛化草地群落物种多样性变化
随着矮脚锦鸡儿种群不断扩大,草地群落的α多样性均有显著变化(P<0.05)。群落Patrick丰富度指数、Simpson优势度指数,Shannon-Wiener多样性指数在12年内都有不同程度降低。Shannon-Wiener多样性指数的变化幅度最大,降低了50.6%;Patrick丰富度指数与Simpson优势度指数变化幅度相似,分别降低了16.9%和14.5%;Pielou均匀度指数显著提高了61.1%(表3)。以上结果表明,随着灌木扩张,群落类型由高丰富度低均匀度型转为低丰富度高均匀度型。

表3 不同封育年限物种多样性变化
2.3 灌丛化草地土壤物理特性变化
天然草地灌丛化并未引起土壤容重的显著变化,但同一年份土壤深层(60-100 cm)容重显著增大(P<0.05)。
土壤含水量随着土层深度增加呈下降趋势,灌丛化引起0-60 cm土层土壤含水量降低,而60-100 cm土层土壤含水量增大,但都不显著(P>0.05)(表4)。
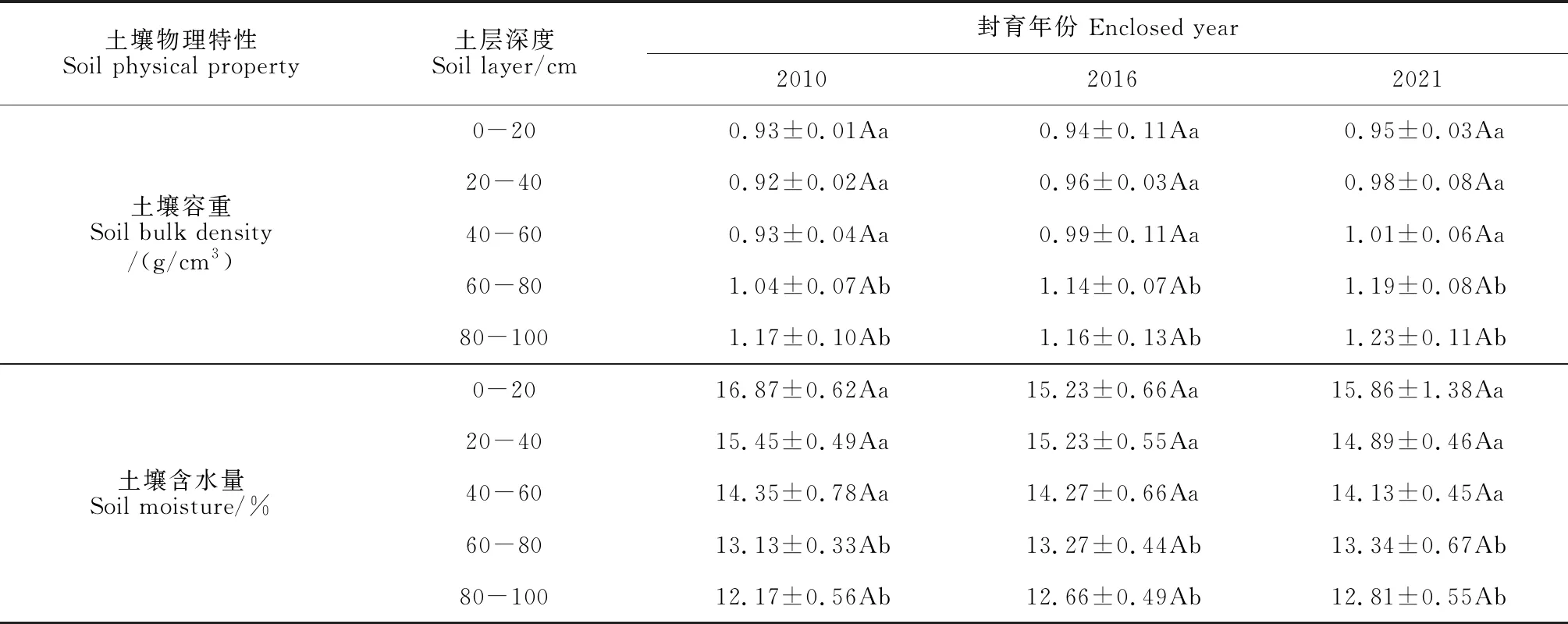
表4 不同封育年限土壤物理特性变化
从各土层储水量来看,除0-20 cm土层的储水量由3 137.82 mm减少至3 013.4 mm外,其余土层(20-100 cm)的储水量均有所增加,其中40-100 cm土层的增幅较大(图1)。

同期不同小写字母表示不同土层间差异达5%显著水平;同一土层不同大写字母表示不同年份间差异达5%显著水平。图1 不同封育年限土壤储水量均值变化Different lowercase letters in the same year indicate significant difference between different soil layer at 0.05 level;different capital letters in the same soil layer indicate significant difference between different years at 0.05 level.Fig.1 Changes in the mean value of soil water storage for different enclosure years
2.4 灌丛化草地土壤化学特性变化
灌丛化草地土壤有机碳含量在土壤浅层(0-60 cm)、全磷含量在整个土壤剖面(0-100 cm)显著增大(P<0.05),而全氮含量和pH无显著变化。同一土层土壤有机碳含量显著增加,尤其是0-20 cm、20-40 cm和40-60 cm 3个土层分别显著提高了25%、32%和38%;同一土层土壤的全氮含量无显著差异,但整体上呈下降趋势;同一土层的土壤全磷含量呈显著增加,5个土层分别提高了79%、76%、78%、75%和73%。土壤pH随灌木扩张并无显著变化,呈较稳定的弱碱性。结果表明,矮脚锦鸡儿扩张对土壤全磷的影响较大,对土壤有机碳的影响主要集中在0-60 cm,而对土壤全氮和土壤pH的影响较小(表5)。
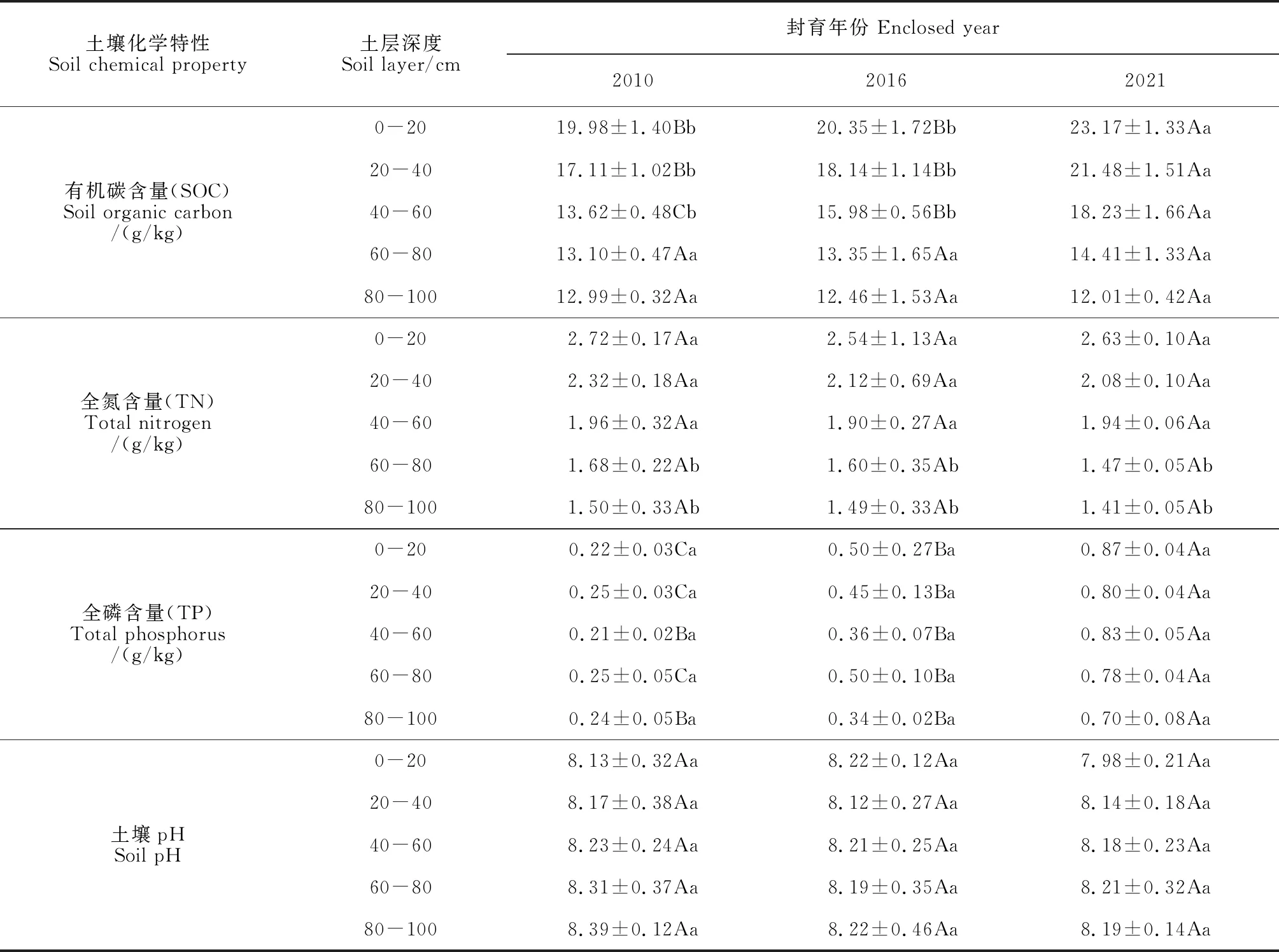
表5 不同封育年限土壤化学特性变化
3 讨 论
当群落中的优势物种由草本植物转变为灌木植物后,原生态系统的结构、功能和过程显著改变[6-7,9,33]。本研究结果表明,灌丛化过程中,灌木矮脚锦鸡儿已经取代了草本植物成为封育草地的优势种,形成了新的灌-草植被景观,引起了地上植被特征和地下土壤理化性质的改变。
灌木扩张改变了草地群落的物种组成、结构和多样性。在长期封育过程中,草地优势种发生转移,由原来的草本植物本氏针茅转变为矮脚锦鸡儿等灌木植物。与矮脚锦鸡儿相比,白莲蒿作为半灌木状根蘖型草本植物,其根系不发达,主要分布在垂直0-10 cm范围内,根蘖性很强[34-35],但其竞争优势较草本植物强,重要值显著增大。而灌木矮脚锦鸡儿的主根粗壮, 其小根和细根主要分布在较深土层[36],其生态效应更大,故本文以矮脚锦鸡儿作为驱动草地灌从化的主要物种。根据D′Odorico等提出的灌木入侵阶段理论,可以判定矮脚锦鸡儿已在2021年的草地群落中定居[37],并与其他草本植物竞争草地中的有限资源(光照、温度、水分和养分等)。灌丛化引起封育草地地上总生物量增加,这与Zhou等[5]、彭海英等[20]、安琪琪等[28]、单贵莲等[38]、郭璞等[39]的结果相近。天然草地发生灌丛化后,群落的总盖度和高度均增大,而群落的物种丰富度与多样性指数均有降低,但群落均匀度显著提高,这与于露等[40]、班嘉蔚等[41]的结果不同。矮脚锦鸡儿作为豆科植物,其根瘤具有较强的固氮作用,可使灌丛斑块冠层下方的土壤肥力高于草地斑块,形成“沃岛”[42-43],进而提升周围土壤的水分和养分,使群落地上总生物量大幅增加。根据Ryel等[44]提出的“资源库假说”(resource pool hypothesis),植物在区域小环境内争夺土壤养分以及水分等资源时,土壤浅层资源库首先被消耗,根系较浅的一年生草本或多年生草本植物会很快死亡或衰老,而根系发达的灌木则利用土壤深层的维持库维持其正常的生理活动存活[45-46],因此深根系的矮脚锦鸡儿相比2010年草地建群种浅根系的草本植物本氏针茅具有更强的忍耐力和竞争力,能得到更好的生长发育,故灌木植物的生物量显著增加,草本物种数和生物量均减少。此外,相比其他灌木,矮脚锦鸡儿较低矮且冠幅较小[47],郁闭度不高,对于其他植物产生的“生态位互补”效应不显著,因此即使群落物种丰富度降低,但仍出现了一些新的草本物种。整体来看,灌木扩张驱动草地群落类型转为低丰富度高均匀度型的灌-草复合型生态系统。
灌丛化可导致深层(60-100 cm)土壤容重显著增加,而浅层(0-60 cm)土壤容重无显著变化,这表明土壤容重只在地下深层区域对灌木扩张有响应,而土壤含水量整体上无显著差异。除0-20 cm土层外,其余土层储水量皆随灌丛化过程呈上升趋势,且土层储水量随土层深度增加呈先减少再增加趋势,并于40-60 cm层达到最低值,这与于露等人[40]的研究结果相似。根据Walter[48]提出的“两层假说”(two-layer hypothesis),植物根系处于不同的生态位,利用着不同深度的水资源,草本植物的根系主要分布在土壤表层,主要吸收土壤浅层的水,而灌木的根系主要分布在土壤深层,主要吸收深层的水,所以二者互不干涉,Dodd等[49]和Germino等[50]的野外观测实验也证实了这一点,这可能是浅层土壤容重和含水量无显著差异的原因。其次,植物根系的生长发育会改变土壤的孔隙,使相对互通的大孔隙增多,土壤入渗率上升[51],且灌木根系最深能到达40-60 cm土层,因此土壤储水量在浅层0-60 cm递减,在深层60-100 cm递增。本研究结果表明灌木入侵导致地上植被盖度降低,而盖度大小会对地表水分蒸发产生影响[52-53],故在灌木入侵后地表裸露导致降雨后水分蒸发强烈以及地表径流增大,因此0-20 cm土层的土壤储水量相对较低。
灌丛化使得土壤有机碳含量在浅层(0-60 cm)显著增大,这与Li等[54]和赵亚楠等[55]的研究结果相似,草地中的大部分植物为浅根系,养分循环和累积主要集中在较浅土层进行,这可能是只有浅层土的土壤有机碳对于灌丛化有积极响应的原因。土壤的全氮含量无显著差异变化,也与李小军等[56]和Mccarron等[21]的研究结果相近,但土壤氮不仅受土壤母质的影响,还受凋落物分解及植物根系输入的影响[57],仅从矮脚锦鸡儿的入侵角度来考虑,还不足以明确土壤全氮的变化。随着矮脚锦鸡儿的扩张,草地土壤全磷的含量上升,这与熊炳桥等人[58]的研究结果相似;土壤磷含量主要受到渗透率[59]和“沃岛”效应、土壤酶含量与活性以及禁牧措施等的影响。随着灌木入侵,土壤渗透率增大,使得土壤磷含量显著上升,并且在群落演替中,灌木逐渐取得优势地位,草本植物凋亡后其养分被灌木所利用,而灌木依赖自身范围广、深度大的根系活动从周边区域吸收磷元素,进而使得磷元素在灌木根系附近富集,根系分泌物及脱落物也会使得土壤磷含量显著上升[60]。其次,灌丛化会引起土壤团聚体中磷酸酶和蛋白酶含量与活性降低[61],这导致土壤中含磷有机体分解缓慢,也会使得土壤磷含量升高。另外,禁牧措施也有效减少了生态系统中土壤磷元素的输出,使得土壤中磷元素能够得到积累,这与顾振宽等人[62]的研究结果相似。
近期的一些研究表明,围栏封育可以引起草地灌丛化,如董珂等[23]、鞠晓峰[63]、王凌菲等[64]研究均发现封育处理可使灌木、半灌木功能群地上生物量持续增长,封育群落呈灌丛化趋势明显。本研究也通过阐述封育条件下灌木扩张对群落组成结构和生物量和土壤特性这一系列问题的影响,也从侧面说明了这一成因。对于灌丛化对草地生态系统的长远影响,有观点认为灌丛化导致群落结构单一化和土壤水分养分的流失,这会加速草地退化的进程;也有观点认为灌丛化一定程度上可以防止和减缓草地退化,而本研究结果更倾向于第二种观点,草地群落会逐渐趋于另一种稳态(草本态-灌木态)。此外,生态系统具有一定的自我恢复和调节能力,灌草系统内部的植物间相互作用(竞争、正相互作用和中性作用)也会随外界环境以及生境的变化进行自我调整[65]。因此,未来研究需要持续关注灌-草以及草-草之间的相互作用。

