原位成像检测活性酶的分子荧光探针研究进展
张 龙,黄众熙,沈 倩,鞠霖杰,吴 琼,余昌敏*
(1.南京工业大学 柔性电子(未来技术)学院,江苏 南京 211816;2.南京医科大学 附属肿瘤医院,江苏 南京 210009)
1 引言
活性酶不仅是各项生命活动的重要组成,同时也与疾病的发生有关[1-3]。例如,实验研究表明急性胰腺炎(Acute pancreatitis,AP)的腺泡细胞损伤与组织蛋白酶B 依赖的胰蛋白酶激活密切相关[4];抑制天冬氨酸蛋白酶β-淀粉样前体蛋白裂解酶1(Beta-Amyloid precursor protein lyase 1,BACE1)是降低阿尔茨海默病(Alzheimer's disease,AD)的一种有前景方法[5];基质金属蛋白酶(MMPs)使其他可溶性或膜表达的介质分子失活或激活,使它们能够控制发育过程、组织重塑、炎症反应和增殖信号通路,MMPs 的失调早已在急性肾损伤和慢性肾病中得到认可[6]。现代医学已经有多种技术用于检测活性酶,例如核磁成像、单光子发射计算机断层成像(Single photon emission computed tomography,SPECT)以及正电子发射计算机断层成像(Positron emission computed tomography,PECT)[7],这些成像技术有着特定的灵敏度、空间分辨率以及穿透深度[8]。然而,目前现有的诊断方法不能直观地反映因疾病导致活性酶的表达异常,以此区分疾病的进展期,这容易错过最佳治疗阶段[3]。因此,有着较好特异性以及一定组织穿透力的荧光探针进入临床医学诊断中。生物活性酶荧光探针可以通过检测酶的水平以及生物成像,判断疾病类型以及进展期,还可以对治疗方案的有效性进行反馈,促进相关抑制剂以及药物和新型医疗方案的开发。
现今在荧光生物成像领域,研究者已经开发了多种类型荧光探针,包括肽探针、纳米粒子探针以及分子荧光探针。基于蛋白酶的特异性底物例如抗体、结蛋白等开发了肽探针,肽探针对蛋白酶具有特异性表达并且蛋白酶对肽链作用改变结构进而引发荧光信号。这类探针具有较好的生物相容性以及灵敏度,但是分子式的尺寸大小会对肿瘤结合有所影响,肽链分子结构尺寸较大,可能会增加体内的循环时间,增加体内背景信号强度[9]。纳米科学与生物技术的联合也让荧光探针领域诞生了纳米荧光探针的研究,纳米材料具有更高的光稳定性,纳米结构可以作为载体与其他方法结合使用,以实现更强大的成像和治疗功能[10-11]。然而,临床实验中大多数纳米粒子被网状内皮系统吸收,导致肿瘤组织内分布不均,并可能对肝、脾和肺等关键器官产生毒性作用[12],为此有针对性地开发出胶囊式纳米粒子探针,不过仍需要对该类探针的安全性进行长期评估。
分子荧光探针作为活细胞成像的强大工具,由于其非侵袭性以及灵敏度高、检测限低、响应时间快和生物相容性好等特性[13-17,近年来,许多研究小组已经成功地开发了一系列用于细胞内离子、代谢物、蛋白质(包括酶)、细胞器和不同类型的细胞/组织的检测小分子成像探针[18-21],这些方案也逐步应用于现代医学诊断中。19 世纪末,亚甲基蓝荧光染料让科研人员确立了进行体内染色病原体可视化诊断的想法;随后,20 世纪小分子近红外染料吲哚青绿(Indocyanine green,ICG)被美国食品和药物管理局批准用于常规临床使用,可以为肝脏肿瘤手术进行术中导航[22]。在此基础上许多分子靶向荧光探针已被开发出来,如利用叶酸受体-α 靶向卵巢癌这一肿瘤特异性,设计的荧光探针成功在人体内实现了术中导航[23]。这些荧光团在光源的照射下吸收光子达到激发态,能量在回到基态时,由于分子振动以及弛豫现象而损失,从而发射出波长能量相较于吸收光低的荧光,产生斯托克斯位移,这也是分子荧光探针的理论基础[24]。然而,这类小分子探针存在缺乏特异性、主动靶向性、在生物体内易扩散以及组织穿透力差等问题[25-27]。分子荧光探针在检测蛋白质活性以及生物成像领域已经有了漫长的发展历史,科研人员一直被小分子的毒性低、组织渗透能力好、可代谢能力强等优点所吸引。近年来,近红外Ⅰ区以及近红外Ⅱ区的荧光探针增强了探针的组织穿透能力,因此更多的高灵敏度、高选择性、特异性表达的分子探针被开发出来[28-31]。
2 分子荧光探针响应机制及其检测活性酶面临的问题
分子荧光探针因为其尺寸小和结构明确,带来了许多优势。如图1 所示,根据分子荧光变化,探针荧光的响应机制可以分为荧光共振能量转移(Fluorescence resonance energy transfer,FRET)[32]、分子内电荷转移(Intramolecular charge transfer,ICT)[33-34]、光诱导电子转移(Photoinduced electron transfer,PET)[35]、激发态分子内质子转移(Excited state intramolecular proton transfer,ESIPT)[36]、聚集诱导发射(Aggregation-induced emission,AIE)[37]、多模态荧光方法(Multimode fluorescence method)等[38-39]。参考以上机制,分子荧光探针结构上的设计大部分由荧光团、连接剂、识别基团三个部分组成[40]。然而,尺寸小也带来了一些问题。小分子荧光团在生物体内有着易扩散以及易被快速代谢等问题,导致荧光团分子的扩散,特别是水溶性荧光团,无法提供高时空分辨率的原位实时成像(图2)。因此,分子荧光探针的原位成像功能特别是酶的原位检测,目前在该领域备受关注。随着科研人员的不断探索,分子荧光探针检测生物活性酶并原位成像得到了巨大发展,但仍然存在一些问题。分子荧光探针生物成像存在因为激发光或发射光波长较短造成的光损伤问题,而且一些常用荧光团无法较好展示精细的生物组织结构或者会受到生物组织散射光的影响。分子荧光探针的检测限也是需要考虑的,较低的生物标志物检测限可以更好地表达不同浓度生物标志物,有助于成像后的区分;同时,探针的灵敏度、特异性识别也需要注意。最后,尽管部分探针已经进入临床,但是仍然无法满足临床需求,临床转译工作仍需努力。
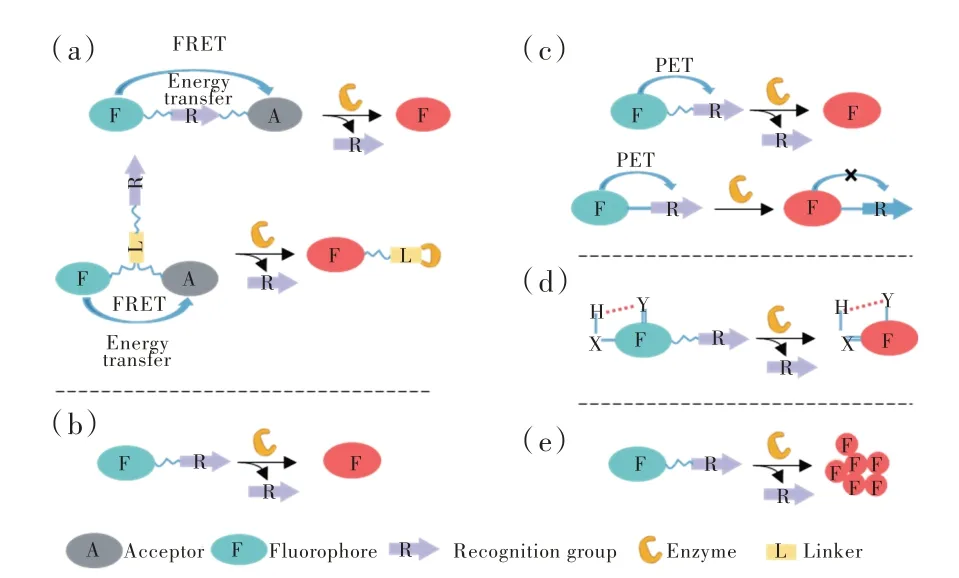
图1 荧光响应机制示意图。(a)FRET 机制;(b)ICT 机制;(c)PET 机制;(d)ESIPT 机制;(e)AIE 机制。Fig.1 Schematic diagram of fluorescence response mechanism.(a)FRET mechanism.(b)ICT mechanisms.(c)PET mechanism.(d)ESIPT mechanism.(e)AIE mechanism.

图2 活性酶原位成像和非原位成像对比示意图。(a)荧光探针用于原位成像与非原位小鼠组织成像对比;(b)细胞内活性酶与探针共价(上图)或非共价原位成像对比(下图)。Fig.2 Schematic diagram of enzyme in situ imaging.(a)In situ and non-in situ probe mouse tissue imaging.(b)Cell enzyme and probe covalent(top)or non-covalent in situ imaging(bottom).
综上,本文将主要探讨近几年分子荧光探针用于检测酶的活性以及原位成像的设计策略,并对这些策略进行汇总,希望对该领域的研究者们提供一些启发。
3 分子荧光探针原位检测活性酶设计策略
分子荧光探针是在生理条件下检测和成像生物重要酶活性的宝贵工具,这些成像试剂大多依赖于酶刺激时荧光强度或发射波长的变化来报告酶活性。与大分子试剂相比,小分子具有更高的细胞渗透性和代谢性。然而,生命物体不同于实验室环境中稳定的和严密测试的溶液,是高度动态和开放的系统;小分子探针容易在生物体内扩散,导致信号背景比下降。为了提高荧光团在目标酶及其附近的保留时间,一些设计策略随之被开发。这些策略可以简单地分为共价方法和非共价方法。第一种是在酶促作用下探针形成反应中间体,酶蛋白结构中的亲核基团进攻探针形成的反应中间,两者以共价键的形式连接,减少了荧光染料的扩散,进而实现原位成像。第二种方案是利用酶裂解连接剂使得荧光探针的水溶解度降低,荧光团通过聚集或自组装非共价成键方式停留在活性位点附近。因此,本文将主要针对这两种探针设计策略,探究蛋白酶原位成像技术的研究进展。
3.1 基于(酰氧基)甲基酮反应基团的分子荧光探针
(酰氧基)甲基酮((Acyl oxygen)methyl ketones,AOMKs)探针是一种与半胱氨酸蛋白酶发生反应脱去AOMKs 反应基团与蛋白酶形成硫酯共价键,常用于开发半胱氨酸蛋白酶的抑制剂以及相应的活性探针,活性探针的开发原理是通过形成共价键达到成像的能力[41-42]。
2007 年,Bogyo 团队利用以上成像原理首次开发了可“开关”的组织蛋白酶小分子近红外荧光探针[43]。探针成功地对小鼠活体在肿瘤、肝脏、脾脏和肾脏组织中标记了相同的三种组织蛋白酶,并通过组织蛋白酶抑制剂处理成像进行了验证;该研究表明AOMKs 反应基团可以引入原位分子荧光探针用于半胱氨酸蛋白酶的检测。随着半胱氨酸蛋白酶的AOMKs 抑制剂转化为小分子活性探针(Active base probes,ABPs)的研究不断进行,Bogyo 团队筛选了半胱氨酸蛋白酶抑制剂库,设计了关于类泛素化蛋白酶(Sentrin specific proteases,SENPs)的含AOMKs 反应基团的抑制剂以及活性检测探针GB137(图3(a))[44]。含有Cy5 染料的AOMK 探针对hSENPs 的标记效果较好(图3(b)),同时也证明了探针是由于hSENPs 活性位点半胱氨酸的修饰拥有的标记能力,可以作为SENP 的高选择性探针。随后,该团队为丁香假单胞菌产生的分泌木瓜蛋白酶样Ⅲ型效应物——AvrPphB 合成了一种AOMK 探针[45],开发了一种荧光强度更好的荧光团FH11,用来更好地识别标记蛋白酶。至此AOMKs 基团修饰分子荧光探针用于生物成像的可行性得到了证明,小鼠实验的成功说明该类探针具有用于半胱氨酸蛋白酶原位成像的潜力。
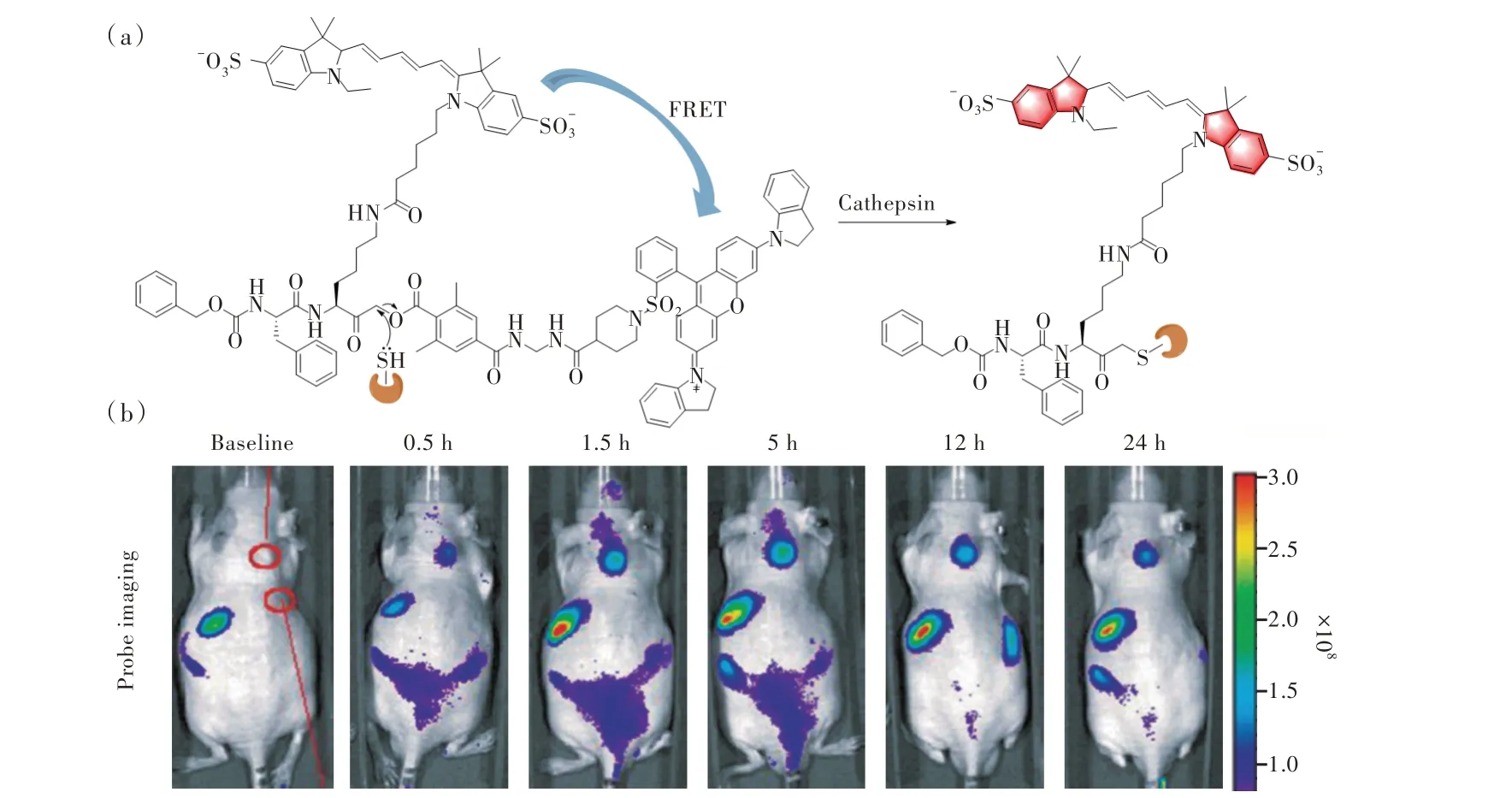
图3 (a)探针GB137 与组织蛋白酶原位成像的响应机理;(b)探针用于原位标记活体荷瘤小鼠生物成像[44]。Fig.3 (a)Response mechanism of probe GB137 and cathepsin in situ imaging.(b)Optical in situ imaging of cathepsin with probe GB137 in mice tumors,bright-light images[44].
同样地,Drag 团队研发了标记组织蛋白酶B的分子荧光探针用于蛋白酶的可视化成像和检测(图4(a))[46]。该团队为了设计蛋白酶选择性底物,使用了两个化学库分析组织蛋白酶B 在P4-P1的位置偏好,实现这些底物可以不被其他类型组织蛋白酶水解。然后将选择性底物转化为AOMK反应基团的抑制剂,最后用Cy5/Cy7 荧光染料进行修饰得到探针。实验证明,通过增加一个ahx连接器可以增加探针的保留能力以及组织蛋白酶L 和S 的标记,含有Cy5 染料的探针MP-CB-2 相比于Cy7 可以被肿瘤细胞吸收并对组织蛋白酶B 有较高的选择性(图4(b));随后通过18 个不同的癌细胞株发现探针对组织蛋白酶B 的选择性较好,并发现探针信号和组织蛋白酶L 抗体染色在被测细胞系中有很大的重叠,这表明组织蛋白酶B 和L 具有相同的内溶酶体区,而且还验证了A-431 细胞的细胞核中存在组织蛋白酶B。该探针虽然无法进行荧光的“开关”,但从生物细胞的成像结果上证明了AOMKs 基团应用于分子荧光探针进行原位成像的能力。
AOMKs 对半胱氨酸蛋白酶有较高的选择性,目前众多科研团队选择该类反应基团进行半胱氨酸蛋白酶活性探针以及抑制剂的开发[47-48]。AOMKs 现在更多用于相关抑制剂的开发中,抑制剂转化为活性探针的进程也在持续更新;目前荧光发射标记类的探针由于荧光发射光谱的重叠,限制了平行检测和可视化的酶的数量,从而限制了它们在多参数分析中的应用[49]。同时,该探针对其他酶的特异性表达能力弱,仅适合用于半胱氨酸蛋白酶的成像与标记。
3.2 基于Aza 醌甲基反应中间体的分子荧光探针
在以往的研究中,Aza 醌甲基结构适用于生物灭活剂[50-51],随着科研人员的不断探索,以香豆素衍生物作为荧光团基本框架的分子荧光探针开发出来。这类探针在酶的作用下形成高活性醌甲基反应中间体,然后由目标酶或附近蛋白质的亲核残基进行迈克尔加成,以共价锚定激活位点周围的荧光团实现原位成像功能;这种探针设计策略在糖苷酶、磷酸酶、类固醇硫酸酯酶等荧光成像中得到了应用[52-54]。Yao 团队开发了一类用于胱天蛋白酶(Cysteinyl aspartate specific proteinase,Caspases)以及蛋白质酪氨酸磷酸酶(Protein tyrosine phosphatases,PTP)的Aza 醌甲基反应中间体荧光探针[55],所得到的荧光探针通常处于“关闭”状态,在这种状态下,荧光团因为FRET 效应被猝灭剂有效猝灭(图5(a))。由于设计分子尺寸较大,需要提前进行细胞渗透,在引入到细胞和酶对酶底物的裂解后,1,6-消除反应导致猝灭剂离去,探针释放荧光和醌甲基中间体。P1 探针对胱天蛋白酶具有良好的响应,P6 探针可以对PTP 进行双光子成像(图5(b)、(c))。随后,该课题组在探针P5 基础上加入细胞穿透肽(CPP)以解决渗透问题。该类探针通过利用这种中间体的反应性和扩散性,实现足够酶定位的空间分辨率,能够不灭活目标酶,允许在原位放大目标信号。该实验对醌甲基探针的作用机制进行了较好的阐述,也表明醌甲基结构应用于分子荧光探针仍然有着优异的生物相容性。

图5 (a)猝灭型活性探针的设计及其原位标记活性酶的机理;(b)P1 探针在凋亡HeLa 细胞中原位检测caspase-3/7 活性的共聚焦荧光图像;(c)P6 探针在HeLa 细胞中单光子和双光子成像[55]。Fig.5 (a)Overall design principle of the quenched activity-based probes(qABPs).(b)Confocal images of caspase-3/-7 activities using P1 in apoptotic HeLa cells and confirmed with immunofluorescence staining.(c)Confocal images of PTP1B overexpressed HeLa cells with P6 under two-photon excitation(800 nm)and one-photon excitation(543 nm)[55].
Withers 团队于2011 年发表了含双氟基团的Aza 醌甲基中间体可以原位固定的检测糖苷水解酶的分子荧光探针(图6(a))[56]。双氟甲基结构相对于单氟结构有较好的水溶性、便捷的合成路径以及较高的原位标记[57]。该类探针可以用于农杆菌β-葡萄糖苷酶/半乳糖苷酶(Beta-glucosidase/galactosidase,Abg)的生物成像,表明醌甲基结构探针广泛的生物应用,对于人体病原体感染探针原位成像也有着较好的借鉴。随后该团队于2018 年在原来研究的基础上发表了一个非特异性的唾液酸酶分子荧光探针(T1,图6(b))以及一个特异性流感病毒神经氨酸酶(NA)成像的分子荧光探针(T8,图6(b))[58],可以近距离连接的试剂在唾液酸酶/神经氨酸酶作用后在酶周围环境共价标记。T1 探针对MDCK 细胞的内源性唾液酸酶有较好的荧光标记,在抑制剂N-乙酰-2,3 脱氢-2-脱氧神经氨酸(N-acetyl-2,3-dehydrogen-2-deoxyneuraminic acid,DANA)作用下信号有所降低。由于T1 探针的非特异性,无法区分唾液酸酶的类型,在检测流感病毒感染的MDCK 细胞的NA和唾液酸酶时,使用NA 抑制剂奥司他韦信号没有降低,而DANA 效果较好,这表明细胞标记是由于唾液酸酶导致的(图6(c))。在唾液苷部分的C4 和C7 位置引入甲基可以增加探针的选择性[59],在使用奥司他韦以及DANA 处理后,T8 探针的荧光效果有所减弱,说明该探针是NA 特异性底物(图6(c))。实验结果充分说明了醌甲基探针在生物成像上的广泛应用,对于植物以及动物病原体侵入的原位成像以及诊断具有巨大潜力。

图6 (a)含双氟甲基探针结构式及其检测农杆菌β-葡萄糖苷酶/半乳糖苷酶(Abg)作用原理[56];(b)神经氨酸酶探针T1和T8 的设计结构及其原位荧光标记酶的作用机制;(c)T1 探针(c1)以及T8 探针(c2)在流感病毒感染后对MDCK 活细胞内神经氨酸酶的原位荧光成像照片[58]。Fig.6 (a)The structure of the probe containing difluoromethyl and its mechanism for detecting Abg[56].(b)The structure and its mechanism of T1 and T8 for in situ detection of neuraminidase.(c)Confocal images of influenza-infected MDCK cells after incubation of T1(c1)and T8(c2)probes[58].
根据上述机理,Xie 团队设计了检测γ-谷酰基转肽酶(GGT)的自固定近红外分子荧光探针[60]。在GGT 作用下探针在715 nm 处荧光信号显著增强,实现了在活体小鼠中对GGT 特异性可视化成像。响应后的分子可以因共价作用保留在肿瘤内增大荧光效果时间,对GGT 可以进行免洗以及实时荧光成像。探针与传统设计一样由识别基团、连接剂以及荧光团三个部分组成,含有甲基的氨基甲酸乙酯作为离去基团使得反应后少量羟甲基化HD 染料A2 成为Aza 醌甲基反应中间体,引入两性离子增加探针的水溶性。探针荧光被对氨基苯酚连接剂猝灭,在GGT 作用下水解得到不稳定中间体释放氨基甲酸乙酯形成Aza 醌甲基中间体,与GGT 周围的蛋白质亲核基团攻击,形成共价键释放荧光信号。在活体小鼠实验中,探针对肿瘤组织以及肝脏和肾脏具有GGT 活性的组织器官都有荧光信号释放。相比对照组,醌甲基自固定荧光探针有着较好的原位成像以及较高的荧光信号,也说明了该类探针在生物成像以及进行深入肿瘤诊断的发展潜力。
研究表明衰老时表达相关β-半乳糖苷酶(Senescence-associated β-galactosidase,SA-β-Gal),且衰老细胞可能会随着年龄的增长而积累,因此相关的荧光探针也开发出来[61-62]。Cui 团队开发了一种用于检测药物诱导体内衰老的自固定分子近红外荧光探针(图7(a)、(b))。Aza 醌甲基中间体与酶亲核基团结合,实现了更长时间的保留,双氟甲基相对于单氟甲基的加入增强了原位近红外信号的强度,为SA-β-Gal 酶提供了新的分子荧光探针策略[63]。该团队使用喜树碱(CPT)处理,诱导HeLa 细胞的细胞衰老,在未处理细胞及处理细胞成像以及冲洗后成像证实了双氟结构具有良好的原位近红外成像能力(图7(c))。在小鼠实验中,经过CPT 处理的相比于接受生理盐水处理的对照组的肿瘤荧光强度明显增加,具有相同的实验结论(图7(d))。该探针利用近红外荧光团以及原位共价自固定方式对细胞衰老相关糖苷水解酶进行原位检测,为检测SA-β-Gal 酶提供了一个新的思路,也为相关领域的研究提供了较好的观察方法。

图7 (a)NIR-BG1 和NIR-BG2 探针结构及其对化疗诱导的体内衰老进行无创伤成像机理;(b)探针NIR-BG1 和NIRBG2 的体外光谱学性能;(c)探针在HeLa 细胞内对SA-β-Gal 原位荧光成像照片;(d)CPT 处理的小鼠肿瘤模型原位荧光成像,NIR-BG1(上)或NIR-BG2(下)[63]。Fig.7 (a)The structures and their noninvasive imaging mechanism of chemotherapy-induced senescence in vivo using probe NIR-BG1 or NIR-BG2.(b)Photophysical properties of NIR probes NIR-BG1 and NIR-BG2.(c)Confocal images of HeLa cells incubated with NIR-BG1 or NIR-BG2.(d)Live animal in situ imaging of CPT-treated HeLa xenografts mice after tail vein injection of NIR-BG1(top)or NIR-BG2(bottom)[63].
3.3 基于反应基团的重氮茚酮和识别基团用于转基因酶
通过罗丹明与重氮茚酮结构的结合与修饰开发出了一系列可以应用于生物细胞活体成像的荧光染料。Hell 团队设计了五种罗丹明N=N 结构染料,染料可以被常见光源激活,这类结构染料可以与蛋白质结合,重氮茚酮笼化基团的尺寸减小导致笼化染料的结构紧凑,有利于穿透细胞膜,光激活可以方便地生成一个无害的二氮分子作为离去基团[64]。该团队初步证明了这类探针的响应机制,并对探针的生物应用进行了一定的评估。受到上述启发,Rivera-Fuentes 团队通过这种存在生物相容性、荧光发射波长长以及与蛋白质结合有巨大潜力的染料[65],对结构进行修饰得到双激活的高分辨率荧光探针,并对该探针作用机制以及生物原位成像应用进行了测试(图8(a))。该设计方案是利用重氮茚酮的光激活发生沃尔夫重排,使得荧光团的荧光发射更强,同时烯酮中间体与酯酶发生共价反应连接实现原位成像能力。小分子探针首先受到酶促作用对酚羟基去乙酰化,使得抑制荧光作用减弱。同时在不同激发波长光的照射下,所得到的中间体结构也不一样。该团队选用了适合人体的激发波长405 nm,在该波长激发光的照射下发生沃尔夫重排,得到的烯酮中间体可以在酯酶及其附近发生共价反应,减少在细胞内的扩散达到原位成像水平(图8(b))。该团队探索了双激发重氮茚酮结构在生物细胞体内的作用机制,表明了该类结构用于原位检测活性酶的能力,同时为罗丹明染料作为生物荧光染料提供了一个新的发展方向。随后,该团队再次开发了对硝基还原酶进行检测的重氮茚酮结构的分子荧光探针[66]。探针本身以及在被硝基还原酶催化硝基芳香族化合物还原为苯胺后没有荧光发射,在激发光照射后,重氮茚酮结构发生沃尔夫重排得到烯酮中间体发出荧光。实验中看出荧光产物会受到吸电子基团硝基的抑制,中间体与酶的蛋白亲核片段发生共价反应,该中间体在极性溶剂中有较高的量子产率,减少了和水以及亚硝基的亲核反应的概率,增大了原位成像的能力。这次实验不仅展示了这类探针强大的原位成像能力,同时通过聚焦共定位实验论证了硝基还原酶主要存在于线粒体中且分布不均匀。
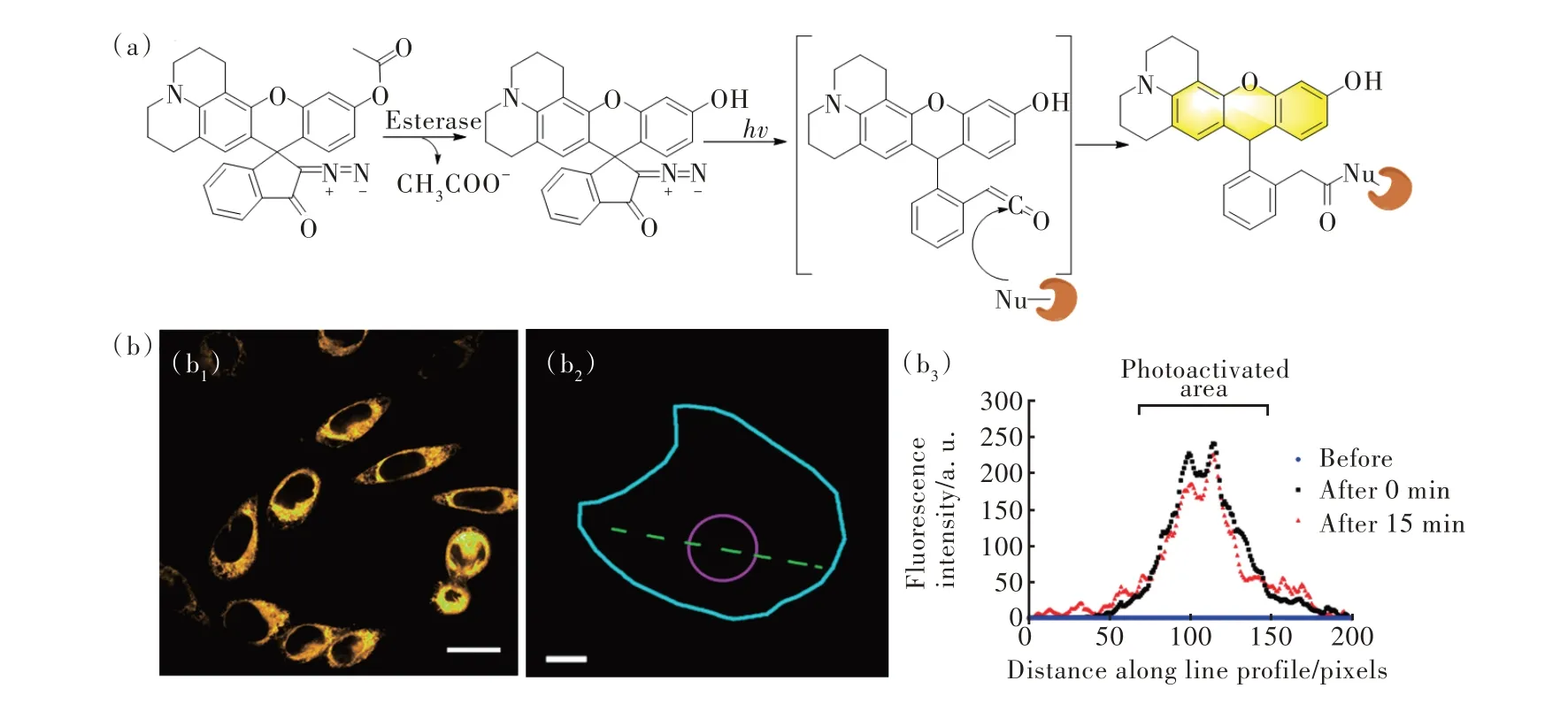
图8 (a)酯酶和光照双激活原位分子荧光探针的响应机制;(b)探针与HeLa 细胞孵育后不同波长激光激发共定位成像[65]。Fig.8 (a)Response mechanism of double-activated in situ small molecule fluorescent probes.(b)Colocalization imaging of HeLa cells with probe 1 after photoactivation(b1)and before photoactivation(b2),line profile(dashed green line in b2)(b3)[65].
利用重氮茚酮与罗丹明染料的修饰思路已经得到了一些具有生物相容性潜力的新型荧光染料,并且借助光激活后的烯酮中间体与蛋白质亲核基团的共价反应实现原位成像减少分子扩散,这些策略对今后开发重氮茚酮类的分子荧光探针有所帮助和启发。设计研究时也需要考虑生物大环境中水分子这种含量最多的亲核试剂对这类探针的影响,可以通过改变环境溶剂极性大小对荧光强度变化进行选择[67]。酶促反应与光激活需要同时进行,这也是探针临床转化的一项挑战。
3.4 基于构象变化引起的电子转移机制
不可逆抑制剂可以通过较强的共价键形式与酶蛋白中的基团结合,研究人员利用该性质,在荧光团、不可逆抑制剂以及抑制结合剂的基础上进行合适的化学修饰,在酶的作用后使探针发生构象变化,得到新型原位成像分子荧光探针。
Peng 团队合成了用于检测环氧合酶-2(COX-2)用于区分炎症、肿瘤以及正常细胞的分子荧光探针[68],探针在基于化学修饰的吲哚美辛(Indomethacin,IMC)与硝基苊醌(Nitro benzoquinone,NANQ)荧光团的连接,选择一种线性烷基二胺作为连接剂,在一端与吲哚美辛形成酰胺键,在另一端与荧光团形成仲胺键(图9(a))。在COX-2 缺失的亲水环境下,探针处于平面折叠状态,此时结构能量最低,并且由于NANQ 与IMC 两平行平面之间的电子转移(PET)荧光被猝灭;在COX-2 过表达的炎症和癌症中探针的抑制剂会识别结合这种氧化还原酶,分子部分进入酶狭窄的疏水空腔内,导致构象被迫展开,荧光恢复[69]。体外测试中,该探针展现了在不同COX-2 浓度下荧光发射波长的变化。由于环境亲水性以及疏水性的改变,在疏水性环境中探针发射波长为526 nm,在亲水性环境中发射波长为595 nm。并且通过小鼠癌症组织以及炎症组织成像,在绿色通道((555 ± 20)nm)中小鼠癌细胞组织荧光增强,在红色通道((615 ± 20)nm)中小鼠炎症组织荧光显色增强(图9(b)),证明探针具有区分癌细胞以及炎症的能力。后面的小鼠成像进一步证实了这个观点,同时也表明了探针在应用于术中导航的潜力。随后,该团队选用塞来昔布作为抑制剂、萘酰亚胺作为荧光团以及阿司匹林作为抑制剂、萘酰亚胺作为荧光团对COX-2 进行检测[70-71]。
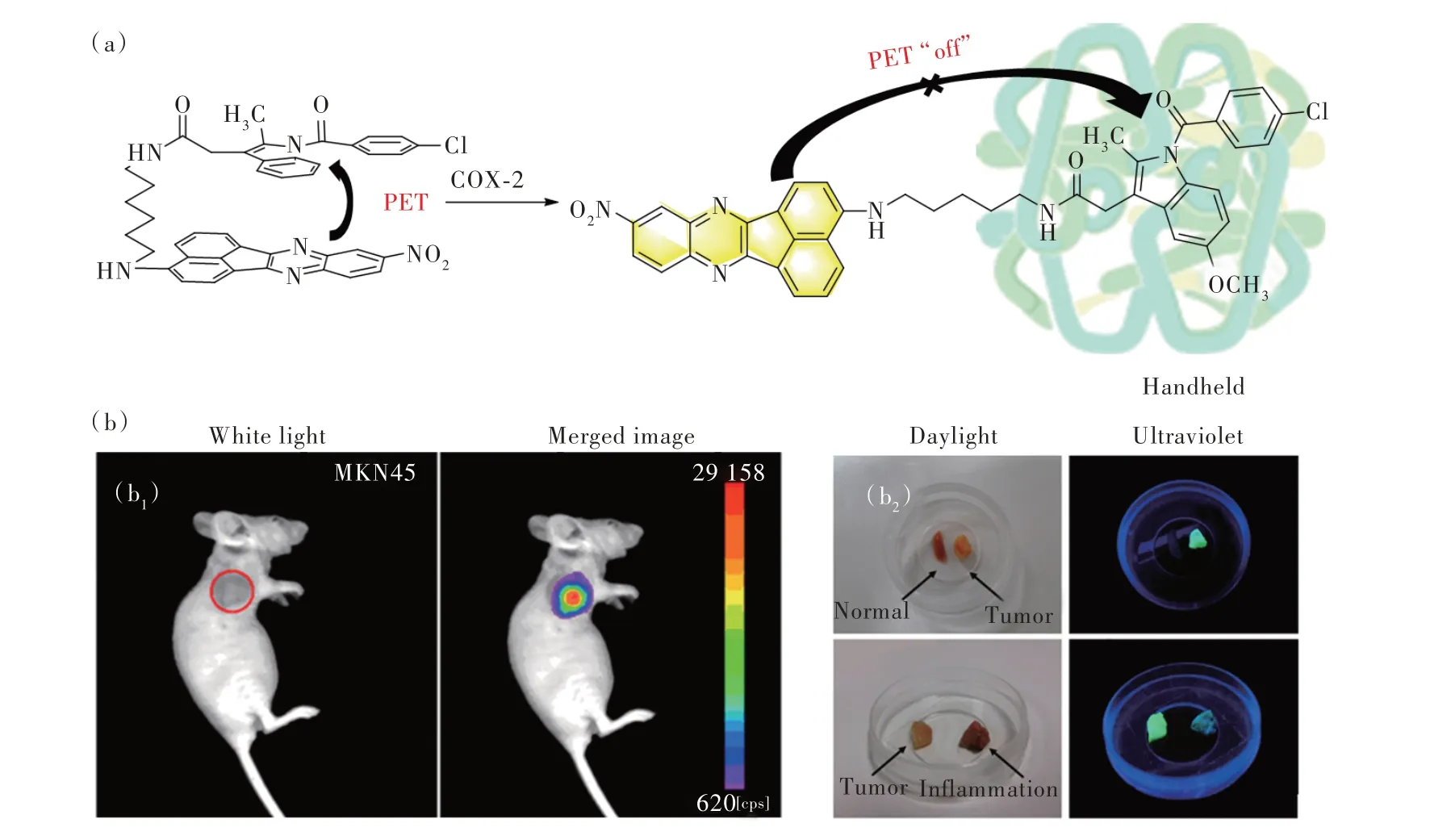
图9 (a)构象变化引发电子转移的NANQ-IMC6 探针荧光检测机制;(b)裸眼荧光引导下肿瘤切除术的操作图片:(b1)小鼠体内肿瘤成像,(b2)紫外线照射下肉眼可见肿瘤切除情况[68]。Fig.9 (a)The mechanism of the probe NANQ-IMC6 via conformational change triggering electron transfer.(b)Possibility of naked eye fluorescence-guided resection of tumors:(b1)imaging tumors in vivo,(b2)visualization of tumor resection by the naked eye under ultraviolet illumination[68].
Lv 团队依照上述策略设计了IMC 作为抑制结合剂、近红外七甲氨酸菁作为荧光团[72]、己二胺作为连接剂的近红外分子荧光探针,并成功对肺纤维化细胞以及小鼠模型的COX-2 可视化。这种策略利用不可逆抑制剂与酶的高度选择性和共价结合以及活性COX-2 酶作用探针诱发空间构象,改变控制PET 作用影响荧光“开关”,减少了因为抑制剂降低酶的活性导致探针荧光处于总是打开的状态,提高探针的原位成像能力。
这类探针展示了一种新型活性酶共价原位结合方式,利用不可逆抑制剂的特异性选择以及高强度共价结合能力、己二胺良好的延展性以及分子间距对PET 机制影响,设计出针对COX-2 氧化还原酶高效生物原位成像的分子荧光探针。但是该类探针目前仅针对COX-2 进行了大量设计,其他类型的酶还没有太多相关报道,后期需要对其他不可逆抑制剂进行筛选,对其他酶的结构进行分析,设计出荧光团与抑制剂较好的结合方式。
3.5 基于酶促作用的固态荧光团原位沉淀
固态荧光成像是原位成像的一种常见策略,相较于水溶性荧光团易扩散至整个细胞,固态荧光团有着较好的沉淀能力,在酶促作用实现原位沉淀后,荧光团能在活性酶附近快速沉淀积累,增强原位荧光信号,降低背景信号,从而提高最终的原位成像分辨率。
Tan 和Zhang 团队基于不溶于水的聚集诱导发射发光物质(AIEgens)——2-(2′-羟苯基)-4(3氢)-喹唑啉酮(HPQ)结构的基础上,研发了新型固态荧光团HTPQ(图10)[73],该荧光团的响应机制是激发态分子内质子转移(ESIPT)。该荧光团有以下特点:(1)有着较大的斯托克斯位移,这不仅有利于荧光成像,还可以增加灵敏度,降低背景信号;(2)高度不可溶性降低了分子扩散有利于沉积,实现了原位成像的能力,染料在固态情况下有着强烈的荧光;(3)荧光团的不可溶性和强烈荧光可以被消除。并以此设计了碱性磷酸酶(ALP)的荧光探针,对酚羟基进行保护阻止ESIPT 机制,达到抑制荧光实现“开关”的功能,探针表现出了较好的原位实时成像能力;同时还能够监测两种骨肉瘤细胞系(U-2OS 和Saos-2)中的ALP 活性。这是首次利用HPQ 固态荧光团进行分子荧光探针的设计,为非共价原位成像探针设计提供了一个崭新的策略。Yang 团队在HPQ 的基础上设计了针对乙酰胆碱酯酶(AChE)、丁酰胆碱酯酶(BChE)、糜蛋白酶(Chy)、羧酸酯酶1&2(Carboxylesterase 1&2,CE 1&2)的固态荧光探针用于追踪残留农药[74],该探针对活体细胞、斑马鱼以及新鲜蔬菜中的代表性有机磷和氨基甲酸酯类农药表现出良好的检测能力,也为分子荧光探针在更多领域应用提供了新思路[75]。

图10 (a)探针HTPQA 的设计策略以及对碱性磷酸酶响应机制;(b)探针HTPQA 在不同浓度的碱性磷酸酶时荧光发射光谱;(c)HTPQA 在HeLa 细胞的实时荧光成像[73]。Fig.10 (a)The design and response mechanism of the probe HTPQA to ALP.(b)The fluorescence emission spectra of HTPQA in the presence of different concentrations of ALP in TBS buffered solution.(C)Real-time imaging of HeLa cells incubated with HTPQA[73].
HTPQ 的量子产率相对HPQ 有所下降,同时四苯乙烯结构的较大空间位阻使得HTPQ 难以设计其他酶的探针,于是Zhang 团队再次开发了一种基于AIE机制的固态ESIPT发射用于检测细胞内溶酶体酶——β-葡萄糖醛酸酶(β-glucuronidase,GLU)的可“开关”分子荧光探针[76],并引用供电子原子硫合成出新型自组装小分子固态荧光团HDPQ(图11(a))。探针识别GLU 后发生酶促作用,酚羟基去保护,荧光团HDPQ 在溶酶体内通过氢键作用发生自组装且激活荧光信号(图11(b))。接着,组装分子荧光团在溶酶体内固态沉积,保持原位性,从而具有长期原位成像以及检测GLU 的能力(图11(c)、(d))。而且由于溶酶体处于酸性环境,荧光团的荧光信号会因此受到限制,荧光团HDPQ 则表现出较低的pH 灵敏度,这也为开发相应的溶酶体酶的分子荧光探针提供了一个新的思路。随后,该团队在此基础上提出将HPQ 融合到简单的半花氨酸共轭体系上,构建了一系列可活化、高稳定性的近红外Ⅱ区J 聚集体,克服了传统J 聚集体对载体的依赖,可以在体内进行原位自组装[77]。通过近红外Ⅱ区J聚集体设计探针HPQ-Zzh-B,并在近红外Ⅱ区成像导航,实现肿瘤的长期原位成像和精确肿瘤切除以及减少肺转移。这一策略将推动可控近红外Ⅱ区J聚集和体内精确生物成像的发展。

图11 (a)探针HDPQ-GLU 的化学结构及其与溶酶体酶GLU 的反应机制;(b)探针HDPQ-GLU 的体外光谱学性质;(c)LPS 诱导L02 细胞炎症中细胞内GLU 的荧光图像;(d)活斑马鱼在不同时期GLU 变化的荧光成像[76]。Fig.11 (a)Chemical structure of the HDPQ-GLU and its response mechanism with GLU.(b)Fluorescence emission spectra of HDPQ-GLU after incubating with GLU in MES buffer.(c)Fluorescence images for detecting intracellular GLU after different incubation times in L02 cells.(d)Fluorescence imaging of GLU in living zebrafish at different periods[76].
固态荧光团原位沉淀的开发是期望保留分子荧光探针毒性小、可代谢等优点的同时,能减少小分子荧光团在细胞组织内的扩散,延长保留时间,达到更好的原位实时成像能力。对于现有的商业固态荧光染料进行修饰改性,也是较为常见的开发生物相容性的新型荧光团以及探针的有力方法。
ESIPT 机制的运用可以有效地增大荧光团的斯托克斯位移,加入供电子基团进行结构修饰改性也可能在增大斯托克斯位移上有所帮助[78],这些是在新型固态荧光团进行初步筛选以及后期改性修饰需考虑的因素。可自组装的固态荧光团需要考虑氢键等分子相互作用后的结构,设计结构稳定以及键长较短(小于0.35 nm,π-π 作用越小越强)的自组装结构也是需要考虑的。
3.6 基于酶促作用发生原位自组装的纳米结构
2004 年,小分子作为酶的底物进行自组装得到了验证[79]。受到上述启发,科研人员将该想法引入分子荧光探针设计中,通过酶促作用,探针以非共价键形式(如静电作用、氢键、π-π 作用、范德华力和疏水作用)实现自组装,在生物活性酶及其周围附着形成纳米结构,达到原位成像的能力[80]。Rao 团队研发了一种检测接受化疗后肿瘤细胞凋亡过程的小分子自组装荧光探针[81],用于区分肿瘤化疗过程的阴性和阳性反应(图12(a))。小分子具有易渗透、生物分布范围广等优势,借助小分子在细胞内生物正交环化反应持续控制自组装形成纳米荧光颗粒,实现细胞组织成像。体外自组装的纳米颗粒在细胞内无荧光信号,证明纳米聚集在细胞内发生,探针可以发生原位纳米聚集,增大保留时间。探针对化疗有效的肿瘤细胞以及组织发生分子内大环化,探针转化大环化分子达到90%,由于阿霉素(DOX)化疗作用肿瘤细胞凋亡时胱天蛋白酶-3/7 被激活,切割L-DEVD capping肽,通过分子间疏水相互作用p-p 堆叠聚集并高度成像(图12(b)、(c)),其他酶的选择性测试都表明探针对胱天蛋白酶-3/7 有高度特异性表达。探针的荧光强度与肿瘤化疗后的大小有着直接关系,这提供了治疗对个体疗效的有力信息。该探针初步实现了生物体内肿瘤化疗效果的检测,为判断肿瘤化疗疗效提供了一个新的思路,也展现了分子荧光探针在生物应用中的巨大潜力。

图12 (a)探针C-SNAF 在人肿瘤异种移植小鼠模型中caspase-3/7 活性的体内成像机制;(b)探针在细胞中自组装荧光纳米聚集体的3D-SIM 成像;(c)探针对荷瘤小鼠细胞凋亡的无创成像[81]。Fig.12 (a)The mechanism of imaging caspase-3/7 activity by C-SNAF in tumor xenograft mouse models.(b)3D-SIM imaging of self-assembled fluorescent nanoaggregates in cells.(c)Non-invasive imaging of apoptosis in tumor-bearing mice[81].
Sun 团队利用聚乙二醇化可以精确将小分子染料NIR-Ⅱ探针从单分子组装到纳米颗粒大小,并研究了尺寸与荧光/药代动力学之间的关系[82]。Ye 团队设计了基于小分子可激活近红外荧光以及核磁共振双模块探针用于分子成像[83],选用细胞膜上过度表达的碱性磷酸酶(ALP)作为靶点,探针可以被ALP 激活定位细胞膜组装纳米颗粒。
近期,Li 团队设计了一种生物活性体内组装(Bioactivatedin vivoassembly,BIVA)荧光探针(图13(a))[84],该探针不仅具有主动靶向机制,而且在酶作用探针后发生聚集组装诱导保留(Aggregation assembly induces retention,AIR)效应进行原位纳米纤维组装。该探针有以下几个较好的设计思路:(1)将探针模块化设计,一共设计了5 个模块,每一个模块对应一个功能。该组在探针分子M1 基础上对相应模块进行裁剪和替换,设计出非对应性反应断裂模块分子M2、无成像模块分子M3、断裂模块反应的R-M1、非对应性靶向模块的M4、无断裂模块以及成像模块的M5、无成像模块并且断裂模块发生反应后的R-M3,这六类分子用于各模块功能机制证明。(2)选择聚乙二醇作为长期循环模块,增加了分子在水溶液中的亲水性以及延长探针在血液传输中的保留时间,让探针有更多的机会在肿瘤细胞周围渗透聚集。(3)酶切作用后探针疏水性增加以及表面氢键暴露,促进自组装形成β-折叠纳米结构纤维(图13(b)),探针纳米纤维化在肿瘤细胞膜周围附着积累,减少分子的扩散以及代谢问题从而增加了荧光信号在肿瘤组织的保留时间,实现了肿瘤的原位实时成像(图13(c)、(d))。最终结果证明,该探针虽然是模块化设计,但最终的性能表现较为优异。成纤维细胞活化蛋白-α(FAP-α)对探针分子具有高度特异性识别,有利于探针在肿瘤内的酶切以及自组装;相对于传统主动靶向机制的荧光探针,这种主动靶向机制以及AIR 效应的联合作用对于延长探针成像窗口期有着一定的启发。

图13 (a)BIVA 探针的化学结构及其在活体中检测机理图;(b)探针在水溶液中自组装结构表征;(c)探针BIVA 与MIA PaCa-2 细胞后形成具有主动靶向性的荧光图像;(d)探针在小鼠模型中的荧光成像及代谢情况[84]。Fig.13 (a)Chemical structure and detection mechanism of bioactivated in vivo assembly(BIVA)probe.(b)Assembled structure conformations and self-assembly behavior in aqueous solution.(c)Confocal images of the probe with active targeting property in MIA PaCa-2 cells.(d)The time-dependent NIR fluorescence image of mice bearing MIA PaCa-2 cells after intravenous administration of ICG,M2 and M1[84].
自组装形成纳米结构降低了小分子扩散造成的背景信号,这种策略也逐渐应用于光声成像、核磁成像等领域[85]。随着可控自组装的发展,科研人员可以通过控制自组装实现控制荧光信号强度,达到聚集诱导猝灭、聚集诱导发射、可调控的单体-外聚体转变等荧光信号变化,一些新型自组装分子荧光探针技术也随之被开发[86]。该策略保留了小分子的特性,增加了探针的多功能化(如抑制肿瘤细胞扩散等),同时一定程度上避免了大分子纳米探针直接注射的一些问题(如网状内皮系统吸收,导致肿瘤组织内分布不均,并可能对肝、脾和肺有毒性)[87]。
4 总结与展望
酶的活性与各项生命活动有着重要的关系,酶表达水平的变化与一些疾病有着一定的关联,能够将这种酶含量清晰直白地展现出来是现代医学一直面临的挑战。分子荧光探针的出现与发展为现代医学以及其他方向提供了一个较好的工具,理想的分子荧光探针具有灵敏度高、选择性好、时空分辨率高、生物相容性好等优点,这些性质保证了分子荧光探针可以精确地反映酶的活性和表达水平。
原位成像能力的探索是获得优秀时空分辨率分子荧光探针的有效策略之一,通过不同的方式(共价键或者非共价键形式)连接或者附着在活性酶及其周围,减少分子的扩散,增加保留时间,提高探针的原位概率。近红外荧光染料的应用是目前研究的热点,荧光团能激发/发射波长更长的荧光,有利于减少光损伤以及增加荧光的组织穿透深度,近红外Ⅱ区可以进行精细组织结构的清晰成像[88-96],使该领域得到了进一步发展。通过现有已被临床批准的药物,如亚甲基蓝、吲哚菁绿等通过修饰转化为高效的荧光探针,可能是提高探针进入临床实验几率的一种方案。为了解决生物组织散色光强烈的问题,双光子乃至三光子分子荧光探针的设计策略受到了关注[97]。分子荧光探针的开发与发展,各种荧光成像技术的迭代更新以及核磁共振成像、超声成像等成像技术与荧光成像技术的结合应用,进一步提升了酶的检测分辨率[98]。其他的设计思路也在不断探索中,例如光激活等双方式激活探针、利用荧光探针进行疾病的诊断治疗一体化等。希望未来能有更多的设计策略应用于分子荧光探针的开发,多领域的研究者们增加交流合作并达成共识,努力将分子荧光探针带入临床转译以及后期应用,为人类在生命领域的探究提供有力的工具。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20230128.

