苗药花蝴蝶回调CIA模型大鼠脂肪细胞变化的研究*
张庆忠,龙思芳,戚国平,魏胜兰,吴富小,朱启悦,张亚亚,李 秋,韦小龙
(黔南民族医学高等专科学校,贵州 都匀 558000)
类风湿关节炎(RA)是一种临床表现为手、足小关节的侵袭性炎症、器官受累、关节畸形、功能丧失等症状的疾病[1-3]。国内RA发病率约为0.3%,全世界为0.5%~1.0%,若控制不好约35%RA患者10年内会丧失工作能力[2-3]。目前,治愈RA的文献资料报道不多,该病的发生与其组织、关节畸变的直接代谢关联性研究资料也不丰富。花蝴蝶学名赤胫散(PolygonumruncinatumBuch.-Ham.var.SinenseHemsl.),为蓼科蓼属植物。贵州省苗族民间中草药医生常用此药治疗RA,效果较好[4-5]。本课题组前期研究发现,苗药花蝴蝶回调RA模型大鼠脂肪细胞、白细胞变化的效果较好。结合另一些研究资料,苗药花蝴蝶调节牛二型胶原蛋白诱导关节炎(CIA)模型大鼠实验研究指标有甘油三酯(TG)、脂联素(ADPN)、白细胞介素-10(IL-10)、类风湿因子(RF)、免疫球蛋白(Ig)等[6-8]。本实验旨在探讨苗药花蝴蝶回调CIA模型大鼠炎症、关节畸形等的直接代谢相关因子及其作用机制。现将本实验结果报道如下。
1 材料与方法
1.1材料
1.1.1苗药花蝴蝶 提取药液制备:采自贵州省都匀市螺蛳壳等地新鲜苗药花蝴蝶全株约1 500g,清理洗净后实验室水提3次,最后取浓缩液静置备用。
1.1.2实验动物及试剂 SPF级雄性SD大鼠40只,体重(180±20)g,由陆军军医大学动物实验中心提供[SCXK-(军)2022-0012]。完全弗氏佐剂(CFA)购自美国SIGMA公司;ADPN、IL-10、牛Ⅱ型胶原蛋白(CⅡ)购自北京索莱宝科技有限公司;氨甲蝶呤片为贵州鼎晟泰生物科技有限公司提供(批准文号:国药准字H31020644)等。
1.2方法
1.2.1CIA建模 将40只大鼠随机分为正常组8只及建模组32只,按照动物福利保护法进行实验(本校伦理委员会动物实验伦理审查表编号:2023013)。将CⅡ溶于0.1 g/mL醋酸溶液,制成浓度为1 mg/mLCⅡ溶液,摇床4 ℃过夜。次日将CⅡ溶液与CFA按体积比(1∶2)混合,并于冰上乳化成乳剂(即CIA建模液)。每只建模组大鼠左右后足跖部皮内注射0.25 mg CIA建模液。
1.2.2建模后分组 CIA建模后大鼠单足关节炎指数评分大于或等于3.5,出现前足或后足关节红肿、踝关节明显肿胀,视为造模成功[9]。建模成功CIA模型大鼠随机分为CIA模型组(模型组)8只、氨甲蝶呤治疗组(氨甲蝶呤组)8只、花蝴蝶高剂量治疗组(花蝴蝶高组)8只、花蝴蝶低剂量治疗组(花蝴蝶低组)8只。
1.2.3给药 分组第2天,各组大鼠经灌胃给药。正常组大鼠给予生理盐水,氨甲蝶呤组大鼠给予1.04 mg/kg氨甲蝶呤,每周2次;结合民间用药经验[4-5],花蝴蝶高、低组药液量分别为每天7.6、3.8 mg/kg。灌胃约35 d即停止给药(可根据实验情况调整)。
1.2.4观察指标
1.2.4.1足肿胀情况观察 建模前1 d,建模后第4、8、12、16、20、24、28、32天,观察、评估各组大鼠左右后足跖关节肿胀情况,并照相记录。根据各组大鼠足关节肿胀评分标准[1,9]进行比较。
1.2.4.2血液相关指标检测 末次给药后第2天,腹腔注射10%水合氯醛麻醉[1](0.1 mg/100 g鼠体重),大鼠仰位固定行腹主动脉取全血3 mL即送贵州医科大学第三附属医院检验科进行TG、RF、IgA、IgG、IgM等指标检测。
1.2.4.3IL-10、ADPN检测 按“1.2.4.2”法麻醉大鼠,大鼠仰位固定行腹主动脉取全血3 mL,静置1 h并以2 000 r/min离心15 min,取血清,严格按酶联免疫吸附测定法(ELISA法)试剂盒说明检测IL-10、ADPN。
1.2.4.4足关节病理切片 按“1.2.4.2”法麻醉大鼠,取足关节,并用4%多聚甲醇固定,后送黔南州人民医院病理科行鼠足关节病理切片(HE染色)制作并扫描成数字图片资料。进行足趾关节病理切片评分[9]。

2 结 果
2.1各组大鼠足肿胀情况 CIA模型组大鼠关节肿胀指数评分明显高于正常组、氨甲蝶呤组及花蝴蝶高、低组,差异均有统计学意义(P<0.05);氨甲蝶呤组、花蝴蝶高组大鼠关节肿胀指数评分与正常组比较,差异均无统计学意义(P>0.05),见图1、表1。
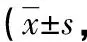
表1 各组大鼠关节肿胀指数评分比较分,n=8)
注:A为正常组;B为CIA模型组;C为氨甲蝶呤组;D为花蝴蝶高组;E为花蝴蝶低组。
2.2各组大鼠RF、IgA、IgG、IgM水平比较 CIA模型组大鼠RF水平明显高于正常组、氨甲蝶呤组及花蝴蝶高、低组,差异均有统计学意义(P<0.05)。CIA模型大鼠IgA水平明显低于正常组和氨甲蝶呤组,但明显高于花蝴蝶高组,差异均有统计学意义(P<0.05),氨甲蝶呤组IgA水平明显低于正常组,明显高于花蝴蝶高、低组,差异均有统计学意义(P<0.05)。花蝴蝶高组大鼠IgA水平明显低于正常组,略高于花蝴蝶低组,但差异均无统计学意义(P>0.05)。CIA模型大鼠IgG水平明显高于正常组和氨甲蝶呤组,略低于花蝴蝶低组,差异均有统计学意义(P<0.05),略高于花蝴蝶高组,但差异无统计学意义(P>0.05)。氨甲蝶呤组大鼠IgG水平明显低于花蝴蝶高、低组,差异均有统计学意义(P<0.05),略高于正常组,但差异无统计学意义(P>0.05)。花蝴蝶高组大鼠IgG水平明显高于正常组,差异有统计学意义(P<0.05),略低于花蝴蝶低组,但差异无统计学意义(P>0.05)。CIA模型组、氨甲蝶呤组、花蝴蝶高组大鼠IgM水平均明显高于正常组,差异均有统计学意义(P<0.05),CIA模型组大鼠IgM水平略高于氨甲蝶呤组及花蝴蝶高、低组,花蝴蝶高组大鼠IgM水平略低于花蝴蝶低组,但差异均无统计学意义(P>0.05)。见表2。

表2 各组大鼠RF、IgA、IgG、IgM水平比较
2.3各组大鼠TG、ADPN、IL-10水平比较 CIA模型组大鼠TG水平明显低于正常组、氨甲蝶呤组和花蝴蝶高组,差异均有统计学意义(P<0.05),略低于花蝴蝶低组,但差异无统计学意义(P>0.05)。氨甲蝶呤组大鼠TG水平略低于正常组,花蝴蝶高、低组,花蝴蝶高组大鼠TG水平略低于正常组,略高于花蝴蝶低组,但差异均无统计学意义(P>0.05)。CIA模型组大鼠ADPN水平明显低于正常组、氨甲蝶呤组、花蝴蝶高组,氨甲蝶呤组大鼠ADPN水平明显低于花蝴蝶低组,花蝴蝶高组大鼠ADPN水平明显高于氨甲蝶呤组和花蝴蝶低组,差异均有统计学意义(P<0.05)。CIA模型组大鼠IL-10水平明显低于正常组、花蝴蝶高组,差异均有统计学意义(P<0.05),略低于氨甲蝶呤组、花蝴蝶低组,但差异无统计学意义(P>0.05)。见图2。
2.4各组大鼠足趾关节病理切片评分比较 CIA模型组大鼠脂肪细胞评分低于其他组,白细胞评分高于其他组;与其他组比较,CIA模型组大鼠足关节骨髓腔内现低度脂肪细胞,而白细胞弥漫性增生,差异均有统计学意义(P<0.05),见表3、图3。
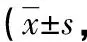
表3 各组大鼠足趾关节病理切片评分比较分,n=8)
注:A为正常组;B为CIA模型组;C为氨甲蝶呤组;D为花蝴蝶高组;E为花蝴蝶低组。
3 讨 论
虽然RA病因及发病机制尚不清楚,但有研究认为脂肪细胞变化及其分泌功能性因子和免疫调节因子紊乱是RA发生机制之一[6-8]。本实验足关节病理切片结果提示,CIA模型组大鼠足关节骨髓腔内现明显低度脂肪细胞,脂肪细胞可能是RA炎症、关节畸形等直接代谢关联的重要指标细胞之一。
RF是临床医学诊断RA时常用经典检测指标[10-12]。本实验中,CIA模型组大鼠RF、IgM水平明显高于其他组,IgG水平低于花蝴蝶低组而高于其他组,可能是CIA模型组大鼠没有给药花蝴蝶,其体内CⅡ、CFA持续刺激,CIA模型组大鼠反复多次产生了抗体IgG、IgM和抗抗体IgG、IgM等,导致了RF-IgG和RF-IgM水平显著增加,最终升高了RF、IgG、IgM水平。
CIA模型组大鼠TG、ADPN水平明显低于其他组,提示可能CIA模型组大鼠脂肪细胞显著减少,导致该细胞分泌功能性物质(如TG等,TG是重要能源物质之一)和免疫活性因子(如ADPN等)明显不足,促进了CIA模型组大鼠发生RA和病变。这虽与相关研究结果(脂肪细胞组织是具有内分泌和免疫功能的活性组织)相似[6-7],但仍需进一步实验证实。
此外,CIA模型组大鼠IL-10水平也较其他组显著降低。IL-10是公认的炎症与免疫抑制因子,作为一种多细胞源、多功能的细胞因子,其相对或绝对缺乏,会持续引起免疫激活,导致RA[8,13]。另有研究报道,因IL-10抑制了Th1细胞的免疫调节作用、单核细胞化学趋化作用等[14-15],使RF-IgG和RF-IgM水平显著增高,即升高了RF水平。
苗药花蝴蝶可能通过回调CIA模型大鼠脂肪细胞减少,恢复了其功能性物质(如TG等)正常分泌,因此缓解了CIA模型大鼠能量代谢,由于模型大鼠能量供应正常,助力回转了大鼠炎症的发展、关节组织畸变凋亡等;此外,苗药花蝴蝶可能通过回调CIA模型鼠能量代谢水平,使其正常分泌免疫因子,如脂肪因子ADPN、IL-10等,而这些直接参与免疫调节的活性因子又缓解了CIA模型大鼠炎症、关节畸形等症状。目前,这些免疫因子与CIA模型鼠关节畸形等变化的直接物质代谢机制,仍是本课题组进一步研究的方向之一。
综上所述,苗药花蝴蝶可能通过回调CIA模型鼠脂肪细胞的减少,保证了正常的能量代谢(如TG)和免疫调节因子分泌(如ADPN、IL-10等),增强了免疫调节作用(如回调了RF、IgG、IgM等),缓解了CIA模型大鼠足关节炎症、畸形等。

