半枝莲总黄酮提取工艺优化及抗氧化、抗肿瘤活性评价
郑 沛,文 敏,刘秋叶,王 潇,左亚杰,
(1.湖南中医药大学第一附属医院,湖南长沙 410007;2.湖南中医药大学,湖南长沙 410208)
半枝莲为唇形科黄芩属植物半枝莲(Scutellaria barbataD.Don)的干燥全草,又名通经草、野夏枯草、并头草等[1]。在世界范围内分布广泛,喜湿,常生于田边或湿润草地上[2]。虽尚未正式纳入药食同源及保健食品可用名录,但被广泛开发用于药品、保健品、动物喂养饲料等行业。半枝莲作为公认的抗癌中药[3],味辛、苦,具有清热解毒、祛瘀止血、利水消肿的作用[4]。目前,从半枝莲中已分离出萜类[5]、黄酮类[6]、生物碱类、多糖和挥发油等多种活性成分[7],此外,还富含人体必需的氨基酸、维生素及微量元素[8]。因其显著的药理价值和营养价值可广泛地用于医药、食品、日用化工等多领域的开发。
半枝莲中的黄酮类化合物为主要的活性物质,具有强化免疫系统[9]、抗自由基氧化、调节内分泌功能[10]、影响血管的脆性与渗透性[11]、改善血液循环等[12]诸多生理功能。同时,现已证实黄酮类成分是人体必需的营养成分,可对人体起重要的保健作用[13]。但人体自身不能合成,只能通过外界摄取[14],故此对黄酮类成分用于食品及保健品的研究与开发也将具有更高的经济效益与社会效益。
目前对于黄酮的提取方法主要有热水提取法[15]、超声波提取法[16]、微波提取法[17]、半仿生-酶法提取[18]等。有研究表明这些方法或多或少存在操作较为复杂,提取杂质多,不适用工业化生产等缺陷,相比较而言溶剂提取法试剂用量少、提取时间短、提取较为完全、杂质少[19]。同时,采用乙醇作为溶剂,可降低生产成本及减少对环境造成的污染。黄酮的测定方法主要有紫外分光光度法、高效液相色谱法、液质联用技术等[20-21]。其中紫外分光光度法可快速测定黄酮成分,操作简便。目前,对于半枝莲总黄酮的研究主要集中在黄酮的提取与抗氧化层面,对提取纯化后的总黄酮在抗氧化、抗肿瘤的研究成果较少,结合现代科学技术对半枝莲总黄酮提取方式及药理作用的相关研究是药材资源合理利用及相关疾病药物的开发应用的重要前提。因此,本文选用半枝莲为研究对象,采用溶剂提取法探讨半枝莲总黄酮的提取工艺,考察了提取时间、料液比、提取温度、乙醇体积分数对半枝莲总黄酮得率的影响;采用响应面Box-Behnken 设计优化半枝莲总黄酮提取工艺,并初步评价半枝莲总黄酮提取物的抗氧化及抗肿瘤活性。以期提高半枝莲黄酮类化合物的提取效率及对半枝莲资源的深入开发具有一定的借鉴意义。
1 材料与方法
1.1 材料与仪器
半枝莲 购自湖南中医药大学第一附属医院,经该院张裕民主任药师鉴定为唇形科植物半枝莲Scutellaria barbataD.Don 的干燥全草;芦丁对照品(纯度≥98%)、维生素C 对照品(纯度≥99%)上海源叶生物科技有限公司;AB-8 大孔吸附树脂 上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)阿拉丁试剂(上海)有限公司;DMEM 培养基、胎牛血清、青链双抗、PBS、0.25%胰酶消化液、人肝癌HepG2 细胞(CL-0103)武汉普诺赛生命科技有限公司;噻唑蓝溴化四唑MTT北京索莱宝科技有限公司;二甲基亚砜DMSO 美国Sigma 公司;其他有机试剂均为分析纯 国药集团化学试剂有限公司;人高转移性肝癌MHCC-97H细胞(IM-H045)、人肝癌HuH-7 细胞(CL-0120)、人非小细胞肺癌NCI-H1299 细胞(CRL-5803)均由湖南中医药大学药学院教研室馈赠。
DK-98-ⅡA 恒温水浴锅 天津市泰斯特仪器有限公司;DHG-9123A 电热鼓风干燥箱、BPN-150CRHCO2培养箱 上海一恒科学仪器有限公司;AX223ZH电子分析天平 奥豪斯公司;UV-9000S 紫外可见分光光度计 上海元析仪器有限公司;Enspire 多功能酶标仪 Perkinelmer 公司。
1.2 实验方法
1.2.1 半枝莲总黄酮含量测定及得率计算
1.2.1.1 芦丁标准曲线的制备 精密称定芦丁对照品20 mg,80%乙醇溶解,制成浓度为0.2 mg/mL 的标准储备液,备用。
1.2.1.2 检测波长的选择 参考文献[22-23]的方法,并稍作修改,吸取芦丁储备液1.0 mL 于10 mL的容量瓶中,加入5%亚硝酸钠溶液0.4 mL 摇匀,静置6 min;后加10%硝酸铝溶液0.4 mL 摇匀,静置6 min;再加4%氢氧化钠溶液4 mL,80%乙醇定容,摇匀,静置15 min。以80%乙醇作为参比溶液,在100~900 nm 进行波长扫描,发现在506 nm 处有最大吸收波长,故选择其作为检测波长。
1.2.1.3 标准曲线的绘制 精密吸取上述储备液0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL 于10 mL 容量瓶中(不足4.0 mL 的加80%乙醇至4.0 mL),采用1.2.1.2 方法下的操作测定吸光度,绘制以芦丁质量浓度为横坐标(X),吸光度为纵坐标(A)的标准曲线,得方程为A=15.738x-0.0628,R2=0.9994,在0.01~0.08 mg/mL 下线性范围良好。
1.2.1.4 样品测定 将半枝莲药材粉碎,过4 号筛后避光保存,备用。准确称取半枝莲粉末5.0 g,置250 mL 具塞锥形瓶中,加入75%的乙醇150 mL,在温度为75 ℃下回流提取90 min,提取2 次,放冷后用五层纱布过滤,合并两次滤液,60 ℃减压浓缩后转移至25 mL 容量瓶中定容,得样品溶液。精密吸取样品溶液1 mL 于10 mL 容量瓶中定容,得样品待测溶液。精密吸取样品待测溶液1 mL 于10 mL 容量瓶中,按照1.2.1.2 方法下显色方法于506 nm 处测定吸光度(A),代入回归方程中计算总黄酮的质量浓度(C),计算半枝莲总黄酮得率(Y)的公式如下[24]:
式中:Y 为半枝莲总黄酮得率,mg/g;C 为提取液中总黄酮质量浓度,mg/mL;D 为稀释倍数;V 为样品溶液总体积,mL;M 为半枝莲的质量,g。
1.2.2 单因素实验 精密称取半枝莲粉末,每份5.0 g,在设定的实验条件下回流提取2 次,过滤,合并滤液,减压浓缩至25 mL 容量瓶中,得半枝莲总黄酮提取液。每组实验平行3 次,按照1.2.1.2 方法下测定吸光度,并根据公式计算半枝莲总黄酮得率。
1.2.2.1 不同提取时间对半枝莲总黄酮得率的影响设定料液比1:30 g/mL,提取温度75 ℃,乙醇体积分数75%,考察提取时间(60、90、120、150、180 min)对总黄酮得率的影响。
1.2.2.2 不同料液比对半枝莲总黄酮得率的影响设定提取时间90 min,提取温度75 ℃,乙醇体积分数75%,考察料液比(1:20、1:30、1:40、1:50、1:60 g/mL)对总黄酮得率的影响。
1.2.2.3 不同提取温度对半枝莲总黄酮得率的影响设定提取时间90 min,料液比(1:40 g/mL),乙醇体积分数75%,考察提取温度(55、65、75、85、95 ℃)对总黄酮得率的影响。
1.2.2.4 不同乙醇体积分数对半枝莲总黄酮得率的影响 设定提取时间90 min,料液比(1:40 g/mL),提取温度65 ℃,考察乙醇体积分数(55%、65%、75%、85%、95%)对总黄酮得率的影响。
1.2.3 响应面试验 在单因素实验基础上,以各显著影响因素为自变量。利用Design-Expert 8.0.6 软件和Box-Behnken 设计进行4 因素3 水平的响应面试验,实验选取提取时间(A)、料液比(B)、提取温度(C)、乙醇体积分数(D)为自变量,半枝莲总黄酮得率(Y)为响应值,优化半枝莲总黄酮的提取工艺,因素及水平设计见表1。

表1 响应面试验设计因素与水平Table 1 Design factors and levels of response surface experiment
1.2.4 半枝莲总黄酮的纯化 按照最优工艺制得半枝莲总黄酮提取溶液,减压浓缩至含生药浓度为0.2 g/mL 的浓缩液,备用。参考前期预实验结果及半枝莲总黄酮纯化工艺的文献[25-26]报道,采用AB-8 大孔吸附树脂纯化,湿法装柱(层析柱内径2.5 cm,高25 cm),树脂径高比1:6。上样浓度为浓缩液所稀释后的样品溶液,浓度为10 mg/mL,样品体积为3 BV,上样流速为2 mL/min,水洗量为3 BV 以去除杂质,后用40%乙醇4 BV 洗脱,洗脱体积流量为2 mL/min。减压浓缩后进行冷冻干燥,处理得半枝莲总黄酮纯化物。分别取适量半枝莲粗黄酮和经过纯化后的总黄酮冻干粉于25 mL 容量瓶中,加75%的乙醇定容制成浓度为20 mg/mL 的样品溶液,按照1.2.1.4 方法下方法测得半枝莲总黄酮纯化后的得率。
1.2.5 体外抗氧化活性分析
1.2.5.1 DPPH 自由基清除能力的测定 参考文献[27-28]方法并稍作修改,精密称取半枝莲总黄酮纯化物和维生素C 适量,分别加乙醇制成浓度为2.5 mg/mL 的储备液备用。精密吸取各储备液后加乙醇稀释得质量浓度为5、10、25、50、100、200、400、600 μg/mL 的样品溶液。每个质量浓度设6 个复孔,阳性组采用维生素C 代替样品溶液。吸取100 μL 样品溶液于96 孔板中,等量加入DPPH 溶液,混匀,避光反应30 min,517 nm 波长下检测吸光度。根据吸光度计算样品对DPPH 自由基的清除能力,实验重复三次,并利用Graphpad prism 9.5.0 软件计算半枝莲总黄酮纯化物和维生素C 对DPPH 自由基清除率的IC50值。计算DPPH 自由基清除率公式如下:
式中:A0为乙醇+DPPH 溶液的吸光度;A1为样品溶液+DPPH 溶液的吸光度;A2为样品溶液+乙醇的吸光度。
1.2.5.2 ABTS+自由基清除能力的测定 参考文献[29-30]并适当优化,将制备的ABTS 储备液用50%乙醇溶液稀释。调节其吸光值在734 nm 波长下为0.7±0.05,即得ABTS 工作液。将半枝莲总黄酮纯化物用50%乙醇稀释成质量浓度为5、10、25、50、100、200、400、600 μg/mL 的样品溶液,维生素C 作为阳性对照组,每个质量浓度设置6 个复孔。分别吸取10 μL 供试品样液与200 μL ABTS 工作液加入到96 孔板中,避光孵育8 min,在734 nm 下测定吸光值。根据吸光度计算样品对ABTS+自由基清除能力,实验重复三次,并利用Graphpad prism 9.5.0 软件计算半枝莲总黄酮纯化物和维生素C 对ABTS+自由基清除率的IC50值。计算ABTS+自由基清除率公式如下:
式中:A0为50%乙醇+ABTS 工作液的吸光度;A1为样品溶液+ABTS 工作液的吸光度;A2为样品溶液+50%乙醇的吸光度。
1.2.6 体外抗肿瘤活性的测定
1.2.6.1 细胞培养 将人非小细胞肺癌NCI-H1299细胞培养于含10%胎牛血清的RPMI-1640 培养基中,人肝癌HepG2 细胞、人高转移性肝癌MHCC-97H 细胞、人肝癌HuH-7 细胞分别培养在含10%胎牛血清的DMEM 高糖培养基中,均于37 ℃、5%CO2培养箱中常规培养。
1.2.6.2 抗肿瘤活性测定 参考文献[31-32]方法,取处于对数生长期的NCI-H1299 细胞、HepG2 细胞、MHCC-97H 细胞、HuH-7 细胞,分别经0.25%胰蛋白酶消化、离心、制成悬液后调整细胞密度NCI-H1299 细胞为8×104个/mL,其余细胞密度为1×105个/mL,接种于96 孔细胞培养板中,每孔100 μL,于37 ℃、5% CO2条件下培养24 h 至细胞完全贴壁,弃去原培养液。实验设置空白组、对照组和样品组。空白组中无细胞只含相应完全培养基,对照组中含细胞与相应培养基,样品组中依此加入总黄酮纯化物浓度为50、100、200、300、400、500、600 μg/mL 的完全培养液。每组设置5 个复孔,分别培养24 h。
培养结束后,每孔加入浓度为5 mg/mL 的MTT溶液(10 μL 每孔),在培养箱中孵育4 h 后吸去上清,每孔加入DMSO 溶液(150 μL 每孔),避光处理,摇床上低速振荡10 min,酶标仪490 nm 波长下测定吸光度,根据下式计算细胞存活率。
1.3 数据处理
试验均设计三次平行实验,运用Excel 2019、Orign 2021、Design-Expert 13、Graphpad Prism 9.5.0等软件对数据进行处理及统计分析,其中MTT 实验数据采用单因素方差分析,以P<0.05 视作差异有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 提取时间对半枝莲总黄酮得率的影响 提取时间对半枝莲总黄酮得率的影响如图1 所示,提取时间在60~90 min 时,半枝莲总黄酮得率随着时间的延长逐渐增加,在提取时间为90 min 时,总黄酮得率达到最大值,得率由22.03±0.10 mg/g 升高到23.35±0.16 mg/g。提取时间超过90 min 后,总黄酮得率随着时间的増加反而出现下降趋势,这可能是因为回流时间越长,乙醇的挥发性越大从而导致乙醇浓度降低,促使黄酮的提取能力减弱,也可能是此时黄酮类化合物已经基本溶出[33],延长回流时间黄酮类成分也变化不大,甚至可能造成部分热敏性的黄酮成分发生降解[34],还会影响其他物质的溶出。因此,选择提取时间60~120 min 进行响应面优化试验。
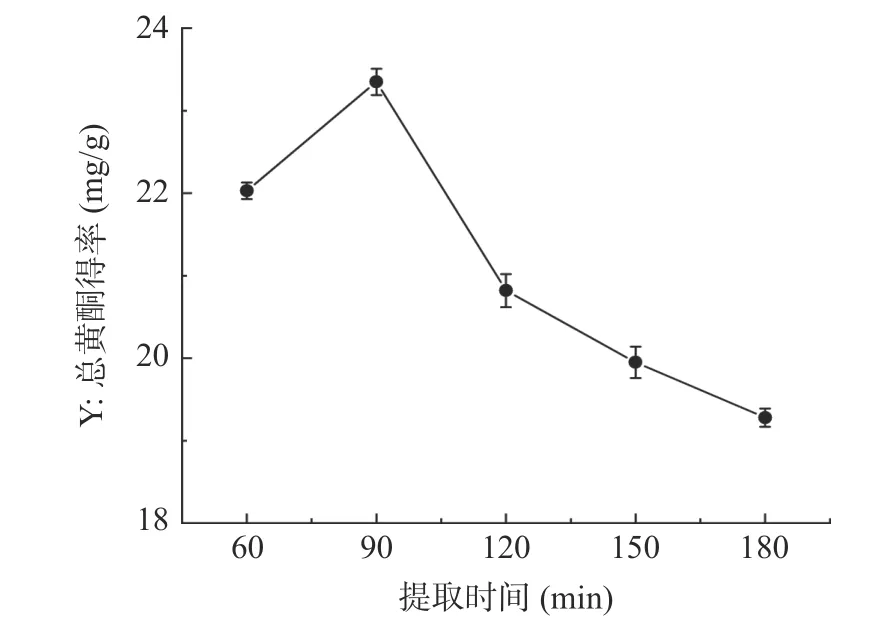
图1 提取时间对半枝莲总黄酮得率的影响Fig.1 Effect of extraction time on the yield of total flavonoids from Scutellaria barbata
2.1.2 料液比对半枝莲总黄酮得率的影响 料液比对半枝莲总黄酮得率的影响如图2 所示,随着料液比的增加,半枝莲总黄酮得率呈现先升高后下降的趋势,总黄酮得率在料液比为1:40(g/mL)时达到最大值,得率为23.31±0.07 mg/g。当溶剂体积倍数超过40 倍时,总黄酮得率明显降低,至21.60±0.08 mg/g。其原因可能是在一定范围内,随着料液比的增加会促进黄酮类物质的溶出,超过此范围可能会导致其他成分的溶出以及使某些黄酮类成分的结构被破坏,从而导致黄酮得率降低[35]。因此,选择料液比1:30~1:50 g/mL 进行响应面优化试验。
2.1.3 提取温度对半枝莲总黄酮得率的影响 提取温度对半枝莲总黄酮得率的影响如图3 所示,当温度在55~65 ℃的时候总黄酮得率随着温度升高而升高,并在提取温度为65 ℃时达到最大值,为27.82±0.14 mg/g,当温度高于65 ℃时,半枝莲总黄酮得率明显下降,这可能是因为随着温度的适当增加,分子运动速度及溶解渗透能力增强,故提取效果好[36]。但温度太高,导致热敏性的黄酮类成分结构遭受破坏,部分黄酮成分氧化,从而黄酮得率降低。因此选择提取温度为55~75 ℃进行响应面优化试验。

图3 提取温度对半枝莲总黄酮得率的影响Fig.3 Effect of extraction temperature on the total flavonoid yield from Scutellaria barbata
2.1.4 乙醇体积分数对半枝莲总黄酮得率的影响乙醇体积分数对半枝莲总黄酮得率的影响如图4 所示,当乙醇体积分数为55%~75%时,半枝莲总黄酮得率明显增加,且在乙醇体积分数为75%时达到最大值,为26.04±0.19 mg/g,当乙醇体积分数大于75%时,黄酮得率减小,这可能是因为当乙醇浓度超过一定范围时,会使醇溶性的色素及极性更小的脂溶性成分溶出变多,这些溶剂会与黄酮类化合物竞争溶剂,从而导致黄酮类成分的溶出能力降低[37]。因此选择乙醇体积分数为65%~85%进行响应面优化试验。
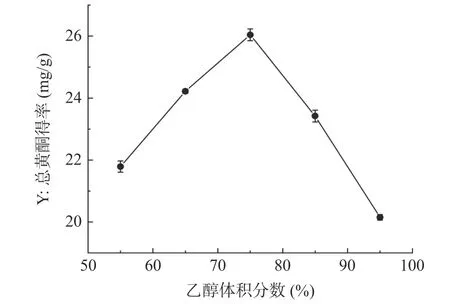
图4 乙醇体积分数对半枝莲总黄酮得率的影响Fig.4 Effect of volume fraction of ethanol on the yield of total flavonoids of Scutellaria barbata
2.2 响应面试验结果
2.2.1 响应试验设计结果 利用软件Design-Expert 8.0.6 进行试验设计并对试验数据进行回归拟合,得半枝莲总黄酮得率(Y)对提取时间(A)、料液比(B)、提取温度(C)、乙醇体积分数(D)的二元回归模拟方程:Y=2.57+0.0664A+0.0685B+0.1291C-0.0866D-0.0722AB+0.0034AC+0.0468AD+0.0592BC+0.0209BD+0.1049CD-0.2524A2-0.2928B2-0.1830C2-0.3434D2。响应试验结果见表2。

表2 响应面试验结果及分析Table 2 Results and analysis of response surface experiment
2.2.2 响应面回归模型方差分析 响应回归模型方差见表3,由表3 可知:该模型的F=15.25,P<0.0001,表明所得模型极显著,失拟项为P值为0.5390>0.05,不显著,表明实验结果主要受所选因素影响受其他因素影响很小,方程式成立,方法可靠。模型的复合相关系数R2=0.9385,说明该模型拟合程度良好,可以用该模型优化半枝莲中总黄酮的提取工艺。根据F值可知所考察的因素对响应值影响力的大小顺序为提取温度(C)>乙醇体积分数(D)>料液比(B)>提取时间(A),其中一次项中提取温度与乙醇体积分数交互作用对结果影响显著,其他交互作用影响不显著,二次项中四个因素对结果均有极显著影响。

表3 回归方程方差分析Table 3 Analysis of variance of regression equations
2.2.3 响应面试验交互作用分析 根据回归方程,绘制出提取温度(C)和乙醇体积分数(D)交互项的响应面和等高线图,如图5 所示。响应面越陡峭且倾斜程度越大则说明该图中两因素间的交互作用越显著;等高线呈现椭圆形且线之间越密集则说明交互作用越明显[38]。从图5 中可看出提取温度与乙醇体积分数的响应面图呈陡峭状且等高线图呈椭圆形,说明提取温度与乙醇体积分数之间的交互作用显著,直观分析结果与方差分析结果一致。
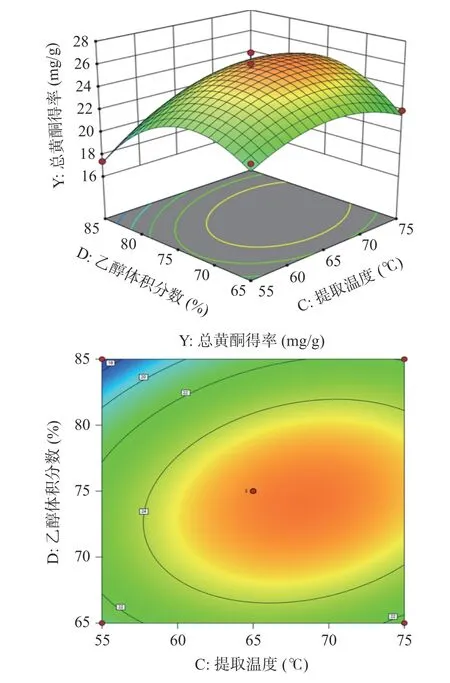
图5 提取温度和乙醇体积分数交互作用对半枝莲总黄酮得率影响的响应面和等高线图Fig.5 Response surface and contour plots of the interaction between extraction temperature and ethanol volume fraction on the yield of total flavonoids from Scutellaria barbata
2.2.4 最佳提取工艺的确定与验证 响应面模型优化的最优提取工艺为提取时间93.2443 min,料液比1:41.3804(g/mL),提取温度68.5852 ℃,乙醇体积分数74.4041%,预测此条件下总黄酮得率为26.05 mg/g。为便于工业生产及实际操作的可行性,确定最终工艺为提取时间93 min,料液比1:41(g/mL),提取温度68 ℃,乙醇体积分数75%。采用该提取方法进行3 次平行实验,总黄酮得率的均值为26.46 mg/g,与预测值的相对误差为1.56%,表明经优化的提取工艺可行且稳定,可用于半枝莲总黄酮的提取。
半枝莲总黄酮经大孔树脂纯化后的得率为60.13 mg/g,纯度为49.32%,比粗提取(17.35%)纯度增大2.84 倍左右。
2.3 半枝莲总黄酮抗氧化活性测定
2.3.1 半枝莲总黄酮纯化物对DPPH 自由基的清除作用 半枝莲总黄酮纯化物对DPPH 自由基的清除作用如图6 所示,当半枝莲总黄酮纯化物质量浓度在5~600 μg/mL 的范围内,对DPPH 自由基的清除能力随着质量浓度的增加而增大,呈现量效关系。当质量浓度在400 μg/mL 时对DPPH 自由基的清除能力开始接近阳性药物维生素C,当质量浓度为600 μg/mL时,自由基清除率达到96.75%,几乎与阳性药维生素C 的自由基清除率(98.86%)相当。此外根据文献[39-40]调查发现,近年来对半枝莲黄酮的抗氧化能力大多是评价粗提物的自由基清除能力,对纯化后的总黄酮未见研究。因此在此次实验中发现在相同浓度时,经纯化后的半枝莲总黄酮比粗提物的自由基清除能力更强。则进一步说明该提取方式可行且纯化后的总黄酮比粗提取的自由基清除能力更强,因此,对半枝莲粗提取进行纯化试验可减少药物资源的浪费,同时增强该成分的抗氧化活性。利用Graphpad prism 软件计算半枝莲总黄酮纯化物和维生素C 对DPPH 自由基清除率的IC50分别为25.41、5.07 μg/mL。可见,与维生素C 相比,半枝莲总黄酮纯化物对DPPH自由基清除率略弱。

图6 半枝莲总黄酮纯化物对DPPH 自由基清除能力Fig.6 Scavenging rate of DPPH radicals by total flavonoids purified from Scutellaria barbata
2.3.2 半枝莲总黄酮纯化物对ABTS+自由基的清除作用 半枝莲总黄酮纯化物对ABTS+自由基的清除作用如图7 所示,ABTS+自由基的清除能力随半枝莲总黄酮纯化物的浓度升高而加强,且呈现量效关系。当质量浓度为600 μg/mL 时,清除率达到91.75%,此时ABTS+自由基的清除能力接近于维生素C 的自由基清除率(94.96%)。同时根据Graphpad prism 软件分析,得出半枝莲总黄酮纯化物IC50=70.41 μg/mL和维生素C 的IC50=8.56 μg/mL,这说明,在相同浓度下,半枝莲总黄酮纯化物对ABTS+的自由基清除率比维生素C 相对较弱。

图7 半枝莲总黄酮纯化物对ABTS+自由基的清除率Fig.7 Scavenging rate of ABTS+ radicals by total flavonoids purified from Scutellaria barbata
2.4 半枝莲总黄酮纯化物抗肿瘤活性测定结果
半枝莲总黄酮纯化物对肺癌NCI-H1299 细胞、肝癌HepG2 细胞、MHCC-97H 细胞、HuH-7 细胞活性试验结果如图8 所示,由图可知,对于人肝癌HuH-7细胞,除质量浓度为50 μg/mL 组外,其余各药物浓度组对肝癌细胞的存活率与对照组相比较均有显著抑制作用(P<0.0001)。此外,半枝莲总黄酮纯化物对以下4 种肿瘤细胞均能产生不同程度的抑制作用,当半枝莲总黄酮的质量浓度增加时,细胞存活率出现显著降低趋势,且呈现剂量-效应关系,其中以NCIH1299 细胞更明显,IC50分别为168.6、330.5、269.2、335.8 μg/mL。

图8 半枝莲总黄酮纯化物作用于肿瘤细胞的活性测定结果(n=3)Fig.8 Results of the activity assay of total flavonoids purified from Scutellaria barbata acting on tumor cells (n=3)
3 结论
本研究采用溶剂提取法,经单因素实验结合响应曲面试验,最终确定半枝莲总黄酮最优提取条件为提取时间93 min,料液比1:41(g/mL),提取温度68 ℃,乙醇体积分数75%,总黄酮得率为26.46 mg/g。所获得的半枝莲总黄酮提取工艺稳定、可靠,能够为半枝莲总黄酮的新药研发、产品开发等提供理论依据。
本实验利用AB-8 型大孔吸附树脂对最佳提取工艺提取后的总黄酮进行富集纯化,并对纯化后得到的总黄酮进行体外抗氧化及抗肿瘤活性评价。其中抗氧化实验结果表明纯化后的半枝莲总黄酮与同样采用溶剂提取法的半枝莲总黄酮粗提物相比在同一浓度上有更强的抗氧化能力,且纯化后的总黄酮抗氧化能力与该质量浓度呈现明显的量效关系,清除DPPH 自由基的能力较清除ABTS+自由基强,但其机理尚不明确,仍需进一步探究。相较维生素C 对照组,在较高浓度时表现出与阳性组相当的抗氧化活性,能够为半枝莲总黄酮在食品、药品等产品研发、新型抗氧剂研发等领域提供新的研究方向。抗肿瘤实验中,采用MTT 法检测细胞活性,结果表明纯化后的总黄酮提取物对4 种肿瘤细胞均有一定抑制作用,其中对NCI-H1299 细胞的抑制作用更明显,其增殖抑制能力依次为肺癌NCI-H1299 细胞>MHCC-97H 细胞>HepG2 细胞>HuH-7 细胞,这提示半枝莲总黄酮在治疗肺癌和肝癌方面有较好的应用前景,可为开发以半枝莲尤其是半枝莲总黄酮为原料的,具有广泛临床应用价值和商业开发价值的抗肿瘤新药提供理论和实验依据。

