气流超微粉碎对香菇柄粉末理化及溶出特性的影响
王维涛,牛 犇,刘瑞玲,陈杭君,房祥军,吴伟杰,郜海燕,,穆宏磊,
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.浙江省农业科学院食品科学研究所,农业农村部果品采后处理重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江杭州 310021)
香菇(Lentinus edodes)又名香信、冬菰,是世界上仅次于双孢蘑菇的第二大食用菌[1],本身含有独特的风味,味道鲜美,深受消费者的喜爱。香菇柄是香菇的副产物,由于香菇柄中纤维含量较高,口感差,生产上常将其作为废弃物丢掉,造成了资源浪费和环境污染。香菇柄中的功能物质较多,其中主要以水溶性的多糖和脂溶性的麦角固醇为代表。香菇多糖是从香菇中获得的具有生物活性的分子,主要由β-1,3 葡聚糖构成,香菇多糖的功能活性与其单糖组成、糖苷键类型、分子量大小密切相关。已有研究表明香菇多糖具有增强免疫、防癌抑癌、抗氧化、免疫调节等作用[2],香菇多糖在食品、医药、农业和化妆品等领域有着广阔的发展前景。麦角固醇,又称麦角甾醇,是蘑菇中丰富的生物活性化合物[3],是维生素D2的前体物质[4],能够有效促进钙的吸收,并具有抗氧化,降低胆固醇,防治心脏病等功效,麦角固醇在医用药物、动物饲料、功能食品的研发等领域有着广阔的发展前景。香菇柄中膳食纤维含量较高,但其中主要为不溶性膳食纤维,难以被人体消化利用,直接食用口感较差,普通粉碎方式制备的粉末粒度较大,利用超微粉碎的方式将其加工成超微粉,可以进一步增加其口感[5],将其制作成粉剂用于香菇酱等其他产品的加工,可以提高香菇副产物的利用。
超微粉碎是一种经常用于生产微、亚微米甚至纳米尺寸粉末的食品加工技术[6],可以减小粉末的粒径,增加功能物质的溶出。Meng 等[7]研究表明与传统的机械粉碎方法相比,超微粉碎改善了铁皮石斛的理化性质,使其具有更好的流动性和水合性,更高的生物利用度和生物活性。气流超微粉碎是一种流体能量冲击粉碎技术,是超微粉碎方法的一种,通常用于产生小于10 μm 粒径的粉末,具有无金属污染、不产热、无菌等优点[8]。高虹等[9]研究表明香菇柄经超微粉碎处理后,平均粒径降至8.05 μm,多糖溶出率提高了1 倍,可溶性膳食纤维含量提高了3 倍,显著改善了膳食纤维素的功能特性。Zhang 等[10]研究表明气流超微粉碎可以显著降低香菇粉末的粒径,提高多糖和蛋白质的溶解度。刘素稳等[11]使用气流超微粉碎处理杏鲍菇粉末使其容积密度、比表面积、流动性、水溶性指数和多糖的溶出率得到了显著提高。目前超微粉碎对香菇类产品的研究主要集中在粉体性质和功能物质溶出这两方面,但对功能物质的溶出主要以水溶性的多糖和蛋白质为主,对脂溶性的麦角固醇溶出影响鲜有报道。
传统粉碎方式的粉末存在溶解性、流动性、吸附性差以及功能物质溶出量低等缺点[12],为了改善香菇柄粉末的品质,增加香菇副产物的利用率,探究气流超微粉碎对香菇柄超微粉物理特性和功能成分溶出规律的影响,选择不同处理的香菇柄粉末作为研究对象,分析了气流超微粉碎对香菇柄粉末物理特性,以及麦角固醇和多糖为代表的功能性成分溶出量的影响,以期为气流超微粉碎在香菇柄的综合利用方面提供参考。
1 材料与方法
1.1 材料与仪器
901 香菇柄 来自浙江省金华市武义县武义创新食用菌有限公司,选择八成熟未开伞的香菇,采收后当天运回实验室,得到长为5~6 cm,直径为1.5~2 cm 的香菇柄(湿基含水率81.67%);甲醇(色谱纯)、无水乙醇(分析纯)、浓硫酸(分析纯)、苯酚(分析纯)、葡萄糖(分析纯)、超纯水、麦角固醇标准品均购自上海麦克林生化科技有限公司。
Malvern Mastersizer2000 型激光粒度仪 英国马尔文仪器有限公司;MH10A 型气流粉碎机 牧虎压缩机有限公司;Readmax 1900 型光吸收全波长酶标仪 上海闪谱生物科技有限公司;TM3000 型扫描电镜 日本日立有限公司;Agilent1200 型高效液相色谱仪 安捷伦科技有限公司;CHROMA METERCR-400 型色差仪 日本柯尼卡美能达公司;AQ-180E 型食品粉末研磨机 慈航市耐欧仪器有限公司;DGG-9140A 型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;KQ-3000TDE 型高频数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 香菇柄粉末的制备 粗粉的制备:香菇柄切成长为2 cm 小块,烘箱60 ℃[13]烘干,烘干后食品研磨机粉碎,4 ℃密封保存。40 目粉的制备:将粗粉过40 目筛后,4 ℃密封保存。超微粉的制备:参考史德芳等[14]的方法略作改动。过40 目的粉末,经过振动筛,进入气流粉碎机,进料量为10 g/min,气体压力0.8 MPa,分级转速3000 r/min,粉碎5 min,将样品取出,4 ℃密封保存。
1.2.2 香菇柄粉末理化性质的测定
1.2.2.1 香菇柄粉末粒径的测定 参考Giry 等[15]的方法,采用干法对样品进行粒度测定,以空气为介质。测定香菇柄粉末的D10、D50、D90、D(3,2)、D(4,3)、跨度值及比表面积(D10、D50、D90分别代表累计分布达到10%、50%和90%时样品的粒径,D(3,2)代表粉体表面积的平均直径,D(4,3)代表粉体体积的平均直径,跨度值表示粒径分布的宽度),所有结果均使用激光粒度仪直接测得。
1.2.2.2 香菇柄粉末微观结构的观察 使用扫描电镜对不同粉碎处理的香菇柄粉末进行微观结构观察,取适量样品粉末粘在导电胶上,在真空条件下喷金,加速电压15 kV,扫描电镜观察[16]。
1.2.2.3 香菇柄粉末色泽测定 采用色差仪测定不同粉碎处理的香菇柄粉末色泽,将样品放在透明平板上,结果用L*、a*、b*表示。按照公式(1)计算香菇柄粉末的总色差ΔE[17]。
式中:L*、a*、b*分别表示香菇柄粉碎后的亮度、红绿度、黄蓝度,分别表示香菇柄粉碎前的亮度、红绿度、黄蓝度。
1.2.2.4 香菇柄粉末密度的测定 堆积密度与振实密度的测定参考王士佳等[18]的方法,略作修改。堆积密度:称取1 g 样品放入10 mL 量筒中铺平表面,记录样品体积。按照公式(2)计算堆积密度。
式中:m 表示样品的质量,g;v 表示记录的体积,mL。
振实密度:称取1 g 样品放入10 mL 量筒中,振荡量筒,直至样品体积不再变化,记录样品体积。按照公式(3)计算振实密度。
式中:m 表示样品的质量,g;v 表示记录的体积,mL。
1.2.2.5 香菇柄粉末休止角的测定 参考郝竞霄等[19]的方法略作改动,将玻璃漏斗用铁架台固定,缓慢加入香菇柄粉末。直到粉末锥体的尖端接触到漏斗的尾端,测量锥体的半径及高度。按照公式(4)计算休止角。
式中:R 表示锥体的半径,cm;H 表示粉末锥体的高度,cm。
1.2.2.6 香菇柄粉末滑角的测定 参考Zhao 等[20]的方法略作改动,将1 g 香菇柄粉末样品倒在可移动倾斜的矩形塑料平板(10 cm×30 cm)上,通过逐渐抬升塑料平面,测量倾斜塑料平板顶部与水平面之间的垂直距离。以香菇粉开始滑动时的斜面与水平面的夹角作为滑角。按照公式(5)计算滑角。
式中:H 表示塑料平板距平面的垂直距离,cm;L 表示玻璃平板的长度,cm。
1.2.2.7 香菇柄粉末持水力和膨胀力的测定 持水力和膨胀力的测定方式参考刘宁等[21]的方法,略作改动。
持水力测定:准确称取香菇柄粉末0.5 g 于10 mL离心管中,加入6 mL 蒸馏水,涡旋混匀,25 ℃下静置4 h,4000 r/min 离心15 min 后收集沉淀,测量沉淀质量。按照公式(6)计算持水力。
式中:m1表示离心管加沉淀的质量,g;m2表示离心管质量,g;m3表示样品质量,g。
膨胀力测定:准确称取香菇柄粉末0.5 g 置于有刻度的玻璃试管中,记录香菇柄粉末的原体积,加入8 mL 蒸馏水,振荡摇匀,20 ℃下静置24 h,记录样品吸水后的体积。按照公式(7)计算膨胀力。
式中:V1表示样品吸水后的体积,mL;V2表示样品的原体积,mL;m 表示样品的质量,g。
1.2.3 香菇柄粉末功能物质的溶出特性分析
1.2.3.1 香菇柄粉末麦角固醇的检测方法 麦角固醇含量测定液相条件参考刘莉等[22]的方法,略作修改。麦角固醇检测条件:Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相纯甲醇,柱温30 ℃,紫外检测波长270 nm,进样量20 μL,流速1 mL/min,运行时间15 min。以麦角固醇的峰面积为纵坐标,麦角固醇的质量浓度为横坐标,绘制麦角固醇的标准曲线,得到标准曲线y=23.836x+8.2651,R2=0.9998。
1.2.3.2 麦角固醇溶出动力学分析 精确称取1 g 香菇柄粗粉、40 目粉、超微粉,分别加入100 mL 无水乙醇中,50 ℃下超声(功率300 W,40 kHZ)提取,分别在1、3、5、7、10、20、30、45、60 min 时吸取1 mL上清液,吸取完毕后立即加入1 mL 无水乙醇,保证总体积不变(防止因溶液体积减小,导致麦角固醇含量变大)。上清液离心,过0.22 μm 滤膜后经HPLC测定不同时间麦角固醇含量,麦角固醇溶出量以每克样品所含麦角固醇质量计,单位为μg/g。绘制溶出量与时间关系的曲线,并根据威布尔模型[23-24]对结果进行拟合,根据公式(8)对累计溶出率F(%)和时间t(min)进行拟合。
式中:m 表示曲线的形状参数;η表示曲线的比例参数,对公式(8)进行变换得到ln[-ln(1-F)]=mlnt-mlnη,根据拟合公式结果求参数m 和η。
1.2.3.3 香菇柄粉末多糖的测定方法 香菇柄粉末多糖含量的测定,参考金瑾等[25]的方法略作改动。精确称取无水葡萄糖0.1 g,蒸馏水溶解,配成质量浓度1 mg/mL 的葡萄糖标准液。分别吸取该葡萄糖溶液0、0.20、0.40、0.60、0.80、1.00 mL 于10 mL 试管中,加水至1 mL。向葡萄糖溶液中加入1 mL 质量分数2%的苯酚溶液,再加入2 mL 浓硫酸,90 ℃加热10 min,蒸馏水冲洗试管降至25 ℃,在490 nm处测其吸光度绘制标准曲线,得到线性回归方程为y=0.876x+0.005,R2=0.9997。
1.2.3.4 多糖溶出动力学分析 精确称取1 g 香菇柄粗粉、40 目粉、超微粉,分别加入10 mL 离心管中,随后加入5 mL 蒸馏水,50 ℃水浴,分别在1、3、5、7、10、20、30、45、60 min 时离心取上清液,根据多糖的标准曲线测定上清液中多糖的含量。多糖溶出量以每克样品所含多糖的质量计,单位为 mg/g。绘制溶出量与时间关系的曲线,并根据威布尔模型对结果进行拟合,根据公式(8)对累计溶出率F(%)和时间t(min)进行拟合。
1.3 数据处理
采用Graph Pad Prism8 和Origin2021 软件对数据进行处理。采用SPSS26.0 进行差异显著性分析,所有样品平行测定3 次,以平均值±标准差表示,均数比较采用邓肯多量程检验(P<0.05)。
2 结果与分析
2.1 不同处理对香菇柄粉末理化性质的影响
2.1.1 不同处理对香菇柄粉末粒径的影响 不同处理的香菇柄粉末累计粒径分布,如图1 所示,粗粉和40 目粉的样品出现了两个粒径的峰。超微粉的样品粒径呈现单峰分布,超微粉的粒径最小,粒径主要分布在1~10 μm 之间,粒径分布更加均匀,40 目粉的香菇柄粉末的粒径主要分布在1~1000 μm 之间,粗粉的粒径主要在3~3000 μm 之间,且粒径分布不均匀,粉体均一性差。

图1 不同处理香菇柄粉末的累积粒径分布Fig.1 Particle size distribution of Lentinus edodes stem powder with different treatments
香菇柄粉末的粒径分布如表1 所示。超微粉与粗粉和40 目粉相比,样品的D10、D50、D90、跨度值、D(3,2)和D(4,3)显著减小(P<0.05);比表面积显著增大(P<0.05)。与粗粉相比,气流超微粉碎的D10由12.15 μm 降到1.66 μm,降低了86.34%,D50由185.23 μm 降低到3.21 μm,降低了98.27%,D90由920.75 μm 降低到5.99 μm,降低了99.35%;比表面积由0.17 m2/g 增大到2.06 m2/g,比表面积的增大可能会增加粉体的溶出能力。D50降至3.21 μm 表明粉体进入了超微粉的范围[26]。粒径分布结果与Heo 等[27]使用气流超微粉碎处理双孢菇后D50由231.00 μm 减小到7.10 μm,跨度值减小的变化结果相似。与普通粉碎相比,气流粉碎可以严格控制粉体粒径,在气流超微粉碎过程中,粗粉被持续粉碎使其粒径减小,粉体在压缩气体的作用下进入粒径分离装置,将达到粒径要求的粉末排出,使粉末的粒径分布更窄更均匀[28]。
2.1.2 不同处理对香菇柄粉末微观结构的影响 不同处理的香菇柄粉末扫描电镜如图2 所示,分别对样品进行了200 倍和1000 倍的放大处理,粗粉呈现出不规则的球状、长条状、粉体颗粒大小不一,样品均一性差,40 目粉的样品呈现出不规则的长条状,超微粉的样品呈现出细小的颗粒状,表面的形状发生了变化,这可能是因为气流超微粉碎的机器将空气压缩行成超高速气流,在碰撞室内物料被气流冲击,使物料相互碰撞、摩擦[29],从而使样品粒径减小,形状改变。在相同视野下的气流超微粉碎的样品颗粒数目最多,颗粒分布变得均匀,扫描电镜的结果与粒径的结果一致。
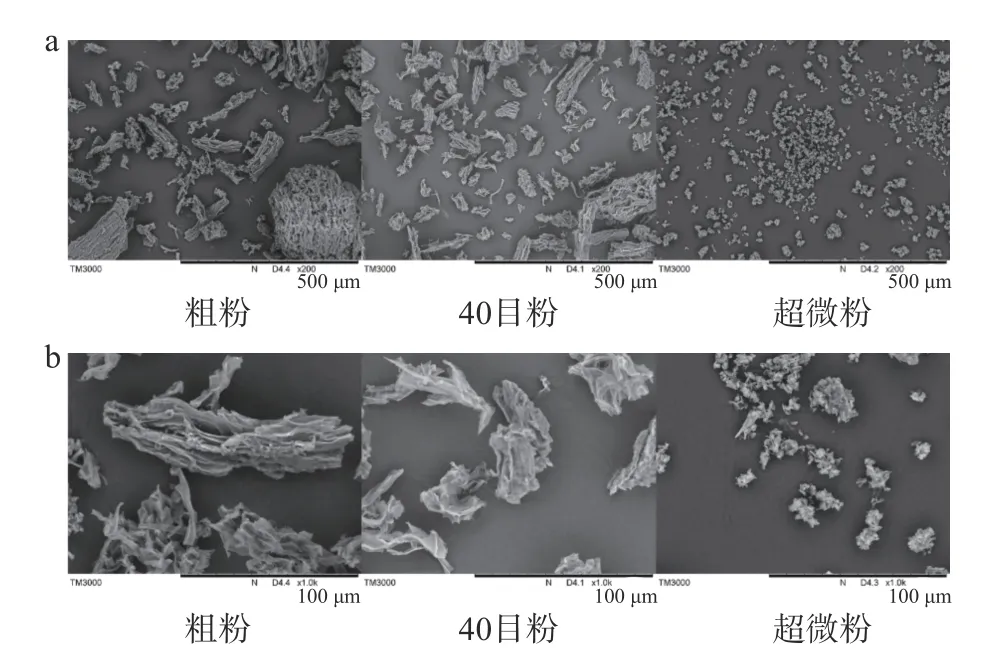
图2 不同处理香菇柄粉末的扫描电镜图Fig.2 SEM of Lentinus edodes stem powder with different treatments
2.1.3 不同处理对香菇柄粉末色泽的影响 颜色是食品粉末的重要品质,它对决定消费者对各种食品的可接受程度起着重要的作用。不同处理的香菇柄粉末色泽如图3 所示,粗粉的L*值、a*值和b*值与香菇柄接近,40 目粉L*值显著高于香菇柄,a*值和b*值显著低于香菇柄(P<0.05)。气流超微粉碎的香菇柄粉末L*值最高,与香菇柄相比超微粉的L*值显著升高,a*值和b*值显著降低(P<0.05)。这与Phat 等[30]报道的超微气流粉碎后猴头菇的L*值增加,a*值和b*值下降的研究结果相似。L*值的上升可能是因为气流超微粉碎后粉末的表面积增加,内部的结构暴露增加,粉末被粉碎的越细,对光的反射越强,导致其L*值上升[31]。a*值和b*值的下降可能是因为气流超微粉碎使香菇柄粉末纤维组分分布更加均匀,减少了色素的暴露[32]。三种加工方式的ΔE大小依次为,粗粉<40 目粉<超微粉。对于ΔE在0~2 左右,颜色变化是不可见的,但当ΔE大于2 时,颜色变化是明显和可见的[33],超微粉ΔE的增加是因为L*值的增加起到了主要的影响作用,40 目粉的ΔE高于粗粉,这可能是因为过筛去除了有颜色的大颗粒物质,本研究中ΔE的变化说明气流粉碎显著改变了香菇柄的色泽,使其颜色更加明亮,能够更好地被消费者认可。
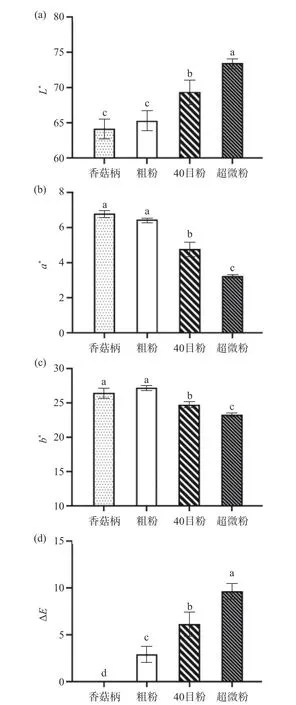
图3 不同处理香菇柄粉末的L*(a),a*(b),b*(c),ΔE(d)Fig.3 L* (a),a* (b),b* (c),ΔE (d) of Lentinus edodes stem powder with different treatments
2.1.4 不同处理对香菇柄粉末密度的影响 堆积密度和振实密度是评价粉体填充性能与压片性能的指标。堆积密度越大说明粉体的填充性能越好,振实密度越大说明粉体越容易压片成型[34]。通过对上述两种密度的比较,可以衡量粉末中颗粒间的相互作用。香菇柄粉末的堆积密度和振实密度如表2 所示,超微粉与粗粉相比粉体的堆积密度和振实密度显著增大(P<0.05),堆积密度从0.15 g/mL 增加到0.25 g/mL,振实密度从0.23 g/mL 增加到0.42 g/mL。说明粒径越小,粉末的堆积密度和振实密度越大,这与王朝川等[35]报道的超微粉碎使金针菇粉体粒径减小、堆积密度增大的结论类似。与普通粉碎相比,超微粉碎后粉体比表面积增大,粉体间作用力增强,在相同的质量下粉体所需的体积变小,从而增加了粉体的堆积密度和振实密度[36]。

表2 不同处理香菇柄粉末的密度Table 2 Powder density of Lentinus edodes stem powder with different treatments
2.1.5 不同处理对香菇柄粉末流动性的影响 粉末休止角和滑角是评价粉体流动性的指标。香菇柄粉末的休止角和滑角变化如表3 所示,粗粉、40 目粉、超微粉的休止角和滑角呈下降趋势,超微粉显著低于粗粉和40 目粉的休止角和滑角(P<0.05),休止角由47.20°减小到38.30°,滑角由42.68°减小到35.09°。休止角和滑角越小,说明粉体的流动性越好[37]。经过气流超微粉碎后,香菇柄粉末的粒径减小,粉体流动性得到改善。粉体的流动性除了与粒径有关外,还与粉体的本身的性质(摩擦力、粉体形状)[6],以及水分含量[38]有关。本研究表明超微气流粉碎可以显著提高香菇柄粉末的流动性,这与Ming 等[39]报道的超微粉碎后香菇粉末的粒径减小,粉体的休止角由48.32°减小到44.15°;滑角由41.12°减小到35.75°,香菇粉流动性增加的研究结果类似,这可能是因为超微粉的粉体大小均一、形状相似、摩擦力小,在重力的作用下更容易下滑,增加了香菇粉的流动性,普通粉碎的粉体颗粒形状大小相差较大,彼此之间相互阻碍使其流动性减弱。
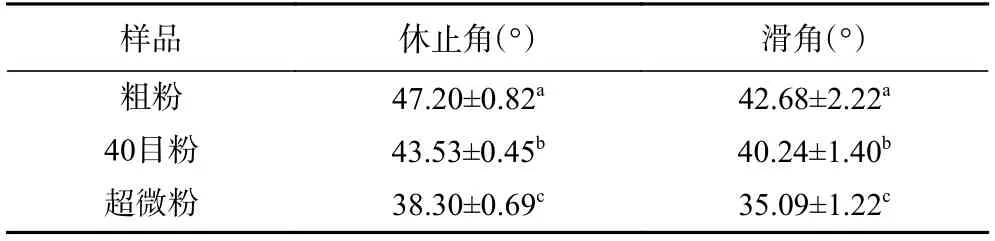
表3 不同处理的香菇柄粉末流动性Table 3 Flow properties of Lentinus edodes stem powder with different treatments
2.1.6 不同处理对香菇柄粉末持水力和膨胀力的影响 香菇柄粉末的持水力和膨胀力如图4 所示,经过气流超微粉碎处理后,香菇柄粉末的膨胀力和持水力都显著增加(P<0.05),持水力由粗粉的4.04 g/g增加到4.82 g/g,膨胀力由粗粉的2.32 mL/g 增加到7.02 mL/g,这可能是因为气流超微粉碎后,粉体的表面积变大,细胞壁被更多地破碎,粉体中的纤维素等亲水基团更多地暴露出来,使粉体更多地与水分接触,导致持水力与膨胀力增加[40]。刘丽娜等[41]使用球磨粉碎对香菇柄进行超微粉碎处理,超微粉的持水力和膨胀力显著提高,这可能是因为与普通粉碎相比,超微粉碎提高了香菇柄粉末中可溶性膳食纤维素的含量,降低了不溶性膳食纤维的含量进而提高了香菇柄粉末的持水力与膨胀力。

图4 不同处理香菇柄粉末的持水力(a)和膨胀力(b)Fig.4 Water holding capacity (a) and expansion force (b) of Lentinus edodes stem powder with different treatments
2.2 不同处理对香菇柄粉末功能物质溶出特性的影响
2.2.1 不同处理的香菇柄中麦角固醇和多糖溶出量的研究 不同处理香菇柄粉末的麦角固醇溶出量如图5a 所示,在1 min 时,超微粉的麦角固醇溶出量为29.24 μg/g,显著高于40 目粉的23.54 μg/g 和粗粉的20.12 μg/g(P<0.05),在0~10 min 期间随着时间的增加,麦角固醇的溶出量逐渐增大,10 min 后3 种粉体的麦角固醇的溶出速率很小并趋于稳定。在60 min 时超微粉的麦角固醇溶出量为44.28 μg/g,显著高于40 目粉的34.75 μg/g 和粗粉的30.79 μg/g(P<0.05)。实验结果表明气流超微粉碎处理可以增加麦角固醇的溶出量,这与陈璁等[42]使用超微粉碎技术处理双孢蘑菇,提高了麦角固醇的溶出量的研究结果类似。与普通粉碎相比,气流超微粉碎具有较好的细胞壁破除效果,细胞膜被暴露,麦角固醇是真菌细胞膜的重要组成成分[43],增加了细胞膜与溶剂的接触面积,增加了麦角固醇的溶出。

图5 不同处理香菇柄粉末的麦角固醇(a)和多糖(b)溶出曲线Fig.5 Dissolution curve of ergosterol (a) and polysaccharides(b) from Lentinus edodes stem powder with different treatments
不同处理香菇柄粉末的多糖溶出量如图5b 所示,在1 min 时,超微粉的多糖溶出量为1.37 mg/g,显著高于40 目粉的1.13 mg/g 和粗粉的1.02 mg/g(P<0.05),在0~10 min 期间随着时间的增加,多糖的溶出量逐渐增大,30 min 后3 种粉体的多糖的溶出速率增长变小并趋于稳定。在60 min 时超微粉的多糖溶出量为6.54 mg/g,40 目粉的多糖溶出量为5.53 mg/g,粗粉的多糖溶出量为4.46 mg/g。实验结果表明气流超微粉碎处理可以增加多糖的溶出量,这与Xu 等[44]使用超微粉碎处理草菇,多糖的溶出量提高了1.45 倍的研究结果相似。可能是因为气流超微粉碎后,减小了粉体的粒径,增大了粉体的表面积,使其在相同的时间里能更好地与溶剂接触,从而增加了多糖溶出量[45]。
2.2.2 不同处理的香菇柄中麦角固醇和多糖溶出动力学分析 为了更好地研究麦角固醇和多糖溶出规律,根据香菇柄粉末的麦角固醇和多糖的溶出量数据,按Weibull 模型进行拟合,拟合曲线如图6 所示,以lnt,ln[-ln(1-F)]为变量拟合出3 种不同处理香菇柄粉末麦角固醇和多糖溶出率的回归方程,F 为不同时间的累计溶出率,并计算溶出度参数T50,Td,Q45(T50为累计溶出50%所需时间,Td为累计溶出63.2%所需时间,Q45为45 min 的累计溶出率)。由表4 可以看出,香菇柄经过气流超微粉碎后,麦角固醇的溶出度参数T50和Td分别由原来的4.12 min、20.08 min 下降到1.56 min、6.59 min,Q45由原来的65.04%增加到75.92%(P<0.05);多糖的溶出度参数T50和Td分别由原来的17.03 min、36.45 min 下降到8.89 min、15.79 min,Q45由原来的65.45%增加到84.60%(P<0.05)。这与廖吕燕等[46]使用超微粉碎处理灵芝后多糖和三萜类物质的T50和Td下降结果相似。与粗粉和40 目粉相比超微粉的粒径显著降低,粉体达到超微粉级别,破除了香菇柄粉末中功能物质溶出的屏障,增加了功能物质的溶出[47],导致超微粉的T50和Td下降、Q45上升。溶出动力学结果表明拟合计算得出的溶出参数可以对不同粉体中功能物质的溶出量进行定量分析,并通过拟合方程可以对香菇粉的功能物质的溶出率进行预测。
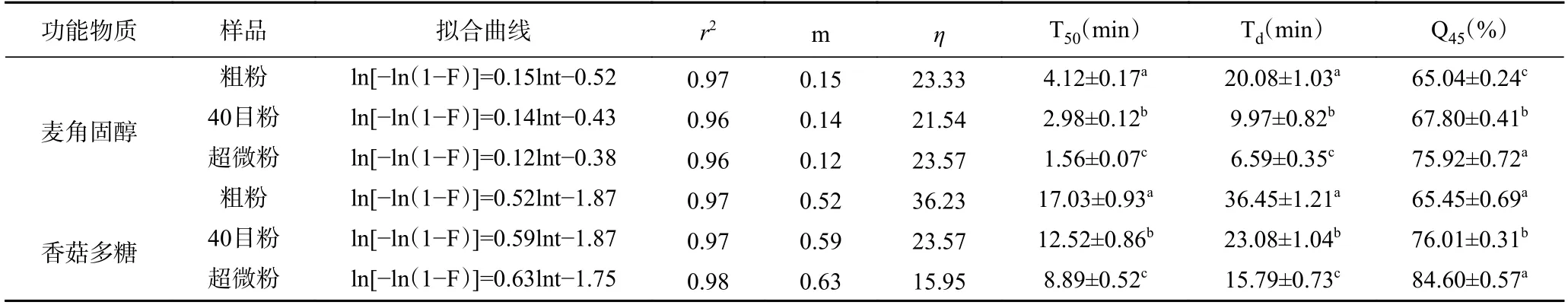
表4 香菇柄粉末麦角固醇和多糖的拟合曲线及溶出度参数Table 4 Fitting curve and dissolution parameters of ergosterol and polysaccharide from Lentinus edodes stem powder
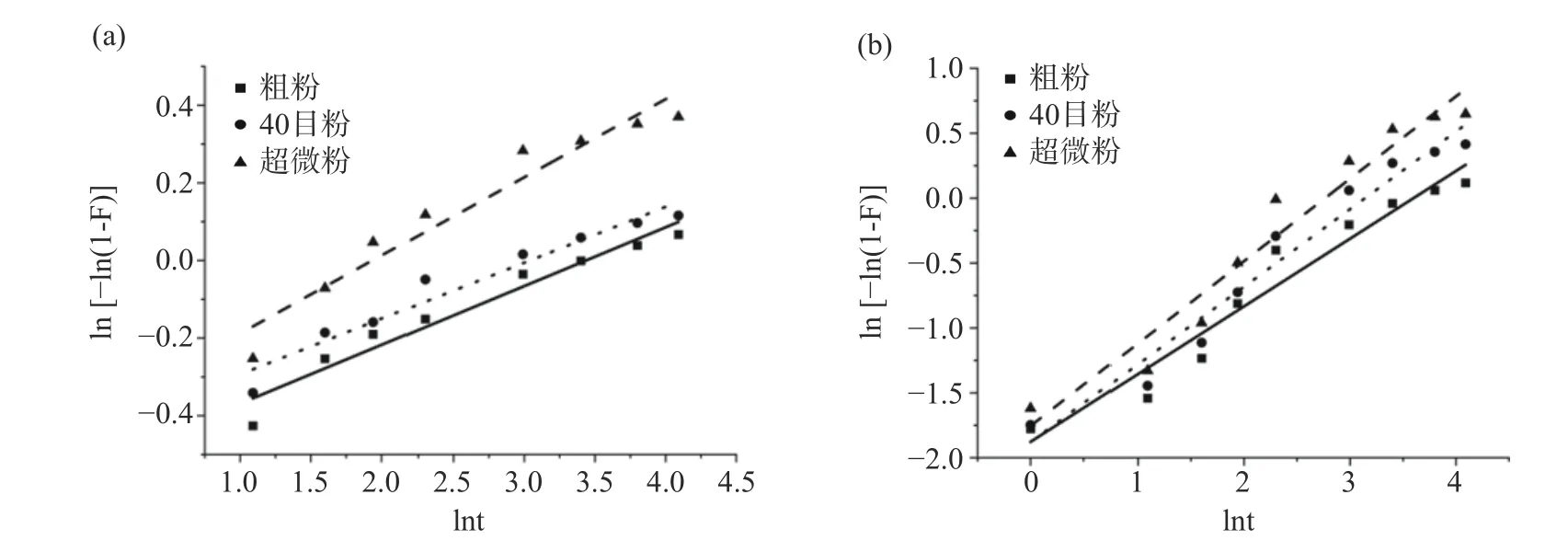
图6 不同处理香菇柄粉末中麦角固醇(a)和多糖(b)溶出曲线的威布尔模型拟合Fig.6 Weibull model fitting of dissolution curve of ergosterol (a) and polysaccharides (b) from Lentinus edodes stem powder with different treatments
3 结论
本实验对香菇柄粉末进行气流超微粉碎处理,以粗粉和40 目粉为对照,研究了气流超微粉碎对香菇柄粉末理化性质及以麦角固醇和多糖为代表的功能物质溶出特性的影响。结果表明,经过气流超微粉碎处理后,香菇柄粉末的平均粒径D50降至3.21 μm,粉体比表面积增大,L*值升高,休止角和滑角减小,粉末流动性增强,堆积密度、振实密度、持水力、膨胀力显著提高(P<0.05)。60 min 时超微粉麦角固醇和多糖的溶出量分别是粗粉的1.43 和1.46 倍。与粗粉相比超微粉麦角固醇和多糖的T50分别减少了2.56 和 8.14 min,Q45分别增加了 10.88% 和 19.15%。综上所述气流超微粉碎可以改善香菇柄粉末的理化性质,增加香菇柄中功能物质的溶出。本研究为气流超微粉碎处理后香菇柄粉末理化性质的变化、香菇副产物的利用以及香菇柄的精深加工提供了一定的参考。

