基于网络药理学和体外实验探讨瓜蒌-薤白药对抗动脉粥样硬化的作用机制
贾子君,周庆兵,张 艳,徐凤芹*
1.中日友好医院,北京100029;2.中国中医科学院西苑医院老年医学研究所,北京100091
以动脉粥样硬化(atherosclerosis, AS)为病理基础的冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease, CHD)是目前导致人类死亡的主要疾病之一[1-2]。 在过去30 年中,他汀类药物奠定了AS 类疾病的治疗基石。 然而,在临床实际使用中发现,他汀类药物存在相对较多的不良反应,包括增加患糖尿病的风险以及引起肌肉疼痛等,这些不良反应限制了他汀类药物的使用[3]。 越来越多的证据表明,中医药在对包括CHD 在内的AS类疾病的预防、治疗和康复方面发挥重要作用[4],值得进一步深入挖掘。
中医学并无AS 的对应疾病病名,根据AS 类疾病的常见临床症状表现,可将其归于“胸痹”“眩晕”等范畴[5]。 瓜蒌-薤白药对(Gualou-Xiebai herb pair,GXHP)是《金匮要略》中治疗胸痹的常用药对,其中瓜蒌性寒,味甘、苦,能宽胸散结、清润化痰;薤白性温,味辛、苦,可温中通阳、行气散结、活血止痛。千百年来,GXHP 一直是治疗AS 类疾病最常用的药对,经典名方瓜蒌薤白白酒汤在治疗CHD 心绞痛时疗效显著,可有效降低患者的血脂及血液黏度[6]。田盼盼等[7]通过临床试验发现,瓜蒌薤白半夏汤合丹参饮能有效缓解不稳定型心绞痛痰瘀互结证患者心绞痛的临床症状,降低患者的血脂,减少发作次数及硝酸甘油的用量。 但GXHP 抗AS 的作用机制仍不清楚,从而限制了其进一步运用,因而有必要从现代生物学角度阐明其抗AS 的效应机制。
本研究将网络药理学方法与体外实验结合,探讨GXHP 抗AS 的效应机制。 通过网络药理学预测GXHP 中的主要成分,筛选出GXHP 在AS 治疗中的核心靶点、相关信号通路,并构建蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络。 在细胞实验部分,运用CCK-8 检测GXHP 对Raw264.7细胞的增殖抑制作用,以此确定后续的药物作用浓度,以氧化型低密度脂蛋白(oxidized-low density lipoprotein, ox-LDL)处理Raw264.7 细胞构建泡沫细胞模型,并利用该模型评估GXHP 的抗AS 效应,包括抗炎与降脂效应。最后,采用Western blot 法对网络药理学筛选的信号通路进行验证。
1 材料和方法
1.1 主要药物与试剂、仪器
1.2 GXHP 成分筛选
通过TCMSP 数据库(https://old.tcmsp-e.com/index.php)获取瓜蒌与薤白所含化合物,结合吸收、分布、代谢及排泄评价指标,根据药代动力学特性,以口服生物利用度(oral bioavailability, OB)≥30%和类药性(drug-likeness, DL)≥0.18 为限定条件对所收集到的化合物进行筛选[8]。
1.3 药物-成分-分子靶点网络构建
通过SwissTargetPrediction(http://www.swisstargetprediction.ch/)确定GXHP 的成分靶点。从OMIM数据库(http://www.omim.org/)、GeneCards 数据库(https://www.genecards.org/)、Drugbank 数 据 库(https://www.drugbank.ca/)以及Therapeutic Target 数据库(https://db.idrblab.org/ttd/)等数据库中获取AS 的靶点,并与GXHP 的成分靶点取交集。 使用Cytoscape 3.7.7软件构建药物-成分-分子靶点-AS 的网络图。 在本研究中,大于Degree 值中位数2 倍的节点被选为核心靶点。
1.4 PPI 构建
为了更好地理解核心靶标之间的相互作用,应用STRING 3.0(https://string-db.org/)构建PPI 网络。限定物种为Homo sapiens(智人),并选择置信度≥0.9作为筛选条件,使用Cytoscape 3.7.7 软件对结果进行可视化展示。
1.5 京都基因和基因组数据库(Kyoto encyclopedia of genes and genomes, KEGG)信号通路富集分析
将筛选到的核心靶点运用DAVID 数据库(https://david.ncifcrf.gov/)进行KEGG 富集分析,得到GXHP治疗AS 的关键信号通路,根据P<0.01 的标准,使用R 语言对KEGG 的前15 条结果进行可视化展示。
1.6 泡沫细胞模型建立
Raw264.7 细胞株由中国中医科学院医学实验中心提供,培养基为含10%胎牛血清的DMEM 高糖培养基,在37 ℃、5% CO2的孵育箱中进行培养,在细胞密度达80%左右时进行传代。 参考既往文献资料[9],以ox-LDL 处理Raw264.7 细胞48 h,油红O染色观察细胞内脂质颗粒。
1.7 油红O 染色
使用异丙醇(分析纯级)溶解油红O 粉末,制备0.5 w/v 浓度的油红O 原液,使用时将油红O 原液与去离子水以3∶2 比例进行稀释,使用双层滤纸过滤3 次,室温放置10 min,弃下层沉淀。 使用6 孔板培养细胞,负压弃去培养液,加入4%多聚甲醛固定20 min,吸出多聚甲醛溶液,加入油红O 染色液静置10 min,使用自来水缓慢漂洗,对背景进行脱色处理,直至去除染色液,放置在显微镜下观察、拍照。
1.8 CCK-8 观察GXHP 对Raw264.7 细胞的增殖抑制作用
制备细胞悬液,密度为1×105个/mL,接种于96孔板中,4 h 后加入含有不同浓度GXHP 的完全培养基,继续于培养箱中培养48 h 后弃去药液,加入培养液与CCK-8 试剂的混合液(比例为9∶1),1 h后使用酶标仪在450 nm 处进行吸光度的检测,计算各组的细胞存活率,根据细胞存活率确定后续实验的药物处理浓度。
1.9 气相色谱质谱法(gas chromatography-mass spectrometry, GC-MS)检测GXHP 的降脂效应
将细胞分为5 组,分别为空白组(无处理)、模型 组(80 μg/mL ox-LDL 处理)、GXHP 低剂量组(80 μg/mL ox-LDL+0.2 g/L GXHP)、GXHP 中剂量组(80 μg/mL ox-LDL+0.6 g/L GXHP)和GXHP 高剂量组(80 μg/mL ox-LDL+1.8 g/L GXHP),于6 孔板中培养,处理48 h 后采集各组细胞进行GC-MS检测。 步骤如下:(1)总胆固醇(total cholesterol, TC)样本,取样品0.5 mL,加入3 mL 无水乙醇、2 mL 60%氢氧化钾,100 ℃回流1 h 后加5 mL 10%氯化钠溶液、2 mL 石油醚与乙醚混合液(石油醚∶乙醚=1∶1),振摇后离心取上层进样;(2)游离胆固醇(free cholesterol, FC)样本,量取样品0.5 mL,加10%氯化钠2 mL 后混匀,加石油醚、乙醚混合物2 mL,振摇后离心取上层进样;(3) 设置气相色谱质谱仪参数,采用Rtx-5MS 色谱柱,进样口温度设置为280 ℃,升温程序为150 ℃保持1 min,以40 ℃/min 升至300 ℃,保持7 min。
床层复氧可采取数种方式加以强化:①干湿交替的间歇运行方式;②床内设置通气管进行自然或强制复氧;③利用植物的根系对系统内部进行复氧,这项研究国内外已有相关进展。
1.10 ELISA 法检测GXHP 的抗炎效应
分组同上,处理48 h 后采集各组细胞上清液进行ELISA 检测,按照检测试剂盒说明书中的步骤进行操作,根据标准品的浓度和吸光度值,使用Excel软件计算出标准曲线的直线回归方程,再根据样本的OD 值计算出对应样本中炎症因子(IL-6、ICAM-1)的浓度。
1.11 Western blot 检测GXHP 对MAPK 信号通路的作用
分组同上,处理48 h 后收集各组细胞,使用蛋白提取试剂盒提取细胞蛋白,BCA 法测定各组蛋白浓度。SDS-PAGE 电泳3 h,随后将蛋白样本转移至PDVF 膜上,以TBST 洗膜后封闭1 h,洗膜后加入不同比例一抗并室温孵育过夜,各一抗比例如下:抗p-ERK(1∶500)、抗ERK(1∶1 000)、抗p-p38(1∶1 000)、抗p38(1∶1 000)、抗NF-κB-p65(1∶1 000)和抗NF-κB p-p65(1∶1 000)。 再次洗膜后加入二抗,使用增强型化学发光试剂,于曝光机曝光,扫描后使用Quantity One 分析目标条带灰度值,做定量统计。
1.12 统计学方法
2 结果
2.1 GXHP 活性成分
在TCMSP 数据库检索到GXHP 中具有相关作用靶点的成分21 个,包括10 种来自瓜蒌的成分和11 种来自薤白的成分。 成分相关信息分别列于表1和表2。

表1 瓜蒌的活性成分
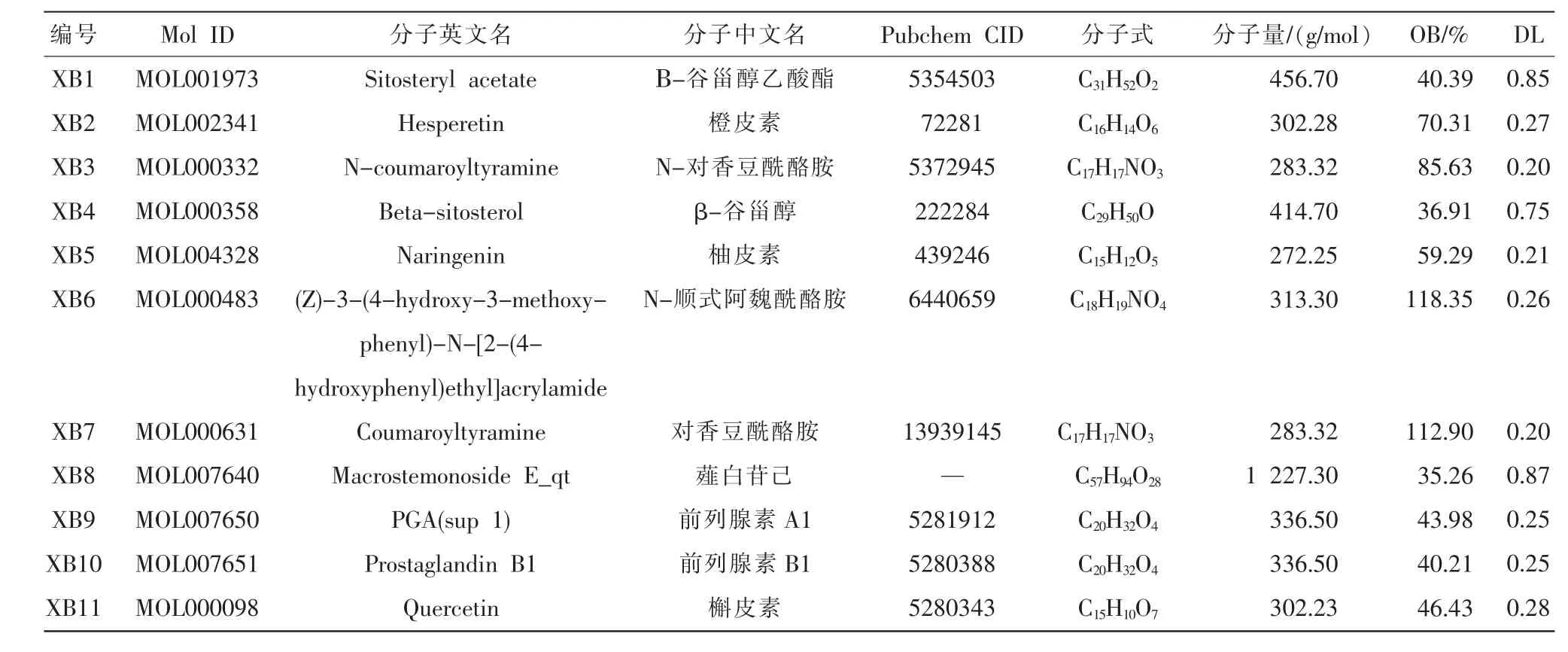
表2 薤白的活性成分
2.2 GXHP-活性成分-AS 靶点网络
通过GeneCards、Drugbank、GeneCards 以及Therapeutic Target 等数据库共确定34 012 个AS 疾病相关靶点。 将GXHP 中主要成分对应的作用靶点与34 012 个AS 相关靶点取交集,得到21 种主要成分,共对应154 个作用靶点,进一步通过网络拓扑分析得到36 个核心靶点,包括JUN、STAT3、MAPK3 和AKT1等,使用Cytoscape 3.7.7 软件构建药物-GXHP 活性成分-AS 靶点网络。 详见图1。
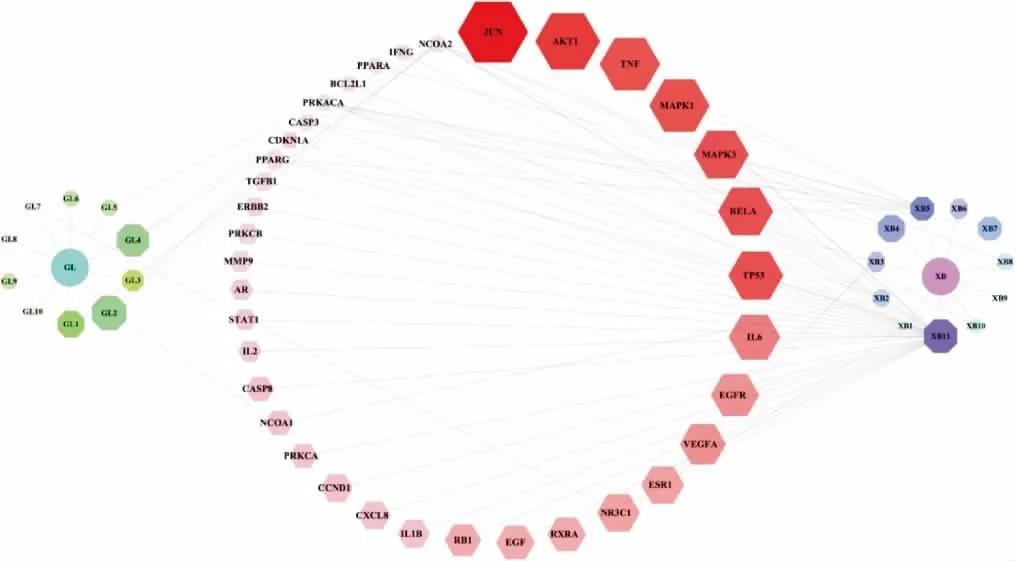
图1 药物-GXHP 活性成分-AS 靶点网络图
2.3 GXHP 核心靶点的PPI 网络图
将36 个核心靶点导入STRING 数据库,获取PPI网络图。 图2 显示JUN、STAT3、MAPK3、AKT1 等在网络图中占有核心位置。

图2 36 个核心靶点PPI 网络
2.4 KEGG 富集分析
将36 个核心靶点导入DAVID 6.8 在线数据分析平台,进行KEGG 富集分析。 按P 值升序排列,选取前15 条KEGG 信号通路进行展示。 图3 显示GXHP 治疗AS 的核心靶点涉及脂质与AS、MAPK和PI3K-Akt 等信号通路。
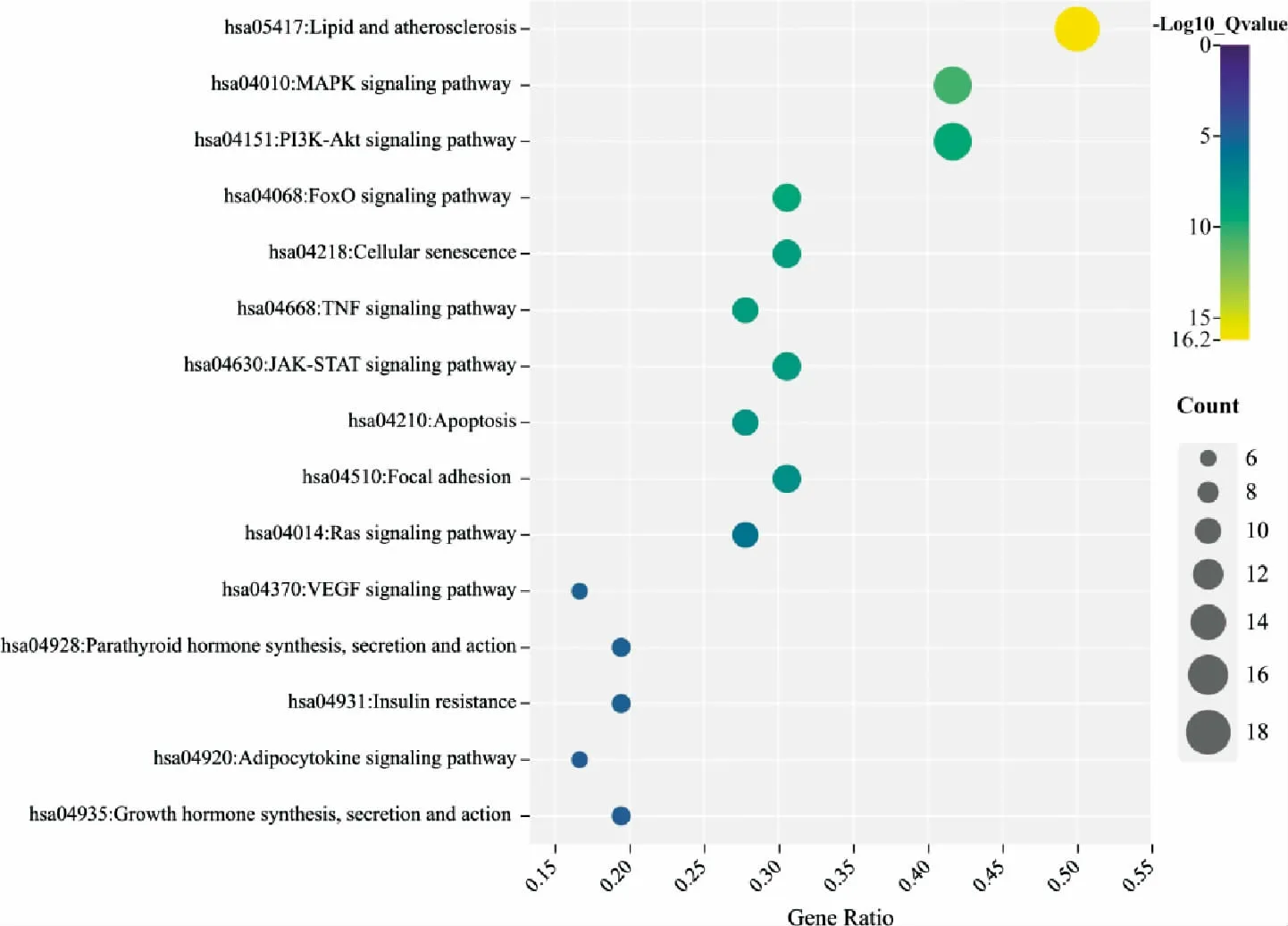
图3 GXHP 核心靶点KEGG 富集分析气泡图
2.5 GXHP 对Raw264.7 细胞的增殖抑制作用
CCK-8 结果显示,GXHP 在0~2.0 g/L 之间,48 h处理后细胞的存活率可达95%以上。与0 g/L 比较,4、8、16、32 g/L GXHP 细胞存活率降低(P<0.01)(图4)。 为避免GXHP 的细胞毒性作用,本研究在后续实验中选择1.8、0.6、0.2 g/L 分别作为GXHP 高、中、低剂量组浓度。

图4 GXHP 对Raw264.7 细胞存活率的影响(48 h,±s,n=3)
2.6 GXHP 对泡沫细胞TC、FC 及ICAM-1、IL-6 的影响
油红O 染色结果显示,经ox-LDL 处理后,空白组细胞中无橙红色脂滴(图5A),模型组细胞内可见大量橙红色脂滴(图5B)。

图5 油红O 染色结果(×200)
与空白组比较,模型组中TC 及FC 的表达水平显著升高(P<0.01);与模型组比较,GXHP 高、中剂量组TC 及FC 的表达显著降低(P<0.01)(图6A、B)。
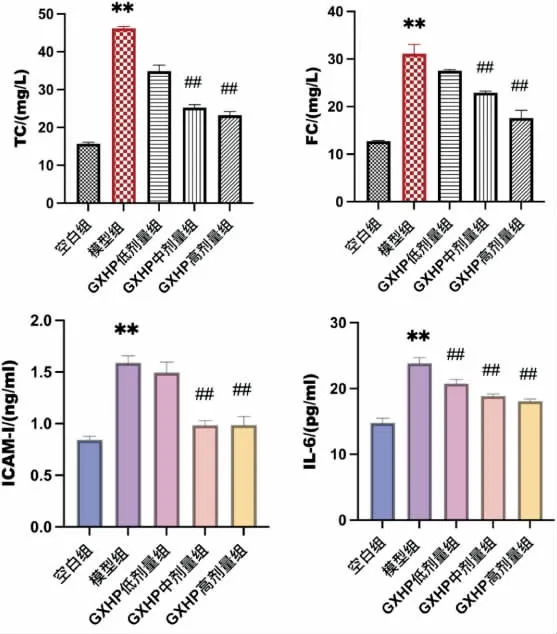
图6 GXHP 对泡沫细胞脂质和炎症因子的表达作用(±s,n=5)
与空白组比较,模型组细胞上清液中IL-6、ICAM-1 的表达水平显著升高(P<0.01);与模型组比较,GXHP高、中、低剂量组IL-6 的表达水平明显下调(P<0.01);GXHP 高、中剂量组ICAM-1 的表达水平明显下调(P<0.01)(图6C、D)。
2.7 GXHP 抑制MAPK 信号通路核心蛋白的表达
与空白组相比,模型组泡沫细胞中p-ERK/ERK、p-p38 MAPK/p38 MAPK 和p-p65/p65 的相对表达水平明显升高(P<0.01);与模型组相比,GXHP 高、中、低剂量组中p-ERK/ERK、p-p38 MAPK/p38 MAPK和p-p65/p65 相对表达水平明显降低(P<0.05 或P<0.01)。 详见图7。

图7 GXHP 对各组p-ERK/ERK、p-p38/p38、p-p65/p65 相对蛋白表达水平的影响(±s,n=3)
3 讨论
AS 是包括CHD 在内众多疾病的主要病理基础,是目前导致人口死亡的主要原因。GXHP 为张仲景治疗胸痹的最常用药对,在防治AS 类疾病中显示出了其独特的临床疗效,如刘丽清等[10]使用瓜蒌薤白半夏汤治疗心绞痛患者获得了良好的临床效果。 周宏伟等[11]发现,瓜蒌薤白半夏汤在治疗CHD患者时可抑制炎症因子的表达。彭喜洋等[12]发现,瓜蒌薤白半夏汤加减能显著降低CHD 痰浊痹阻证患者的血脂水平且提高患者心功能。然而,关于GXHP抗AS 的分子机制的报道较少,这限制了其治疗AS的临床应用范围。
网络药理学目前已被广泛用于揭示中药的分子作用机制[13]。 在本次研究中,我们发现GXHP 有21个可能的活性成分,包括槲皮素、柚皮素、葫芦素D和香叶木素。 同时确定了GXHP 活性成分对应的36个核心作用靶点,包括JUN、STAT3、MAPK3 和AKT1等,在此基础上构建了药物-成分-分子靶点-疾病网络。 与此同时,对36 个核心靶点进行KEGG 富集分析,发现GXHP 治疗AS 的核心靶点涉及脂质与AS、MAPK 和PI3K-Ak 等信号通路。 既往研究表明,MAPK 信号通路与AS 疾病的炎症反应密切相关[14]。NEWBY 等[15]和ELKHAWAD 等[16]进一步发现,抑制MAPK 信号通路可以减少AS 患者的血管炎症。 因此,我们选择MAPK 信号通路作为GXHP 体外抗AS 效应机制的靶通路,进行实验验证。
巨噬细胞摄取大量ox-LDL 可形成泡沫细胞,泡沫细胞的形成是AS 早期病变的标志性事件[17-18]。此外,泡沫细胞在受到ox-LDL 刺激后还会释放出大量的促炎症因子,进一步加速AS 的发展[19-20]。 因此,泡沫细胞模型可用来评估药物的抗AS 效应及作用机制[21-22]。在本研究中,我们以80 μg/mL 的ox-LDL 处理Raw264.7 细胞48 h,油红O 染色观察到细胞内有大量橙红色脂滴颗粒,提示造模成功。CCK-8结果显示,GXHP 对Raw264.7 细胞的增殖具有显著的抑制作用,为了避免GXHP 对Raw264.7细胞的细胞毒性作用,在后续实验中,选择1.8、0.6、0.2 g/L分别作为GXHP 高、中、低剂量组的处理浓度来观察GXHP 的抗AS 效应及相关机制。
炎症反应是导致AS 发病及进展的一个核心机制,其中IL-6 可由巨噬细胞释放,能够增强局部炎症反应,是参与AS 病变及进展的重要炎症因子[23]。ICAM-1 属于免疫球蛋白家族,ICAM-1 的大量表达则增强了单核细胞与内皮细胞之间的黏附,促进AS炎症的发生和发展,还能加重脂质代谢的紊乱[24]。在本研究中,我们也发现经ox-LDL 处理后,细胞培养液中炎症因子ICAM-1 和IL-6 明显升高。更重要的是,GXHP 不仅能降低TC 和FC 的水平,还能减少炎症因子ICAM-1 和IL-6 的表达,提示GXHP 具有显著的抗AS 效应。
为进一步探索GXHP 抗AS 作用的分子机制,我们观察了GXHP 处理后各组MAPK 信号通路核心蛋白ERK、p38 和p65 等的表达变化。MAPK 级联是细胞内重要的信号转导方式之一,参与多种细胞生物学反应的调节。MAPK 信号通路在未受刺激时,处于静止状态,受到炎性刺激时,在上游激酶的作用下,发生级联磷酸化而激活,MAPK 被激活后进入细胞核,使一些转录因子磷酸化,参与细胞的增殖、分化、转化及凋亡等细胞过程的调控,其核心蛋白包括p-JNK、JNK、p-ERK、ERK、p-p38、p38 等。 大量的基础研究证实,MAPK 信号通路的激活是AS 发生和发展的重要因素,与炎症、血管内皮与平滑肌细胞的增殖迁移密切相关。 如动物实验发现,ERK、p38 的激活均可促进内膜增厚和血管平滑肌细胞的增殖,而抑制ERK、p38 能够减少AS 斑块的形成[25];ZHAO等[26]通过体外实验发现,抑制MAPK 信号通路可诱导巨噬细胞呈现M2 表型,减缓炎症的发生,对AS有保护作用。 WANG 等[27]认为,抑制p38 MAPK 的激活可减少ox-LDL 诱导巨噬细胞产生的促炎作用,起到抗AS 的作用。同时,研究发现,血管紧张素Ⅱ参与内皮损伤和炎症,加速AS,应用p38 MAPK 抑制剂可以抑制血管紧张素Ⅱ对内皮损伤及炎症的影响[28]。本研究发现,与空白组比较,模型组细胞中p-ERK、p-p38 和p-p65 的表达水平明显增加,而GXHP 能降低处理组泡沫细胞中p-ERK、p-p38 和p-p65 的表达水平。
综上,基于网络药理学与体外实验的研究表明,GXHP 可能通过抑制MAPK 信号通路实现抗AS 效应。研究发现的活性成分如槲皮素、柚皮素、葫芦素D和香叶木素,以及GXHP 的核心靶点包括JUN、STAT3、MAPK3 和AKT1 等,为未来进一步深入进行抗AS研究奠定了基础。中医药治疗AS 引起的CHD、心绞痛等疾病具有良好的疗效,且具有药物价格低及不良反应少等优势,有着不可替代的地位。本研究仅基于网络药理学及体外实验探究GXHP 抗AS 的作用机制,缺乏对GXHP 中的有效成分研究。 在今后的研究中,我们将进一步明确其活性成分并对其深入研究。中医药在治疗心系疾病方面有着悠久的历史,我们相信深入研究中医药防治AS 的机制,将为AS疾病的预防和治疗提供更好的方案。

