碳酸铝铵热解制备纳米氧化铝以及陶瓷烧结
马佳进,罗 钱,李晨辉*,胡 梁,周念莺,邹 阳
(1.华中科技大学 材料成形与模具技术国家重点实验室,湖北 武汉 430074;2.武汉科技大学 精密制造研究院,湖北 武汉 430081)
纳米氧化铝粉体具有粒径小、反应活性高、比表面积大、耐高温、耐化学腐蚀、强度高等特点,在精密陶瓷、微电子器件等方面有重要的应用价值,是21 世纪高新技术领域的基础材料之一[1-4]。
纳米氧化铝粉体的制备方法按原料在反应中的存在形式可分为固相法、液相法和气相法,其中固相法包括燃烧法、热解法、机械法等,液相法包括沉淀法、溶胶-凝胶法、水热法等,气相法包括激光诱导气相沉积法、等离子体气相合成法等[5-8]。目前,纳米氧化铝粉体的主要制备方法有硫酸铝铵热解法、异丙醇铝水解法、金属铝水解法等,其中硫酸铝铵热解法在制备过程中会产生有害气体SO2;而后2种工艺较复杂,并且对设备要求较高。碳酸铝铵热解法是对硫酸铝铵热解法的改良,其克服了硫酸铝铵热解法产生有害气体SO2的缺点,并且碳酸铝铵在热解过程中产生的CO2、NH3、H2O等气体能抑制粒子之间的团聚,有利于制备粒径小的纳米氧化铝粉体[9-10]。作者以碳酸氢铵(NH4HCO3)和硫酸铝铵[NH4Al(SO4)2]为原料,采用沉淀法合成前驱体碳酸铝铵(AACH),再经热解得到纳米氧化铝粉体,并在纳米氧化铝粉体中掺入少量TiO2后烧结得到氧化铝陶瓷,系统研究热解温度、干燥方式、NH4HCO3与NH4Al(SO4)2物质的量比对前驱体AACH和热解产物氧化铝的影响。
1 实验
1.1 试剂与仪器
碳酸氢铵(NH4HCO3)、硫酸铝铵[NH4Al(SO4)2],分析纯,国药集团化学试剂。
STA449F3型热重/差热综合分析仪,德国耐驰仪器制造有限公司;X′Pert 3 Powder型X-射线衍射仪,荷兰帕纳科公司;V-Sorb 2800 型比表面积及孔径分析仪;Sirion200型场发射扫描电子显微镜,荷兰FEI 公司;MAY-Entris120型智能陶瓷孔隙率、吸水率分析仪,深圳群隆仪器设备有限公司;RMS1000IBA型高温绝缘电阻率测量系统,武汉佰力博科技有限公司。
1.2 氧化铝粉体的制备
称取适量NH4HCO3、NH4Al(SO4)2分别置于烧杯中,加入适量去离子水,用磁力搅拌器充分搅拌使其溶解,分别得到2 mol·L-1的NH4HCO3溶液、0.2 mol·L-1的NH4Al(SO4)2溶液;取适量2 mol·L-1的NH4HCO3溶液置于烧杯中,置于水浴磁力搅拌器中,控制体系温度为35 ℃,通过蠕动泵按物质的量比4∶1 向烧杯中滴加NH4HCO3溶液和NH4Al(SO4)2溶液;滴加结束后,停止搅拌,静置20 min,抽滤,得到前驱体AACH;用无水乙醇洗涤2次,用无水乙醇置换水后烘干或冷冻干燥,研磨,得到AACH粉体;置于烧结炉中煅烧,使其热解,得到氧化铝粉体。
1.3 氧化铝陶瓷的制备
按球料比(氧化锆球与氧化铝粉体+TiO2的质量比)3∶1将氧化铝粉体和纳米TiO2乙醇分散液倒入尼龙球磨罐中,加入0.2%的聚乙二醇400、适量的无水乙醇,在行星球磨机中以200 r·min-1的转速球磨3 h;将氧化锆球滤出,得到浆料;烘干,研磨,过100 目筛,得到混合粉体。取适量混合粉体置于干压模具中,30 MPa干压3 min,将干压后的生坯真空封装,用冷等静压机在280 MPa压力下冷等静压保压 5 min,取出生坯,置于电阻炉中550 ℃排胶3 h;将排胶后的生坯置于氧化铝方舟中,放入管式炉,通入含8%H2的N2,于1 550 ℃烧结2 h,得到氧化铝陶瓷。
1.4 性能测试
采用X-射线衍射仪对前驱体AACH进行物相分析;采用热重/差热综合分析仪对前驱体AACH进行热重-差热(TG-DSC)分析;采用场发射扫描电子显微镜观察氧化铝粉体的微观结构;采用比表面积及孔径分析仪利用多点BET法测定氧化铝粉体的比表面积;采用智能陶瓷孔隙率、吸水率分析仪结合阿基米德排水法测定烧结后陶瓷样品的相对密度;采用高温绝缘电阻率测量系统测定陶瓷样品的体积电阻率。
2 结果与讨论
2.1 前驱体AACH的结构表征
2.1.1 XRD分析(图1)

图1 NH4HCO3与NH4Al(SO4)2物质的量比为15∶1时前驱体AACH的XRD图谱Fig.1 XRD pattern of precursor AACH when molar ratio of NH4HCO3 to NH4Al(SO4)2 is 15∶1
从图1可以看出,前驱体的3强峰15.31°、26.90°和34.93°与AACH的PDF标准卡片(COD 00-052-1138)的3强峰15.29°、26.93°和35.08°非常吻合,其它衍射峰也基本吻合,确定前驱体的物相组成为AACH。
2.1.2 TG-DSC分析(图2)
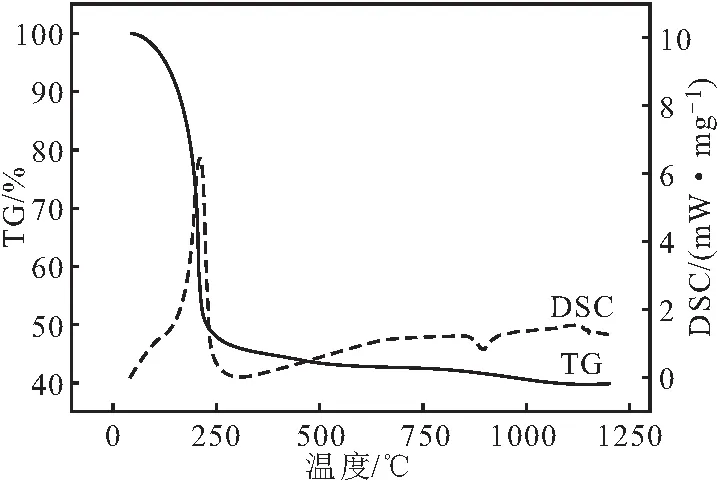
图2 前驱体AACH的TG-DSC曲线Fig.2 TG-DSC curve of precursor AACH
从图2的TG曲线可以看出,前驱体AACH 的热解可分为2个阶段:第1阶段为25~280 ℃,热解失重为53.20%;第2阶段为280~1 100 ℃,热解失重为6.82%。整个热解过程失重为60.02%。
从图2的DSC曲线可以看出,210 ℃左右时,AACH出现了明显的吸热峰,此时AACH 热解第1阶段的热解速率达到最大;895 ℃、1 150 ℃时,AACH出现了微弱的放热峰,说明均存在晶型转变,即895 ℃时无定型Al2O3转变为γ-Al2O3,1 150 ℃时θ-Al2O3转变为α-Al2O3。
根据TG-DSC分析,前驱体AACH的热解可分为以下2个阶段:(1)NH4AlO(OH)HCO3=AlOOH+NH3↑+CO2↑+H2O↑;(2)2AlOOH=Al2O3+H2O↑。第1阶段的理论失重为56.83%,第2阶段的理论失重为6.47%,整个热解过程理论失重为63.30%,与前驱体AACH 实际热解过程第1阶段失重53.20%、第2阶段失重6.82%较吻合。
2.1.3 SEM分析(图3)

图3 前驱体AACH的SEM照片Fig.3 SEM images of precursor AACH
从图3 可以看出,前驱体AACH的粒子大小均匀,粒径约为30 nm,有利于后续热解制备大小均匀且粒径较小的氧化铝粉体。
2.2 热解温度对热解产物Al2O3的影响
热解程序为:以2 ℃·min-1从室温升至250 ℃,保温1.5 h;再以5 ℃·min-1分别升至750 ℃、850 ℃、950 ℃、975 ℃、1 000 ℃、1 025 ℃、1 050 ℃、1 150 ℃、1 280 ℃,保温1.5 h。考察热解温度对热解产物Al2O3物相组成、微观形貌的影响。
2.2.1 热解温度对热解产物Al2O3物相组成的影响
AACH经不同热解温度处理后热解产物Al2O3的XRD图谱如图4所示。

图4 不同物相Al2O3的PDF标准卡片(a~c)及不同热解温度下(d)、950~1 050 ℃下(e)AACH热解产物Al2O3的XRD图谱Fig.4 PDF standard cards of Al2O3 with different phases(a-c) and XRD patterns of AACH pyrolysis products Al2O3 at different pyrolysis temperatures(d),and at 950-1 050 ℃(e)
根据不同物相Al2O3的PDF标准卡片(COD 00-043-1484 α-Al2O3,COD 00-035-0121 θ-Al2O3,COD 00-001-1303 γ-Al2O3)的标准衍射峰(图4a~c)可知,在750 ℃时,热解产物呈无定型Al2O3;升温至950 ℃时,热解产物出现较为明显的γ-Al2O3衍射峰;升温至1 050 ℃时出现较为明显的θ-Al2O3、α-Al2O3衍射峰;升温至1 150 ℃以上时出现尖锐的α-Al2O3衍射峰。故随着热解温度的升高,AACH热解产物的转变顺序为:无定型Al2O3、γ-Al2O3、θ-Al2O3、α-Al2O3。
从图4e可以看出,AACH热解产物在 1 000 ℃时未出现 α-Al2O3衍射峰;在1 025 ℃时出现微弱的α-Al2O3衍射峰;在1 050 ℃时出现较强的α-Al2O3衍射峰。故在热解温度为1 025 ℃时,可以得到活性最高且粒径小的α-Al2O3,同时以α-Al2O3粉体进行烧结可以减少后续高温烧结时Al2O3晶体相变体积变化对烧结体密度的影响。
2.2.2 热解温度对热解产物Al2O3微观形貌的影响(图5)

a~g,热解温度:750 ℃、850 ℃、950 ℃、1 025 ℃、1 050 ℃、1 150 ℃、1 280 ℃
从图5可以看出,热解温度为1 025 ℃时,热解产物Al2O3的粒径在30 nm左右(图5d);而热解温度为1 150 ℃时,热解产物Al2O3的粒径显著增大,达到上百纳米(图 5f)。这是因为,热解温度在1 025~1 150 ℃范围时,Al2O3粒子间发生烧结,粒子长大,导致粒径增大。综合XRD分析和SEM分析,选择AACH热解温度为1 025 ℃,得到的热解产物α-Al2O3活性高、粒径小。
2.3 干燥方式对前驱体AACH和热解产物Al2O3的影响
前驱体AACH粉体的分散性对热解产物Al2O3的分散性有较大影响,而AACH粉体的分散性与其干燥方式密切相关,故对前驱体AACH的2种干燥方式无水乙醇置换水和冷冻干燥进行研究。
2.3.1 干燥方式对前驱体AACH和热解产物Al2O3物相组成的影响
分别采用无水乙醇置换水干燥和冷冻干燥,前驱体AACH及热解产物Al2O3的XRD图谱如图6所示。
从图6a可以看出,两种干燥方式所得前驱体AACH的XRD图谱并无较大差异,故干燥方式对AACH 的物相组成影响较小。从图6b~d可以看出,采用无水乙醇置换水干燥的AACH在1 025 ℃下所得热解产物Al2O3出现微弱的α-Al2O3衍射峰,在1 050 ℃下α-Al2O3衍射峰更加明显;而采用冷冻干燥的AACH在1 000 ℃、1 025 ℃、1 050 ℃下所得热解产物Al2O3均无α-Al2O3衍射峰出现。故采用无水乙醇置换水干燥AACH 有利于后续热解时转变为α-Al2O3。
2.3.2 干燥方式对前驱体AACH和热解产物Al2O3微观形貌的影响
分别采用无水乙醇置换水干燥和冷冻干燥,前驱体AACH及热解产物Al2O3的SEM照片如图7所示。

图7 无水乙醇置换水干燥的AACH(a)、冷冻干燥的AACH(b)、无水乙醇置换水干燥的AACH在1 025 ℃下热解产物Al2O3(c)、冷冻干燥的AACH在1 025 ℃下热解产物Al2O3(d)的SEM照片Fig.7 SEM images of AACH dried by anhydrous ethanol replacement water(a),AACH dried by freezing(b),pyrolysis product Al2O3 of AACH dried by anhydrous ethanol replacement water at 1 025 ℃(c),and pyrolysis product Al2O3 of AACH dried by freezing at 1 025 ℃(d)
从图7可以看出,与采用冷冻干燥相比,采用无水乙醇置换水干燥的AACH粒子和热解产物Al2O3粉体团聚更弱,粒子间的孔隙更大。这是因为,一方面,无水乙醇可以置换脱除自由水;另一方面,无水乙醇官能团取代 AACH 粒子表面部分非架桥羟基,从而起到一定的空间位阻作用,降低相邻粒子间通过非架桥羟基脱水结合形成化学键的可能性,故只要保证无水乙醇与AACH 粒子充分接触,使自由水被充分置换脱除,并且AACH 粒子表面的非架桥羟基被无水乙醇官能团充分取代,就能有效减弱团聚。而冷冻干燥是指将浆料中的水冻成冰,水转变为冰后体积膨胀,使相邻粒子分开,然后冰直接升华成气体,由于不存在水的表面张力而引起粒子间相互作用,从而减弱粒子间团聚;但是冷冻干燥时真空度不够低,冰的升华速率过慢,则温度上升,冰融化成水,因水的表面张力引起粒子间相互靠近,从而使得冷冻干燥减弱团聚的作用被削弱。
2.3.3 干燥方式对热解产物Al2O3比表面积的影响(图8)

图8 干燥方式对热解产物Al2O3比表面积的影响Fig.8 Effect of drying method on specific surface area of pyrolysis product Al2O3
从图8可以看出,随着热解温度的升高,2种干燥方式得到的热解产物Al2O3的比表面积均逐渐减小,这是因为,热解温度升高时,粒子间发生键合和重排,粒子间接触增多,并且由点接触逐渐扩大为面接触,使得Al2O3粉体的比表面积减小。相同热解温度下,无水乙醇置换水干燥AACH的热解产物Al2O3的比表面积均比冷冻干燥的大,这是因为,与冷冻干燥AACH 相比,无水乙醇置换水干燥AACH团聚更弱,从而导致热解产物Al2O3团聚更弱,比表面积更大。结合2种干燥方式下热解产物Al2O3的微观形貌分析,选择无水乙醇置换水干燥AACH,在1 025 ℃下热解产物Al2O3的比表面积为122.65 m2·g-1。
2.4 NH4HCO3与NH4Al(SO4)2物质的量比对前驱体AACH和热解产物Al2O3的影响
基于NH4HCO3和NH4Al(SO4)2反应生成AACH 的原理,NH4HCO3与NH4Al(SO4)2物质的量比应该大于4∶1,故研究NH4HCO3与NH4Al(SO4)2物质的量比4.5∶1、6∶1、8∶1、10∶1、15∶1对前驱体AACH和热解产物Al2O3物相组成、微观形貌、比表面积的影响。
2.4.1 对物相组成的影响
NH4HCO3与NH4Al(SO4)2不同物质的量比下前驱体AACH和热解产物Al2O3的XRD图谱如图9所示。
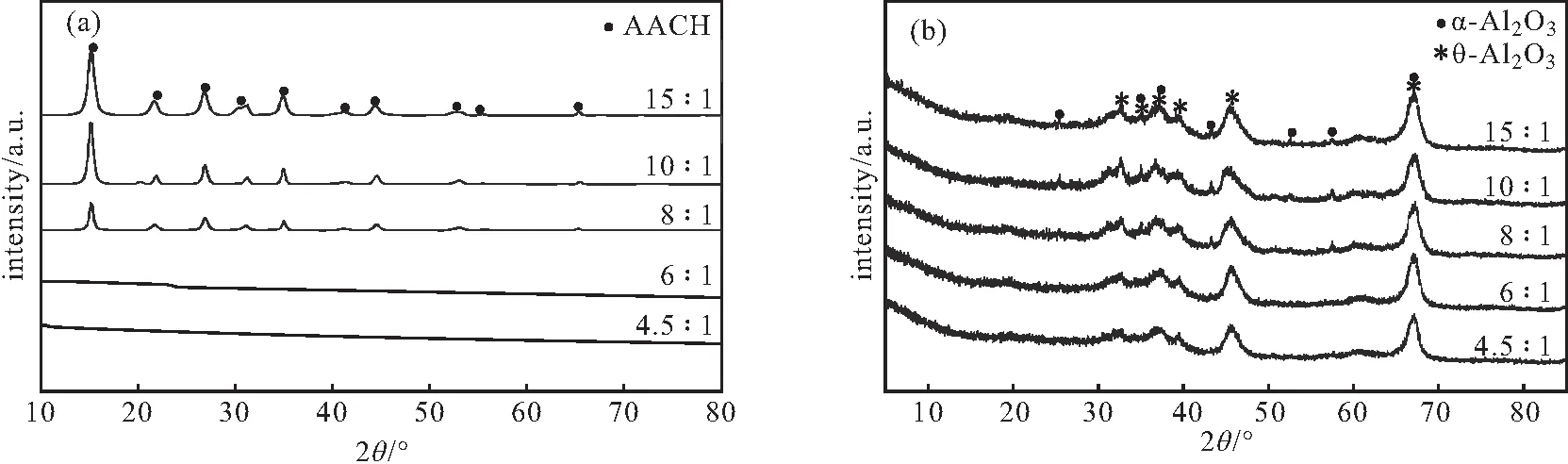
图9 NH4HCO3与NH4Al(SO4)2不同物质的量比下前驱体AACH(a)和1 025 ℃热解产物Al2O3(b)的XRD图谱Fig.9 XRD patterns of precursor AACH(a) and pyrolysis product Al2O3(b) at 1 025 ℃ under different molar ratios of NH4HCO3to NH4Al(SO4)2
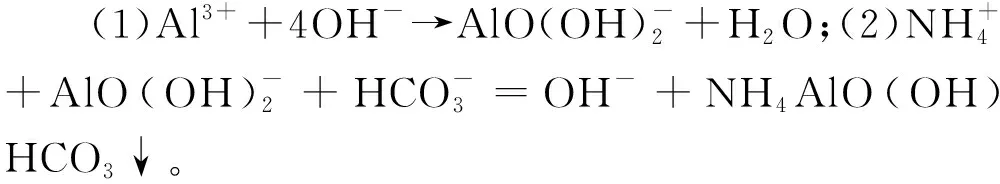
从图9b可以看出,当NH4HCO3与NH4Al(SO4)2物质的量比为4.5∶1、6∶1时,热解产物无α-Al2O3衍射峰出现。当NH4HCO3与NH4Al(SO4)2物质的量比为8∶1、10∶1、15∶1 时,出现较弱的α-Al2O3衍射峰,其中物质的量比为8∶1时,α-Al2O3衍射峰强度最弱;物质的量比为10∶1、15∶1 时,α-Al2O3衍射峰强度相差不大。这是因为,当物质的量比小于10∶1时,AACH 的结晶度减弱较明显,AACH中可能掺入了少量的勃姆石,使得1 025 ℃热解产物的α- Al2O3衍射峰强度减弱。
2.4.2 对微观形貌的影响
NH4HCO3与NH4Al(SO4)2不同物质的量比下前驱体AACH的SEM照片如图10所示。

a~e,NH4HCO3与NH4Al(SO4)2物质的量比:
从图10可以看出,随着NH4HCO3与NH4Al(SO4)2物质的量比的减小,AACH粉体粒径无太大变化,但AACH 粒子间接触逐渐紧密,说明其分散性逐渐减弱,粉体更易团聚。这是因为,NH4HCO3与NH4Al(SO4)2物质的量比减小时,AACH 中易生成勃姆石,勃姆石表面存在大量羟基,干燥过程中容易发生不同粒子间非架桥羟基转变为架桥羟基,导致粉体发生团聚。
NH4HCO3与NH4Al(SO4)2不同物质的量比下热解产物Al2O3的SEM照片如图11所示。

a~e,NH4HCO3与NH4Al(SO4)2物质的量比:

2.4.3 对比表面积的影响
NH4HCO3与NH4Al(SO4)2不同物质的量比下前驱体AACH和热解产物Al2O3的比表面积如图12所示。

图12 NH4HCO3与NH4Al(SO4)2不同物质的量比下前驱体AACH和热解产物Al2O3的比表面积Fig.12 Specific surface areas of precursor AACH and pyrolysis product Al2O3 under different molar ratios of NH4HCO3to NH4Al(SO4)2
从图12可以看出,随着NH4HCO3与NH4Al(SO4)2物质的量比的减小,前驱体AACH的比表面积先逐渐减小后略微增大,而1 025 ℃热解产物Al2O3的比表面积逐渐减小。当NH4HCO3与NH4Al(SO4)2物质的量比从15∶1减至6∶1时,AACH的比表面积从195.65 m2·g-1减至70.23 m2·g-1;物质的量比继续减至4.5∶1时,AACH的比表面积略微上升,为94.95 m2·g-1,但总体趋势仍是减小。当物质的量比从15∶1减至4.5∶1时,Al2O3的比表面积从122.65 m2·g-1降至54.46 m2·g-1。这是因为,NH4HCO3与NH4Al(SO4)2物质的量比减小时,易于生成勃姆石,使得AACH和Al2O3易于团聚,导致其比表面积减小。当NH4HCO3与NH4Al(SO4)2物质的量比为10∶1时,AACH和Al2O3的比表面积均较大,综合考虑反应底物的利用率、AACH的结晶度、α-Al2O3的活性等因素,选择NH4HCO3与NH4Al(SO4)2物质的量比为10∶1。
2.5 TiO2掺杂量对氧化铝陶瓷的影响
TiO2掺杂量(0.2%、0.4%、2.0%)对氧化铝陶瓷相对密度和体积电阻率的影响如图13所示。

图13 TiO2掺杂量对氧化铝陶瓷相对密度和体积电阻率的影响Fig.13 Effect of TiO2 doping amount on relative density and volume resistivity of alumina ceramics
从图13可以看出,TiO2掺杂量分别0.2%、0.4%、2.0%时,氧化铝陶瓷的相对密度变化不大,均在97%以上,较为致密;氧化铝陶瓷的体积电阻率分别为7.81×1011Ω·cm、2.24×1011Ω·cm、3.47×109Ω·cm,说明可以通过控制TiO2掺杂量来调节氧化铝陶瓷的体积电阻率,改变其电性能。氧化铝粉体中掺入少量TiO2在还原气氛下烧结,TiO2晶体中的氧浓度大于还原气氛中的氧浓度,造成晶格中氧的脱离,晶体中出现氧空位,造成载流子浓度增大,从而导致氧化铝陶瓷的体积电阻率降低,其电性能改变。
3 结论
在NH4HCO3与NH4Al(SO4)2物质的量比为 10∶1、无水乙醇置换水干燥AACH、热解温度为1 025 ℃的条件下,可以得到粒径约50 nm、比表面积93.23 m2·g-1、分散性较好的纳米氧化铝粉体。当纳米氧化铝粉体中掺入2.0%TiO2时,在含8%H2的N2气氛下1 550 ℃烧结2 h,可以得到相对密度97.40%、体积电阻率3.47×109Ω·cm的氧化铝陶瓷。

