HPLC法测定银黄甘颗粒中甘草有效成分甘草酸的含量*
刘宗新,郑雪媚,黄钦耿,蒋顺进
(1 广东容大生物股份有限公司,广东 清远 511500;2 清远一生自然生物研究院有限公司,广东 清远 511500)
猪感冒是一种猪类的急性呼吸道器官的疾病,一年四季都可发生,多发于气候多变的早春和深秋,仔猪、小猪更容易发生。猪感冒等呼吸道疾病对现代养猪业的发展有较大影响。目前,猪感冒尚无特效药物,临床上主要采用抗菌药物。长期使用和滥用抗生素,易致使病原微生物发生变异,产生耐药性,给后期疾病的防控带来困难,导致一些疾病药物无法治愈,甚至产生“超级细菌”。银黄甘颗粒由金银花提取物、黄芩提取物和甘草浸膏组方而成。方中金银花为君药,能疏散风热、清热解毒;黄芩为臣药,能增强金银花清热解毒之功效;甘草为佐使药,能助金银花、黄芩清热解毒,又能祛痰止咳。黄芩过于苦寒,苦寒伤胃,而甘草具有甘缓护胃功效。三药合用,共奏清热、解毒、止咳之功效,主治猪外感发热、咳嗽。现代药理研究表明,甘草含有甘草酸、甘草次酸等主要活性成分,具有镇咳祛痰[1-2]、解毒[3-4]、抗炎[5-6]、抗支原体[7]、免疫功能调节[8]等药理作用。
按照中国兽药典要求[9],根据甘草酸的结构特点,建立测定银黄甘颗粒中甘草酸含量的HPLC法。该方法具有定量检测准确度高、线性范围广、重现性好、分析时间短、样品处理简单等特点,为银黄甘颗粒的质量控制提供可靠的依据。
1 实 验
1.1 仪器和材料
SPD-20A液相色谱仪,日本岛津;柱温箱CTO-20AC;UPR-5T超纯水仪;KQ-500DE超声波清洗器;METTLER MS105DU天平;甘草酸铵对照品(纯度93.1%,每1 mL含甘草酸铵0.2 mg,折合甘草酸为0.195 9 mg),中国食品药品检定研究院;银黄甘颗粒(水分为1.8%),广东容大生物股份有限公司;水为超纯水,甲醇为色谱纯,磷酸为AR级别。
1.2 色谱条件
流动相:A相:乙腈;B相:0.05%磷酸溶液;按照表1进行梯度洗脱。

表1 流动相梯度Table 1 Mobile phase gradient
色谱柱:菲罗门 C185 μm,4.6 mm×250 mm;
检测波长:237 nm;
流速:1.0 mL/min;
柱温:35 ℃;
进样量:10 μL。
1.3 溶液的配制
1.3.1 对照品溶液的制备
精密称取甘草酸铵对照品20 mg,置100 mL容量瓶,加70%乙醇溶解,摇匀,过滤,即得。
1.3.2 供试品溶液的制备
取本品适量,研细,取约3.5 g,精密称定,置具塞锥形瓶中,精密加入70%乙醇50 mL,称定重量,超声处理30 min,取出,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
1.4 阴性干扰测定
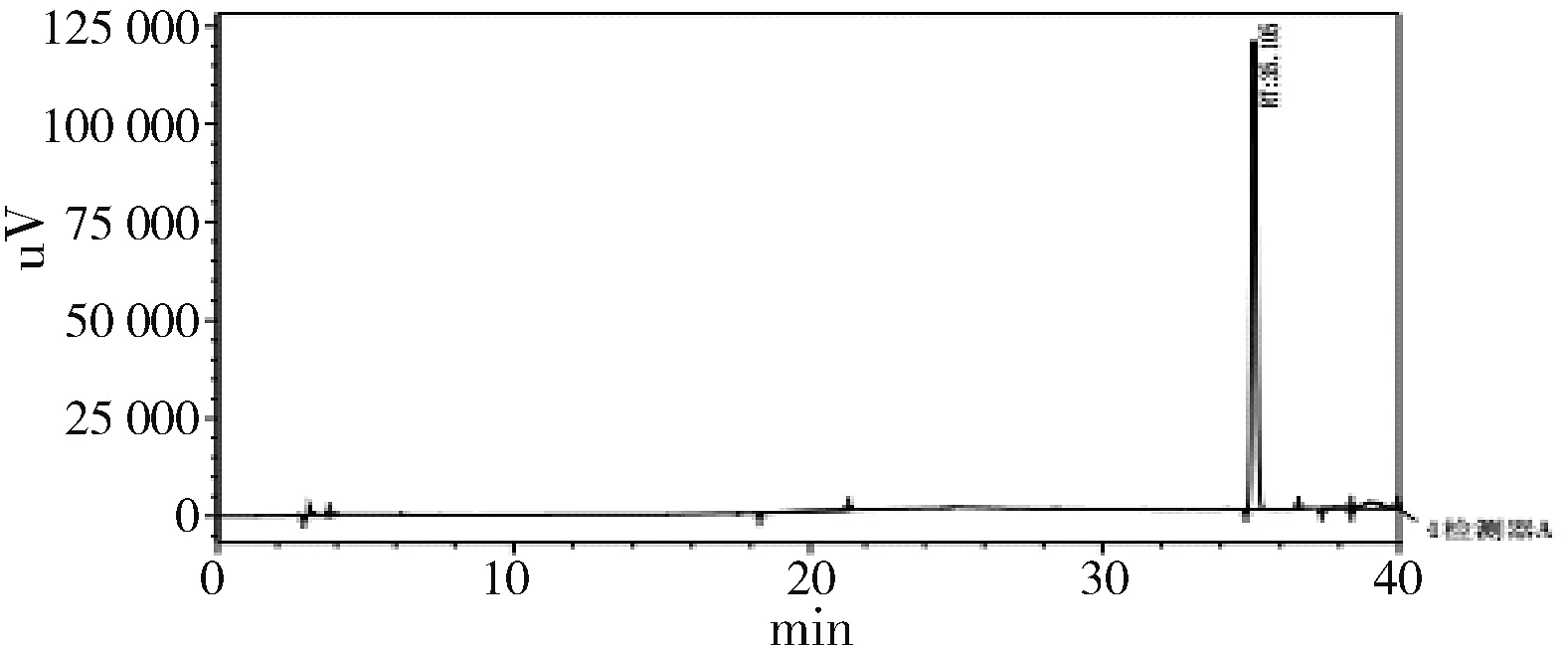
图1 甘草酸对照Fig.1 Glycyrrhizin control

图2 甘草浸膏阴性样品Fig.2 Liquorice extract negative sample

图3 银黄甘颗粒样品Fig.3 Yinhuanggan particle sample
以相同的处方比例,按照银黄甘颗粒的制备工艺,制得甘草浸膏阴性制剂。取甘草浸膏阴性颗粒适量,按1.3.2项下制成甘草提取物阴性颗粒溶液。进样测试。结果阴性溶液无干扰。证明本方法用于甘草酸的含量测定具有专属性。
1.5 标准曲线的制备
精密称取甘草酸铵对照品54.8 mg,置50 mL量瓶中,加70%乙醇使溶解至刻度,摇匀,作为对照品贮备液;精密吸取对照品贮备液0.5、1.0、1.5、2.0、2.5、5 mL,分别置10 mL量瓶中,加70%乙醇至刻度,摇匀,作为对照品溶液。精密吸取上述溶液10 μL进样测定,记录峰面积。测定结果见表2。

表2 甘草酸标准品溶液的浓度及其峰面积Table 2 Concentration and peak area of glycyrrhizic acid standard solution

图4 甘草酸的线性曲线图Fig.4 Linear graph of glycyrrhizic acid
以甘草酸浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果见图4。计算回归方程为y=9 584x-20 215,R2=0.999 9。结果表明,在此色谱条件下,甘草酸在49.97~499.73 μg/mL范围内,甘草酸浓度与峰面积线性关系良好。
1.6 精密度试验
精密称取甘草酸铵对照品21.7 mg,按1.3.1项下制成每1 mL含197.89 μg甘草酸溶液。连续进样6次,记录色谱图。结果见表3。

表3 甘草酸精密度试验Table 3 Glycyrrhizin precision test
结果表明,甘草酸峰面积RSD值为0.3%,证明本测定方法的精密度良好。
1.7 重复性试验
1.7.1 对照品溶液的制备
精密称定甘草酸铵对照品18.5 mg,按1.3.1项下制成每1 mL含168.70 μg甘草酸溶液。
1.7.2 供试品溶液的制备

表4 甘草酸含量测定重复性试验Table 4 Repeatability test for determination of glycyrrhizic acid content
取银黄甘颗粒适量,研细,按1.3.2项下制备供试品溶液,平行处理6份,进样测定,记录峰面积,计算甘草酸含量。结果见表4。
结果表明,甘草酸含量RSD为0.7%,证明本测定方法的重复性良好。
1.8 回收率试验
1.8.1 对照品母液配制
精密称取甘草酸铵对照品52.4 mg,置50 mL量瓶中,加70%乙醇至刻度,作为甘草酸对照品母液。
1.8.2 对照品溶液配制
精密量取5 mL对照品母液至25 mL量瓶中,加70%乙醇至刻度,摇匀,过滤,即得。
取银黄甘颗粒适量,研细,取约1.75 g,精密称定,共计6份,分别置具塞锥形瓶中,精密加入70%乙醇45 mL,精密加入甘草酸铵对照品母液5 mL,称定重量,超声处理30 min,取出,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液作为供试品溶液。按甘草酸含量测定项下方法操作,记录峰面积,计算甘草酸含量。结果见表5。
结果表明,甘草酸回收率的平均值为100.3%,RSD为0.8%,本方法回收率较好。

表5 甘草酸含量测定回收率试验Table 5 Glycyrrhizic acid content determination recovery test
1.9 稳定性试验
取银黄甘颗粒供试品溶液,在室温条件下放置,分别在0、2、4、6、8、12、24 h,进样测定,记录峰面积,结果见表6。

表6 甘草酸含量测定稳定性试验Table 6 Stability test for determination of glycyrrhizic acid content
结果显示,不同时间点甘草酸峰面积RSD为0.4%,表明本品供试品溶液在室温下放置24 h稳定。
1.10 甘草酸测定方法的耐用性研究
本试验考察色谱柱温度、流动相流速、流动相比例和波长的微小变化及不同品牌色谱柱对银黄甘颗粒中甘草酸含量的影响。
1.10.1 不同的色谱柱温度
(1)对照品溶液的制备:精密称定甘草酸铵对照品18.4 mg,按1.3.1项下制成每1 mL含167.79 μg甘草酸对照溶液。
(2)供试品溶液的制备:取银黄甘颗粒,按1.3.2项下制备银黄甘颗粒供试品溶液。
在其它色谱条件不变的情况下,色谱柱温度分别设定为25、30、35 ℃,对同一样品进行含量测定,记录峰面积,计算甘草酸含量,结果如表7所示。
结果表明,柱温的微小变化对甘草酸含量无明显影响。

表7 色谱柱温度对甘草酸含量测定的影响Table 7 Influence of column temperature on determination of glycyrrhizic acid content
1.10.2 不同的流速
(1)对照品溶液的制备:精密称定甘草酸铵对照品19.6 mg,按1.3.1项下制成每1 mL含178.74 μg甘草酸对照溶液。
(2)供试品溶液的制备:取银黄甘颗粒,按1.3.2项下制备银黄甘颗粒供试品溶液。
在其它色谱条件不变的情况下,流动相流速分别设定为0.8、1.0、1.2 mL/min,对同一样品进行含量测定,记录峰面积,计算甘草酸含量,结果如表8所示。
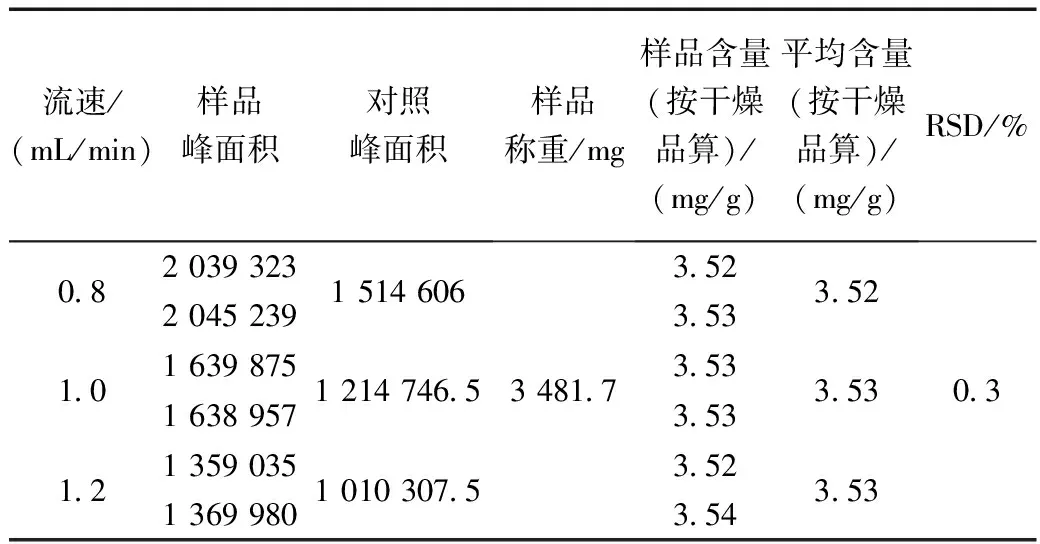
表8 流动相速度对甘草酸含量测定的影响Table 8 Effect of mobile phase velocity on determination of glycyrrhizic acid content
结果表明,流动相速度的微小变化对甘草酸含量无明显影响。
1.10.3 不同的流动相比例
(1)对照品溶液的制备:取甘草酸铵对照品19.6 mg,按1.3.1项下制成每1 mL含178.74 μg甘草酸对照溶液。
(2)供试品溶液的制备:取银黄甘颗粒,按1.3.2项下制备银黄甘颗粒供试品溶液。
在其它色谱条件不变的情况下,分别以原流动相比例、表9、表10改变流动相比例,对同一样品进行含量测定,记录峰面积,计算甘草酸含量,结果如表9~表11所示。

表9 甘草测试流动相向左平移-5%(有机相减小)Table 9 Liquorice test mobile phase shift to the left -5% (organic phase reduction)
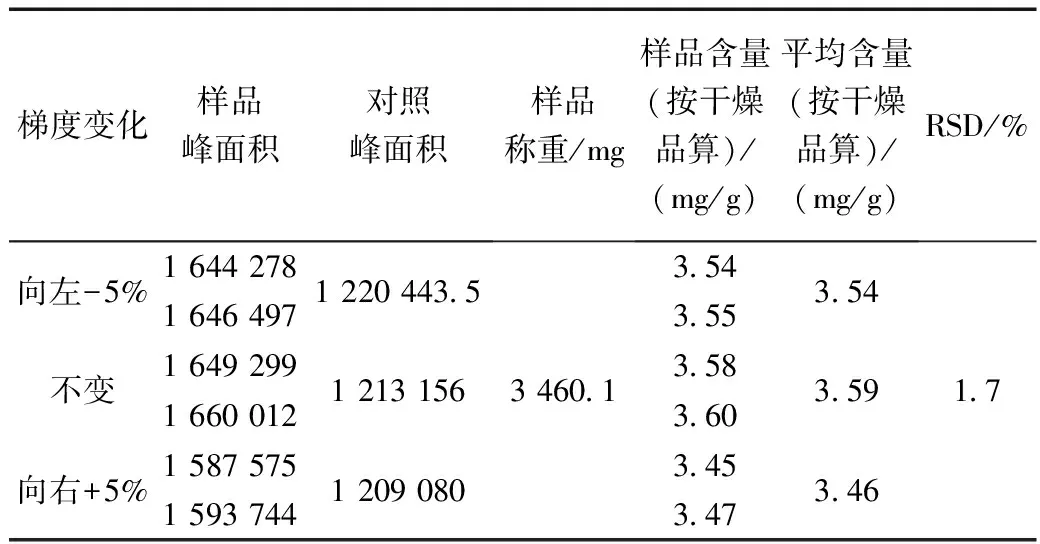
表11 不同色谱流动相比例对甘草酸含量测定的影响Table 11 Influence of different proportion of mobile phase on determination of glycyrrhizic acid
以乙腈为流动相A,0.05%磷酸溶液为流动相B;分别按照原组成及下表进行梯度洗脱。
结果表明,流动相比例的微小变化对甘草酸含量无明显影响。
1.10.4 不同品牌的色谱柱
(1)对照品溶液的制备:取甘草酸铵对照品19.4 mg,精密称定,按1.3.1项下制成每1 mL含176.91 μg甘草酸对照溶液。
(2)供试品溶液的制备:取银黄甘颗粒,按1.3.2项下制备银黄甘颗粒供试品溶液。
在其它色谱条件不变的情况下,分别以WR、superb、Boston色谱柱,对同一样品进行含量测定,记录峰面积,计算甘草酸含量,结果如表12所示。

表12 不同色谱柱对甘草酸含量测定的影响Table 12 Influence of different chromatographic columns on determination of glycyrrhizic acid content
结果表明,不同品牌色谱柱对甘草酸含量无明显影响。
1.10.5 不同的测定波长
(1)对照品溶液的制备:取甘草酸铵对照品19.4 mg,按1.3.1项下制成每1 mL含176.91 μg甘草酸对照溶液。
(2)供试品溶液的制备:取银黄甘颗粒,按1.3.2项下制备银黄甘颗粒供试品溶液。
在其它色谱条件不变的情况下,测定波长分别设定为234、235、236、237、238、239 nm,对同一样品进行含量测定,记录峰面积,计算甘草酸含量,结果如表13所示。

表13 测定波长对甘草酸含量测定的影响Table 13 Influence of wavelength on determination of glycyrrhizin content
结果表明,测定波长的微小变化对甘草酸含量无明显影响。
2 结 论
采用本方法能准确测定银黄甘颗粒中甘草酸含量,方法耐用性良好。本实验建立了HPLC法测银黄甘颗粒中甘草有效成分甘草酸的含量。测定色谱条件为:以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,0.05%磷酸溶液为流动相B;按照梯度洗脱,流速为1.0 mL/min,检测波长为237 nm。该方法定量检测准确度高、线性范围广、重现性好、分析时间短、样品处理简单,为银黄甘颗粒质量控制提供了依据。

