超声法与闪式提取法提取刺五加中绿原酸的工艺对比研究
■ 关 皎 丁思宇 胡子君 季玲玲 王军民 朱鹤云 韩丽琴*
(吉林医药学院药学院,吉林吉林 132013;2.吉林医药学院附属医院,吉林吉林 132013)
刺五加又称五加参、一百针,主要用药部位为干燥根、茎及根茎[1-2]。我国东北和华北以北地区具有适宜刺五加植物的生长环境,是刺五加药材的主要产地,其中黑龙江、吉林、辽宁三省地区的刺五加药材产量较高[3]。刺五加性温、味苦、微甜,益气健脾,补肾安神[4-6],在动物生产中应用刺五加及其提取物可以提高生长性能,促进肠道健康,改善屠宰性能和肉品质[7-8]。
刺五加中含有多种化学成分,主要活性成分为苷类化合物,但也有研究表明,刺五加中苯丙素类化合物,特别是绿原酸的含量较高[9-11]。绿原酸是由奎尼酸的羟基和咖啡因的羧基缩合而成的缩酚酸,是植物细胞通过莽草酸途径合成的一种苯丙素类物质,其含有酯键、不饱和双键、多元酚等分子结构,具有抗菌[12]、抗氧化[13]、抗疲劳[14]、降血压[15]、抗血糖和免疫调节等多种药理活性[16-17],广泛应用于食品、医药和化工等领域[18]。
绿原酸的提取分离方法有水提醇沉法、乙醇回流法、超声法、闪式提取法等[19-21],超声法为提取药材中有效成分的常用方法;闪式提取法是中药提取领域的一项新技术,该方法能充分保留植物的有效成分,受热影响小,操作简便,用时较短,效率高。本研究将超声法和闪式提取法应用于刺五加中绿原酸的提取工艺研究,对比分析两种方法提取绿原酸的效果,优化并选择刺五加中绿原酸的最佳提取工艺,为刺五加药材的开发利用提供参考。
1 仪器与材料
1.1 仪器
高效液相色谱仪(LC-20AT,日本岛津公司);微型万能粉碎机(FW80,永康市久品工贸有限公司);闪式提取器(JHBE-50S,河南金鼐科技发展有限公司);三频恒温数控超声波清洗器(KQ-500GVDV,昆山市超声仪器有限公司)。
1.2 材料
刺五加药材为道地药材(产地:辽宁;鉴定人:吉林医药学院李景华副教授),绿原酸对照品(纯度>99.40%;批号:MUST-220700918;购自成都曼斯特科技有限公司)的化学结构见图1。无水乙醇(天津市大茂化学试剂厂,分析纯);甲醇(美国Fisher 公司,色谱纯);乙腈(美国Fisher 公司,色谱纯);磷酸(沈阳市华东试剂厂,分析纯)。
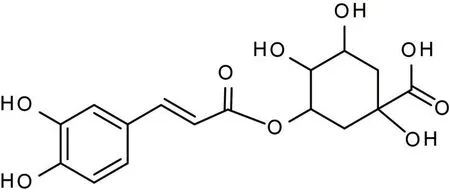
图1 绿原酸的化学结构
2 试验方法
2.1 绿原酸含量测定方法学考察
2.1.1 色谱条件
色谱条件见表1。

表1 色谱条件
2.1.2 对照品溶液的制备
精密称取绿原酸对照品适量,甲醇溶解,配制1.0 mg/mL的对照品储备液。
2.1.3 供试品溶液的制备
精密称取药材粉末1.0 g,加入具塞锥形瓶(容积50 mL)中,加入30 mL 体积比为 50%的乙醇溶液,称重,超声提取45 min(功率200 W),冷却至室温,加入体积比为50%的乙醇溶液补足损失量,过滤。取10 mL续滤液,加于蒸发皿上,水浴蒸干,流动相溶解,转移至10 mL容量瓶中,定容至刻度,微孔滤膜(孔径0.22 μm)过滤,备用。
2.1.4 标准曲线的绘制
精密量取绿原酸对照品储备液适量,配制20、40、100、200、500、1 000 μg/mL系列甲醇溶液,横坐标(X)为浓度,纵坐标(Y)为峰面积,绘制标准曲线并进行线性回归。
2.1.5 精密度试验
取200 μg/mL 刺五加对照品溶液适量,连续进样6次。
2.1.6 稳定性试验
取刺五加样品溶液,放置0、2、4、6、8、12、24 h 后进样分析。
2.1.7 重复性试验
取同一批次刺五加药材,制备样品溶液6 份,计算峰面积的RSD。
2.1.8 回收率试验取刺五加药材适量(已知绿原酸含量),分别加入对照品溶液,计算回收率和峰面积的RSD。
2.2 超声法和闪式提取法的单因素考察
采用不同的因素进行单因素试验,考察分析各因素的不同水平对绿原酸提取率的影响,因素见表2。

表2 主要提取方法、考察的因素及水平、固定因素
2.3 正交设计优选刺五加中的绿原酸的超声提取、闪式提取工艺
2.3.1 超声提取试验方案
选择4 个考察因素(A:乙醇体积分数;B:超声时间;C:料液比;D:超声功率),每个因素设置3 个水平,开展正交试验,各因素水平见表3。
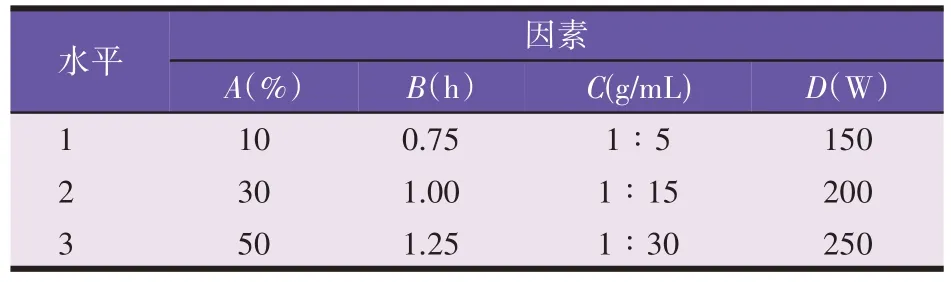
表3 超声法正交试验因素水平
2.3.2 闪式提取试验方案
选择3个考察因素(E:乙醇体积分数;F:料液比;G:闪提时间),开展正交试验,各因素水平见表4。

表4 闪式提取法因素水平
2.4 样品含量测定
取供试品溶液平行测定3 次,计算供试品中绿原酸的含量。
3 结果与分析
3.1 绿原酸含量测定方法学考察结果
绿原酸对照品与刺五加样品色谱图见图2。
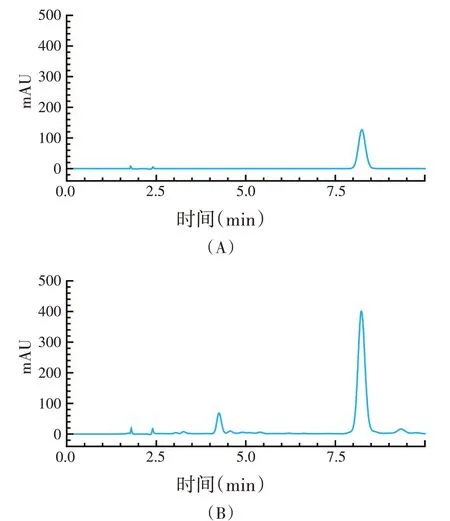
图2 绿原酸对照品(A)和刺五加样品(B)的高效液相色谱图
绿原酸的线性回归方程为Y=3.308×104X+3.582×105(r=0.999 9)。结果表明,绿原酸在20~1 000 μg/mL浓度范围内线性关系良好。精密度试验结果显示峰面积的RSD=1.7%,表明HPLC 精密度符合要求。稳定性试验结果显示不同时刻测定的峰面积的RSD 值为1.5%,即样品在24 h 稳定性良好,符合要求。重复性试验结果峰面积的RSD=2.2%,即方法的重复性良好,符合要求。平均回收率为98.7%(RSD=1.1%),即方法回收率较好,符合要求。
3.2 超声法和闪式提取法的单因素考察结果与分析
3.2.1 超声法单因素考察结果
由图3 可知,乙醇体积分数增加绿原酸的提取率增大,乙醇体积分数为30% 时提取率最高,超声时间增加绿原酸的提取率升高,60 min 后趋于稳定,故1 h为最佳超声时间。绿原酸的提取率随溶剂体积的增加而减小,当料液比为1∶5(g/mL)时绿原酸的提取率达到最大值,超声功率提高,绿原酸的提取率增大。根据单因素试验结果选择30%乙醇、料液比为1∶5,250 W功率,提取60 min。
3.2.2 闪式提取法的单因素考察结果
闪式提取绿原酸单因素试验结果见图4。乙醇体积分数增加绿原酸的提取率增大,乙醇体积分数70%时提取率最高,故选择70%乙醇为最佳提取溶剂浓度。提取时间增长,绿原酸的提取率反而降低。当提取时间为1 min时绿原酸的提取率达到最大值,因此,适宜的提取时间为1 min。绿原酸的提取率随溶剂体积的增大而减小,当料液为1∶30(g/mL)时绿原酸的提取率达到最大值,因此,提取的适宜料液比为1∶30(g/mL)。
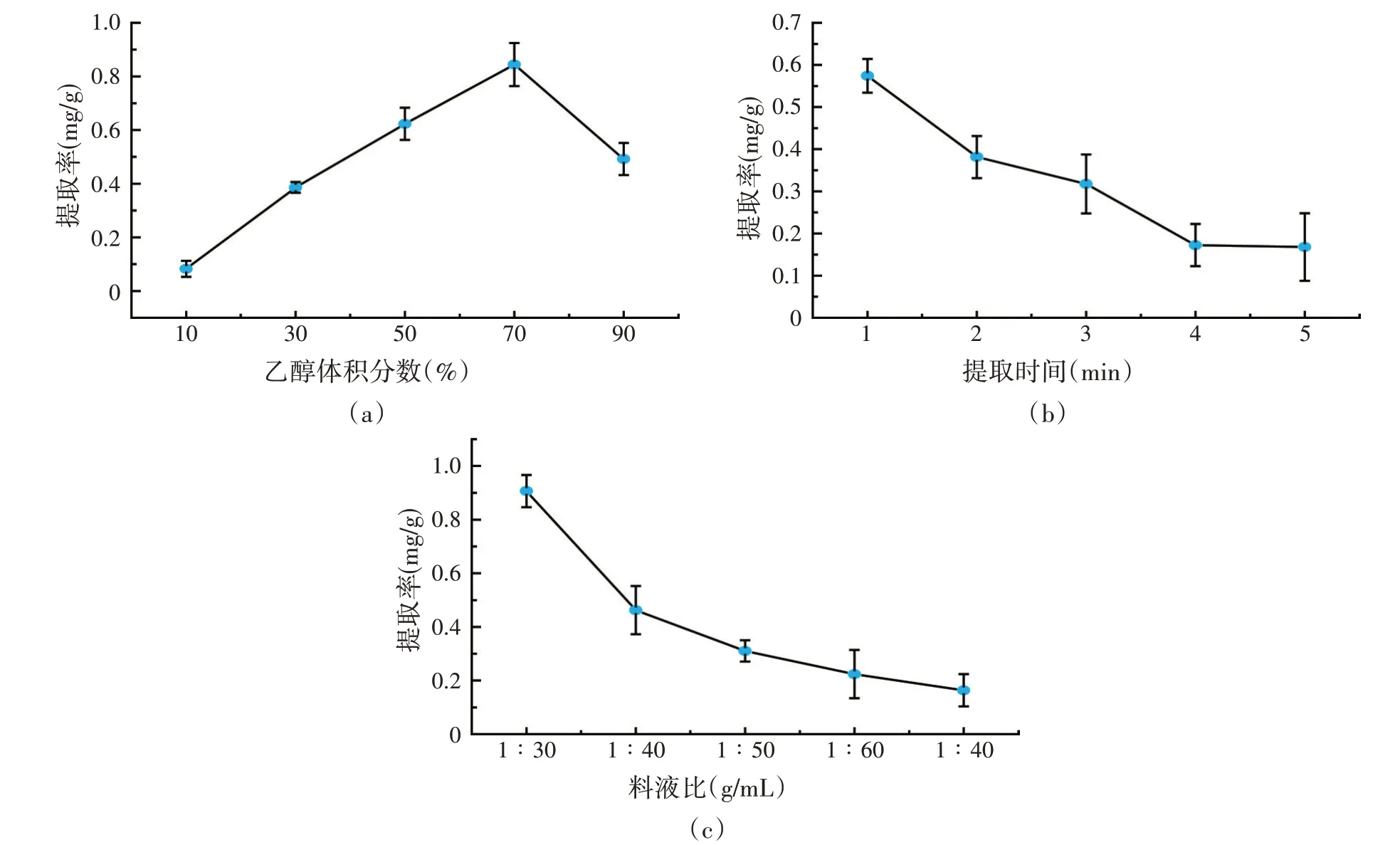
图4 闪式提取法的单因素试验结果
3.3 正交设计优选刺五加中的绿原酸的提取工艺 结果
3.3.1 超声法的正交试验和方差分析结果
由表5、表6 结果可知,超声法中各因素不会显著影响提取工艺,各因素对绿原酸提取率的影响顺序为C>A>D>B。筛选得到的超声法最佳工艺为A3B2C1D3,即50%乙醇,提取1 h,料液比1∶5(g/mL),功率250 W,与正式试验方案8一致,无须验证。

表5 超声法正交试验结果
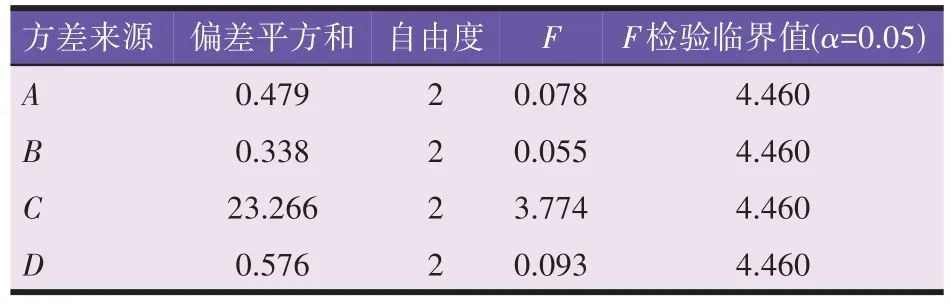
表6 超声法方差分析结果
3.3.2 闪式提取法正交试验和方差分析结果
由表7、表8 结果可知,各因素对提取效率没有显著影响,因素影响顺序为G>E>F。从而确定超声法最佳工艺为E2F1G1,即70%乙醇,料液比1∶30(g/mL),提取1 min。供试品验证得绿原酸平均提取率为1.008 mg/g,高于正交试验的最高提取率0.964 mg/g。
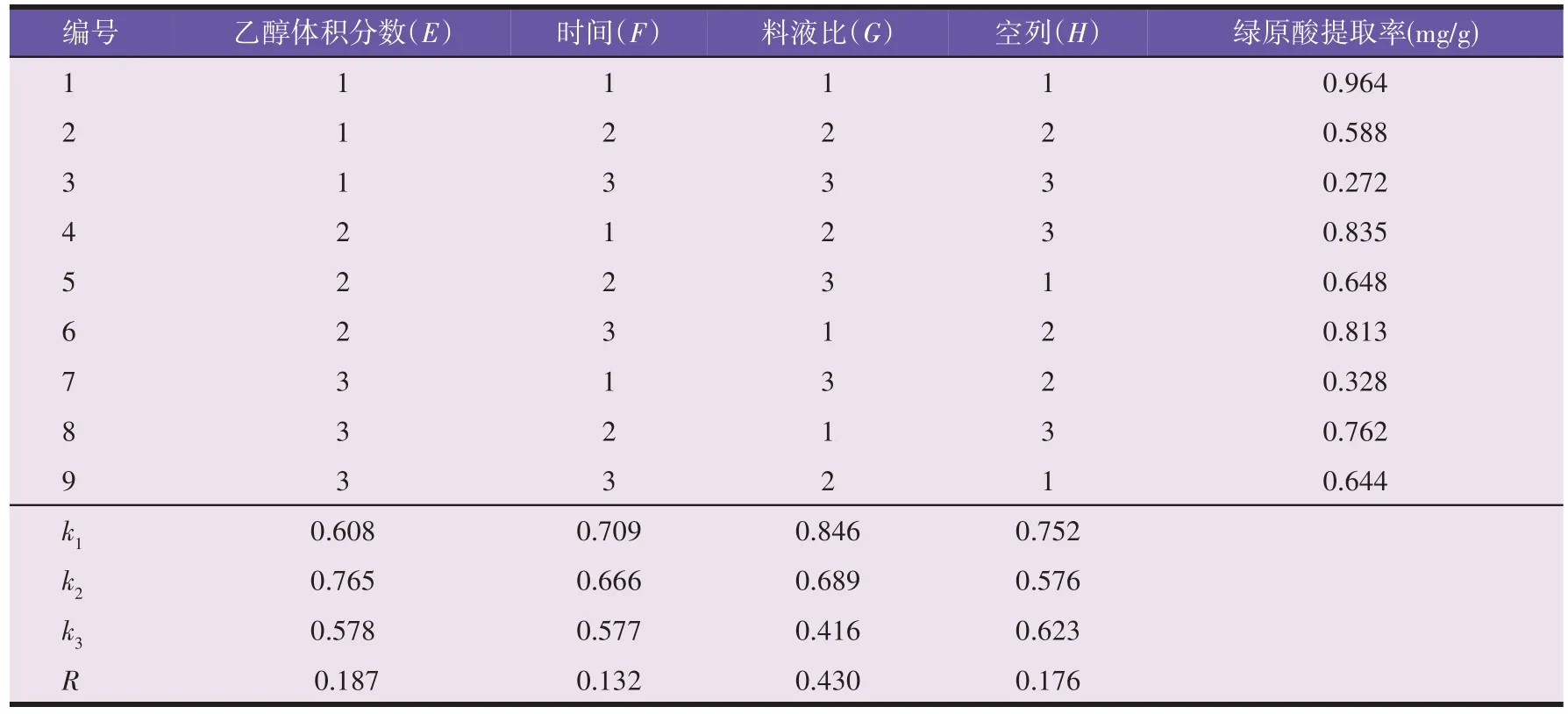
表7 闪式提取法正交试验结果
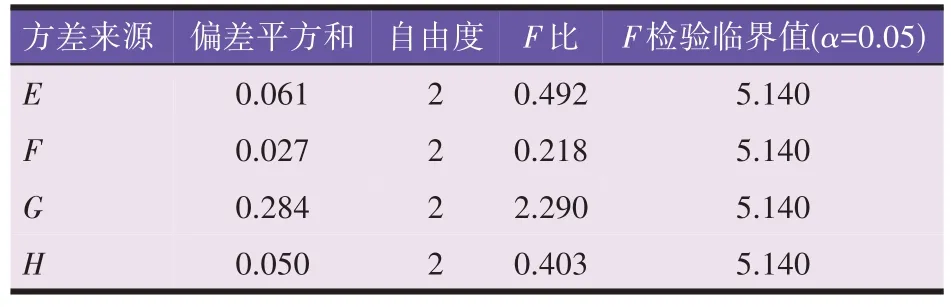
表8 闪式提取法方差分析结果
3.4 超声法与闪式提取法比较
由表9 可知超声法与闪式提取法提取绿原酸的最佳工艺对比。超声法提取绿原酸的提取率是闪式提取法的5倍,更适合于刺五加中绿原酸的提取。
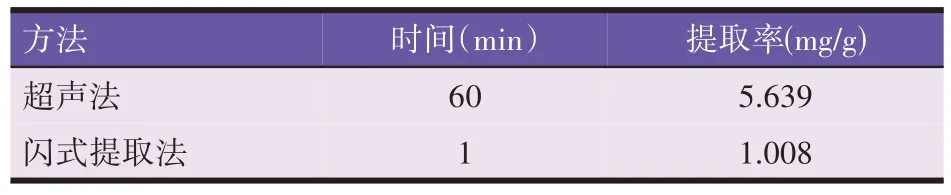
表9 不同方法提取绿原酸的提取率
4 讨论
超声提取法主要原理为超声波振动产生空化、粉碎等作用,破坏植物细胞壁,能够加速中草药多糖成分溶于溶剂中[22],广泛应用于黄酮、有机酸、多糖等成分的提取。闪式提取法最早应用是为实现生物组织的破碎,它通过高效机械剪切力和超快速分子渗滤技术,在室温条件下将组织物料破碎至细微颗粒,使有效成分与溶剂接触,达到提取的目的,具有效率高、能耗低等显著特点[23-24]。与传统的提取方式相比,超声和闪式提取均具有提取时间短的优势,在提取刺五加药材的绿原酸过程中,从提取效率因素看,超声法明显高于闪式提取法,但如果考虑时间和能耗,则可选择闪式提取。
5 结论
采用超声法和闪式提取法提取刺五加中绿原酸均获得较好效果,通过单因素试验和正交试验结果可知,优化后的闪式提取法最佳工艺:70%乙醇,1∶30料液比,提取1 min,获得1.008 mg/g 的提取率。优化后超声法最佳工艺则为50%乙醇,提取时间60 min,料液比1∶5,功率250 W,获得5.639 mg/g 的提取率,明显高于闪式提取法。

