外源性H2S对血管性痴呆大鼠缺血再灌注后神经元线粒体损伤及其相关信号通路的影响
刘雨霞 肖子宇 郑菊 张文萍 齐晓岚 吴昌学 李毅 官志忠 肖雁
(地方病与少数民族疾病教育部重点实验室 贵州医科大学,贵州 贵阳 550004)
血管性痴呆(VaD)是指各种脑血管疾病引起脑功能障碍而造成的后天性智能障碍综合征,其作为最常见的老年期痴呆之一,患病人数占所有老年痴呆人数的15%〔1〕,属于血管性认知障碍(VCI)的一类,发病后严重影响患者生活质量〔2,3〕。高血压、动脉硬化、冠心病和糖尿病等多种疾病均可引起脑血管不同程度的狭窄、闭塞等病理改变,使海马等参与认知功能的重要部位处于缺血缺氧低灌注状态,导致VaD的发生〔4〕。线粒体是胞内能量产生的场所,常被称为“细胞的动力工厂”,是缺血再灌注所致神经元损伤的靶点。在VaD大鼠海马中观察到神经元线粒体损伤,推测线粒体损伤与缺血再灌注后学习记忆功能障碍有关〔5〕。硫化氢(H2S)可以通过减少神经细胞凋亡而起到脑保护作用,在缺血再灌注损伤中的作用受到关注〔6,7〕。本课题组前期用H2S供体硫氢化钠(NaSH)处理VaD模型大鼠,发现外源性H2S可以通过减轻神经元细胞凋亡改善VaD大鼠的学习认知能力及病理变化〔8〕。本研究利用改良二血管法(2-VO)结扎SD大鼠双侧颈总动脉制作VaD模型,使用NaSH作为H2S供体,探讨外源性H2S对VaD大鼠海马神经元线粒体功能与线粒体自噬及其相关信号通路的影响。
1 材料与方法
1.1动物 成年健康雄性SD大鼠,体质量220~250 g,购自贵州医科大学动物实验中心,合同号:SCKY(黔)2018-0001。所有实验操作获得贵州医科大学动物伦理委员会的许可。
1.2主要试剂及抗体 Tris、甘氨酸、氯化钠(NaCl)、十二烷基硫酸钠(SDS)、Tween-20、苯甲基磺酰氟(PMSF)、脱脂奶粉均购自北京Solarbio有限公司,二甲亚砜(DMSO)、NaSH均购自美国Sigma公司;DMEM/F12(1∶1)完全培养基、无糖DMEM、澳洲胎牛血清均购自美国Gibco公司;0.25%胰酶消化液、双抗、二喹啉甲酸(BCA)蛋白定量试剂、电化学发光(ECL)-Plus液购于美国Thermo Fisher Scientific公司;组织线粒体分离试剂盒、SDS-聚丙烯酰胺凝胶电泳(PAGE)快速凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、一抗稀释液、二抗稀释液、一抗二抗去除液均购于碧云天生物技术公司;预染Marker购自爱必信生物有限公司,聚偏氟乙烯(PVDF)膜购于美国Millipore公司。抗体:Beclin1 抗体(ab217179)、SQSTM1/P62抗体(ab91526)均购自美国Abcam公司;COX Ⅳ(#4850)、哺乳动物雷帕霉素靶蛋白(mTOR,#2983)、P-mTOR(#5536)、蛋白激酶B(Akt,#4691)、P-Akt(#4060)、辣根过氧化物酶(HRP)标记的抗兔二抗(#7074)均购自美国CST公司;Anti-beta actin(abs830031)购于上海爱必信公司。
1.3动物筛选及分组 雄性SD大鼠210只。保持室温25 ℃,清洁环境下以纯净水、标准饲料适应性喂养30 d后进行Morris水迷宫实验,检测其学习记忆能力,1~4 d对大鼠的定航能力及学习能力进行检测:按照相同顺序分别将四个象限中点作为大鼠入水点,使其面向池壁放入水中,进行自由探索,若60 s内找到平台即结束实验,若未找到则引导其站至平台上并停留10 s结束实验。第5天检测其学习记忆能力:开始撤除平台,仍将各象限中点作为其入水点,使其自由探索,并记录其在60 s内第一次游经平台原位置所需时间(即逃避潜伏期)及60 s内大鼠穿越平台目标区域次数、目标象限内停留时间。选取时间、记忆力相近的SD大鼠180只,按缺血进程的急性缺血期、缺血损伤期、损伤恢复期,利用随机数字表法随机分为1、7、30 d 3个时间段,每个时间段各设置假手术(Sham)组、模型(VaD)组、阳性对照〔尼莫地平(Nimodipine)〕组、NaSH低剂量(Low-NaSH)组、NaSH高剂量(High-NaSH)组,每组12只。
1.4VaD大鼠模型制备 大鼠术前10 h禁食禁水。按照0.3 ml/100 g体质量的剂量经腹腔注射10%水合氯醛进行麻醉后仰卧位固定,颈部备皮,碘伏,75%酒精常规消毒,颈前正中线切口,分离暴露双侧颈总动脉,Sham组仅进行分离操作不进行结扎,其他各组均使用手术线永久结扎双侧颈总动脉,伤口喷洒使用青霉素粉预防伤口感染,缝合皮肤并作常规消毒。常规饮食清洁饲养。
1.5SD大鼠给药 为保持药物处理时间一致,1、7 d各组术前灌胃给药30 d,30 d各组术后灌胃给药30 d,Nimodipine组10 mg/(kg·d)Nimodipine灌胃给药、Low-NaSH组及High-NaSH组分别灌胃30、100 μmol/kg NaSH,VaD组和Sham组用等量生理盐水灌胃。
1.6行为学实验 给药结束后利用Morris水迷宫实验对30 d各组学习记忆能力进行检测,方法同1.3。
1.7样本制备 水迷宫测试结束后进行取材。称重后腹腔注射10%水合氯醛(0.45 ml/100 g),麻醉后用1×磷酸盐缓冲液(PBS)心脏灌注取脑,冰上分离海马组织,用组织线粒体分离试剂盒提取海马线粒体,部分于-80 ℃冻存。
1.8Western印迹法检测相关蛋白的表达 BCA蛋白定量法于570 nm波长检测吸光度从而测定胞浆蛋白浓度,以12 μl/20 μg体系每孔上样于12%的SDS-PAGE凝胶,30 mA恒流进行电泳分离,200 mA转膜75 min,一抗孵育(Akt、P-Akt、mTOR、P-mTOR、P62、Beclin1、COXⅣ用一抗稀释液稀释1 000倍,actin用一抗稀释液稀释3 000倍),兔二抗稀释5 000倍进行二抗孵育,化学发光成像仪成像。用ImageJ分析曝光图片中各条带灰度值,计算结果时,以COXⅣ条带灰度值作为内参,计算P62、Beclin1蛋白条带灰度值与COXⅣ条带灰度值的比值表示P62、Beclin1蛋白表达量相对水平;以actin作为参照,计算P-Akt、P-mTOR蛋白条带灰度值与Akt、mTOR条带灰度值的比值表示P-Akt、P-mTOR蛋白表达量相对水平
1.9统计学分析 采用SPSS20软件进行单因素方差分析,两两比较采用LSD检验,检验水准α=0.05。
2 结 果
2.1行为学结果 Sham组逃避潜伏期随时间增加而缩短;VaD组逃避潜伏期较Sham组长且随时间变化不明显;第三天后,Nimodipine、Low-NaSH、High-NaSH组逃避潜伏期较VaD组短,但Low-NaSH组逃避潜伏期比Nimodipine组和High-NaSH组更长。在第五天空间探索实验中,与Sham组比较,VaD组逃避潜伏期延长、穿越平台次数减少、目标区域时间降低,差异有统计学意义(均P<0.01),表明大鼠2-VO术后30 d学习记忆能力及定航能力受到损伤;与VaD组比较,Nimodipine组及NaSH不同剂量组逃避潜伏期降低、穿越平台次数增加、目标区域时间延长,差异有统计学意义(均P<0.01);与Low-NaSH组比较,High-NaSH组逃避潜伏期较短、穿越平台次数较多、目标区域时间较长,差异有统计学意义(均P<0.01)。见表1。
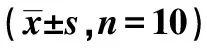
表1 各组Morris水迷宫不同时间逃避潜伏期及Morris水迷宫第五天学习记忆能力比较
2.2各组海马神经元细胞内自噬蛋白Beclin1表达 术后1 d,与Sham组比较,VaD组Beclin1表达显著降低;与VaD组比较,不同剂量NaSH组Beclin1表达显著降低(均P<0.05)。术后7、30 d,与Sham组比较,VaD组Beclin1表达显著升高;与VaD组比较,Nimodipine组及不同剂量NaSH组Beclin1表达显著降低;与Low-NaSH组比较,High-NaSH组Beclin1表达显著降低(P<0.05,P<0.01)。见图1、表2。

1~5:Sham组、VaD组、Nimodipine组、Low-NaSH组、High-NaSH组;下图同图1 Western印迹检测各组Beclin1、P62表达水平
2.3各组海马神经元细胞内自噬蛋白P62表达 术后1 d,各组P62蛋白表达无统计学差异(P>0.05)。术后7 d,与Sham组比较,VaD组P62表达显著降低;与VaD组比较,Nimodipine组及不同剂量NaSH组P62表达显著升高(均P<0.01)。术后30 d,与Sham组比较,VaD组P62表达显著升高;与VaD组比较,Nimodipine组及不同剂量NaSH组P62表达显著降低;与Low-NaSH组比较,High-NaSH组P62表达显著降低(均P<0.01)。见表2、图2。
2.4各组海马神经元细胞内自噬通路蛋白P-Akt表达 术后1 d,与Sham组比较,VaD组P-Akt表达显著降低;与VaD组比较,Nimodipine组及不同剂量NaSH组P-Akt表达显著降低;与Low-NaSH组比较,High-NaSH组P-Akt表达显著降低(均P<0.01)。术后7 d,与Sham组比较,VaD组P-Akt表达显著降低;与VaD组比较,不同剂量NaSH组P-Akt表达显著升高(均P<0.01)。术后30 d,与Sham组比较,VaD组P-Akt表达显著降低;与VaD组比较,Nimodipine组及不同剂量NaSH组P-Akt表达显著升高;与Low-NaSH组比较,High-NaSH组P-Akt表达显著升高(P<0.05,P<0.01)。见表2、图2。
2.5各组海马神经元细胞内自噬通路蛋白P-mTOR表达 术后1 d,与Sham组比较,VaD组P-mTOR表达显著降低;与VaD组及Low-NaSH组比较,High-NaSH组P-mTOR表达显著降低(P<0.05,P<0.01)。术后7 d,与Sham组比较,VaD组P-mTOR表达显著降低;与VaD组比较,High-NaSH组P-mTOR表达显著升高(P<0.05,P<0.01)。术后30 d,与Sham组比较,VaD组P-mTOR表达显著降低;与VaD组比较,Nimodipine组及不同剂量NaSH组P-mTOR表达显著升高;与Low-NaSH组比较,High-NaSH组P-mTOR表达显著升高(P<0.05,P<0.01)。见表2、图2。
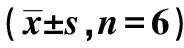
表2 各组海马神经元线粒体中Beclin1、P62及胞质中P-Akt、P-mTOR表达水平比较


图2 Western印迹检测各组P-Akt、P-mTOR表达水平
3 讨 论
VaD被广泛认为是除阿尔茨海默病(AD)后第二种最常见的痴呆类型,其临床表现主要有神经认知障碍,还包括行为症状,运动异常等。缺血后慢性低灌注也是VaD的常见诱因之一,脑卒中后慢性低灌注导致脑血流量(CBF)降低,缺氧导致氧化应激并且引发炎症反应,氧化应激使血管内皮细胞、胶质细胞和神经细胞受损从而导致CBF进一步降低,这些病理变化发生在大脑并导致VaD〔9〕。2-VO法可导致大鼠皮质区域整个CBF突然减少至35%~45%,并导致海马中CBF减少至60%〔10~12〕,能很好模拟人类衰老和痴呆中发生的全脑慢性低灌注。
线粒体是一种重要的细胞器,在活细胞中主要负责能量代谢和氧自由基(ROS)生成,同时也是缺血再灌注损伤的靶细胞器〔13〕,脑卒中后慢性低灌注可引发神经系统中神经元细胞内线粒体发生功能障碍〔14〕。自噬是介导功能障碍线粒体去除的关键细胞机制之一。本研究结果说明,在急性缺血期线粒体发生功能障碍,可能是线粒体自噬还未被激活,术后7 d及30 d线粒体自噬程度随术后时间延长而增加,且术后7 d时P62表达量降低,可能是因为此时已经过了急性缺血期(1 d),并且在缺血损伤期线粒体自噬处于稳定状态,P62募集水平小于其降解水平。而术后30 d时P62表达量与Beclin1同步升高,可能是因为在损伤修复期线粒体自噬程度升高,也可能与损伤后自我修复过程中线粒体自噬流受到抑制有关。推测在某一时间段内,神经细胞中线粒体自噬程度随缺血再灌注时间延长而加深,而缺血时间超过机体限度时再灌注会诱发细胞死亡。其中具体机制可能与缺血再灌注过程中线粒体功能、线粒体自噬及细胞存活之间的调控有关。
研究表明,H2S是一种新型气体递质,类似于一氧化氮和一氧化碳,通过抗炎症〔15〕和抗氧化应激对心脑血管起保护作用〔16〕。有研究指出,H2S对脑缺血小鼠的血脑屏障完整性起着重要的保护作用〔17〕。此外,有研究证明H2S对氧糖剥夺再灌注(OGD/R)诱导的神经元细胞凋亡中线粒体功能起到保护作用〔18〕。同时有研究表明,H2S与自噬有关,H2S通过调节磷脂酰肌醇3激酶(PI3K)/Akt1通路抑制心肌纤维化的自噬〔19〕。课题组前期研究发现VaD大鼠血浆H2S含量降低、学习记忆能力受损,NaSH处理后血浆H2S含量升高且学习记忆能力增强〔8〕,而H2S改善VaD大鼠学习记忆能力的作用机制目前尚不明确。同时,H2S对于脑缺血再灌注损伤中线粒体自噬的作用尚无定论,但有研究认为当自噬在疾病的发病机制中发挥正面作用时,外源性H2S处理可使自噬上调,当自噬发挥负面作用时,外源性H2S通过下调自噬发挥保护作用〔20〕。本研究结果说明,外源性H2S作为预防药处理后大鼠海马神经元线粒体自噬程度降低,并且缺血再灌注7 d大鼠海马神经元线粒体自噬流被抑制:而作为治疗药物处理,同样能使缺血再灌注30 d VaD大鼠海马神经元线粒体自噬程度降低。此前有研究通过抑制人神经元细胞母细胞瘤细胞(SH-SY5Y)细胞内线粒体钙单向转运蛋白降低了OGD/R后的线粒体自噬,并且改善了线粒体形态及功能,提高了细胞活力〔21〕。推测在VaD大鼠海马神经元细胞中,缺血再灌注导致的线粒体自噬过量,在VaD发病中起负面作用,而H2S通过降低海马神经元中线粒体自噬水平起到神经元保护作用。本研究说明,高剂量NaSH能更好降低缺血再灌注后神经细胞线粒体自噬程度,能较好改善VaD大鼠脑组织中神经元线粒体功能障碍,从而对VaD大鼠发挥更强的神经保护作用。
PI3K/Akt/mTOR信号通路是一种重要的信号传导介质,对损伤后神经元存活产生显著影响。通常被视为关键神经保护信号通路之一〔22〕。PI3K是一种细胞内磷脂酰肌醇激酶,通过调节其下游信号通路在脑缺氧缺血性损伤中发挥核心作用,而Akt作为关键信息分子,是PI3K 信号转导通路中的重要下游靶点。可刺激细胞存活、增殖、抑制细胞凋亡,维持正常功能。同时,作为Akt重要底物之一,mTOR是细胞存活、增殖、分化和代谢的主要调节因子,并且P-mTOR活性升高可抑制自噬〔23〕。研究证实,经过缺血再灌注损伤后的神经细胞中P-PI3K、P-Akt、P-mTOR蛋白表达受到抑制。同时,Akt/mTOR通路与线粒体自噬呈负调控关系。外源性H2S可通过PI3K/Akt/mTOR途径抑制自噬从而改善脂多糖诱导的急性肺损伤〔24〕。本研究发现,外源性H2S可减轻脑缺血再灌注损伤后的线粒体自噬,术后7 d及30 d模型组Akt/mTOR通路均受到抑制,但NaSH处理后Akt/mTOR通路被激活且线粒体自噬受到抑制,同时30 d NaSH高剂量处理组P-mTOR、P-Akt表达量较NaSH低剂量明显升高,与30 d组线粒体自噬程度呈负相关,推测外源性H2S可通过上调Akt/mTOR通路抑制神经元线粒体自噬并改善其线粒体形态及功能,从而保护神经细胞免受缺血再灌注损伤。此前Xu等〔25〕发现,NaSH可通过激活PI3K/Akt/mTOR通路抑制线粒体自噬改善线粒体功能,并起到改善脑应激性损伤后的功能恢复作用。本研究结果提示,OGD/R在1 d后Akt/mTOR通路受到抑制,用阳性药物及NaSH处理后P-Akt与P-mTOR表达量与模型组比较均降低,说明NaSH处理后Akt/mTOR通路进一步受到抑制,但是观察到线粒体自噬程度却也降低,说明Akt/mTOR通路与线粒体自噬调节不是一个专一性调控,可能还有其他通路参与外源性H2S对脑缺血再灌注过程中的线粒体自噬的调控。
综上,缺血再灌注会导致神经元线粒体功能受损并激活胞内线粒体自噬,在缺血急性期线粒体损伤严重但无明显线粒体自噬发生,同时在一定时间段内随着缺血时间增加,线粒体自噬程度增强。外源性H2S可保护缺血再灌注所致神经元线粒体功能受损,降低VaD大鼠海马神经元的线粒体自噬程度,从而对神经元发挥保护作用,Akt/mTOR通路在其中起到调控作用。且高剂量NaSH处理比低剂量 NaSH处理能更好改善VaD大鼠脑组织中神经元线粒体功能障碍、降低神经元线粒体自噬程度,对学习、记忆及定航能力有更好的改善作用。

