丝沉香中2个α-葡萄糖苷酶抑制活性的2-(2-苯乙基)色酮二聚体
韦 媛,董文化,李 薇,曾 军,陈惠琴,袁靖喆,梅文莉,戴好富,王 昊*,郭志勇
丝沉香中2个α-葡萄糖苷酶抑制活性的2-(2-苯乙基)色酮二聚体
韦 媛1, 2,董文化2,李 薇2,曾 军2,陈惠琴2,袁靖喆2,梅文莉2,戴好富2,王 昊2*,郭志勇1*
1. 三峡大学生物与制药学院,天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002 2. 中国热带农业科学院热带生物技术研究所,海南省沉香工程技术研究中心,沉香国际联合研究中心,海南省黎药资源天然产物研究与利用重点实验室,海南 海口 571101
研究菲律宾产丝沉香的化学成分。采用硅胶、凝胶、半制备高效液相色谱等多种色谱技术分离丝沉香的化学成分,通过高分辨质谱、核磁共振等波谱学方法鉴定化合物结构,采用改进后的4-硝基苯基-β--吡喃葡萄糖苷(4-nitrophenyl-β--glucopyranoside,pNPG)法测试化合物的α-葡萄糖苷酶抑制活性。从菲律宾产丝沉香中分离鉴定了2个2-(2-苯乙基)色酮二聚体,分别为aquifilarone N(1)和diaquilariachrome B(2)。化合物1和2均具有α-葡萄糖苷酶抑制活性,半数抑制浓度(median inhibition concentration,IC50)值分别为(14.33±0.38)μmol/L和(39.53±2.09)μmol/L。化合物1为新化合物,化合物2为首次从丝沉香中分离得到。
丝沉香;沉香;2-(2-苯乙基)色酮二聚体;α-葡萄糖苷酶抑制活性;aquifilarone N;diaquilariachrome B
沉香为瑞香科(Thymelaeaceae)沉香属Lam. 或拟沉香属Gaertn. 植物含有树脂的木材。作为传统名贵药材,沉香主要用于治疗胸腹胀闷疼痛、呕吐呃逆、气逆喘急等症[1],还可治疗精神疾病,如神经官能症、神经分裂症和神经衰弱[2]。此外,沉香还是天然香料,位列“沉檀龙麝”四大名香之首,被称为“香料之王”,在香文化、日化等领域广泛使用。现代药理学研究表明,沉香主要含有倍半萜类和2-(2-苯乙基)色酮类化合物[3],此类化合物具有抗炎、细胞毒、α-葡萄糖苷酶抑制、乙酰胆碱酯酶抑制、神经保护等生物活性[3-7]。其中,2-(2-苯乙基)色酮类化合物是沉香真伪鉴定和品质评价的关键成分[1]。据中国濒危物种进出口管理办公室数据显示丝沉香为四大沉香进口品种之一[8]。丝沉香(Oken) Merr.主要分布于印度尼西亚、巴布亚新几内亚、菲律宾、马鲁古群岛[9-10]。作为沉香贸易的重要组成部分,关于丝沉香中化学成分的报道屈指可数,对其鉴定与应用也缺乏科学指导[7,11-15]。本课题组首先系统研究了印度尼西亚产丝沉香的化学成分,发现5,8-二羟基-2-(2-苯乙基)色酮衍生物丰富,且具有显著的抗炎活性[7,14]。另外,也从菲律宾产丝沉香中发现一系列结构新颖且有抗炎活性的2-(2-苯乙基)色酮二聚体,聚合方式与印度尼西亚产丝沉香中2-(2-苯乙基)色酮二聚体的结构存在一定差异,尚未发现5,8-二羟基-2-(2-苯乙基)色酮衍生物[5]。本课题继续对菲律宾产丝沉香的乙醇提取物醋酸乙酯相进行分离纯化,得到2个2-(2-苯乙基)色酮二聚体(图1),分别为aquifilarone N(1)和diaquilariachrome B(2)。其中化合物1为新化合物,化合物2首次从菲律宾产丝沉香中分离得到。化合物1和2均具有显著的α-葡萄糖苷酶抑制活性。

图1 菲律宾产丝沉香中2-(2-苯乙基)色酮二聚体
1 仪器与材料
安捷伦1260分析型高效液相色谱仪和安捷伦1260半制备型高效液相色谱仪(美国Agilent公司);Cosmosil 5PFP色谱柱(250.0 mm×10.0 mm,5 μm,Nacalai tesque公司);Cosmosil πNAP色谱柱(250.0 mm×10.0 mm,5 μm,Nacalai tesque公司);布鲁克AV-500型超导核磁仪(德国布鲁克公司);沃特世Xevo G2-XS QTof质谱仪(美国沃特世科技有限公司);旋光仪MCP 5100(奥地利Anton Paar有限公司);圆二色谱仪MOS-500(法国Biologic公司);CA-1111型冷却水循环装置(上海爱朗仪器有限公司);旋转蒸发仪(德国Heidolph Laborota);Mettler Toledo ME204精密分析天平[万分之一,梅特勒-托力多仪器(上海)公司];ELX-800 酶标仪(美国宝特公司);薄层色谱硅胶板G和柱色谱硅胶G、H(200~300、60~80目,青岛海洋化工厂);ODS(20~45 µm,日本Fuji公司);凝胶Sephadex LH-20(德国Merck公司);色谱级甲醇(批号221121)购于康科德科技有限公司;α-葡萄糖苷酶(批号6052006)购于Sigma-Aldrich公司;阿卡波糖(批号W12J9B52561)购于青岛腾龙微波科技有限公司;金雀异黄酮(批号C11903909)购于Macklin公司;4-硝基苯基-β--吡喃葡萄糖苷(4-nitrophenyl- β--glucopyranoside,pNPG,批号K22J9B64113)购于源叶生物公司。
菲律宾产丝沉香样品购于海南省海口市,经中国热带农业科学院热带生物技术研究所戴好富研究员鉴定其基原植物为丝沉香(Oken) Merr.,凭证标本(FLBS20200710)保存在中国热带农业科学院热带生物技术研究所。
2 提取与分离
将干燥的丝沉香样品(817.0 g)粉碎后经95%乙醇(5.0 L)回流提取5次,减压浓缩得到浸膏(180.4 g)。乙醇提取物均匀分散于去离子水中,用石油醚(3.5 L×3)、醋酸乙酯(3.5 L×3)和正丁醇(3.5 L×3)依次进行萃取,即得石油醚相7.4 g、醋酸乙酯相81.7 g和正丁醇相85.2 g。醋酸乙酯相经减压硅胶柱色谱(9 cm×25 cm),以氯仿-甲醇(100∶1→0∶1)梯度洗脱后,根据TLC和HPLC分析合并得到14个流分(Fr. 1~14)。Fr. 12(17.8 g)在ODS柱上通过甲醇-水溶液(40%~100%)加压洗脱,所得洗脱液浓缩后经过TLC和HPLC分析合并得到20个流分(Fr. 12.1~12.20)。Fr. 12.6(232.8 mg)经Sephadex LH-20(甲醇)得到3个流分(Fr. 12.6.1~12.6.3),Fr. 12.6.2(96.3 mg)经半制备型HPLC(πNAP柱,甲醇-水65∶35)柱色谱后得到3流分(Fr. 12.6.2.1~12.6.2.3),Fr. 12.6.2.2(37.8 mg)再经半制备型HPLC(5PFP柱,甲醇-水50∶50)获得化合物1(3.7 mg,R=25.0 min)。Fr. 12.9(532.8 mg)经Sephadex LH-20(甲醇)得到3个流分(Fr. 12.9.1~12.9.3),Fr. 12.9.2(48.9 mg)经半制备型HPLC(πNAP柱,甲醇-水65∶35)分离得化合物2(8.0 mg,R=50.0 min)。
3 结构鉴定
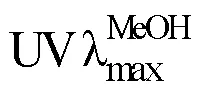

表1 化合物1的1H-NMR (500 MHz, DMSO-d6)和DEPTQ (125 MHz, DMSO-d6)数据
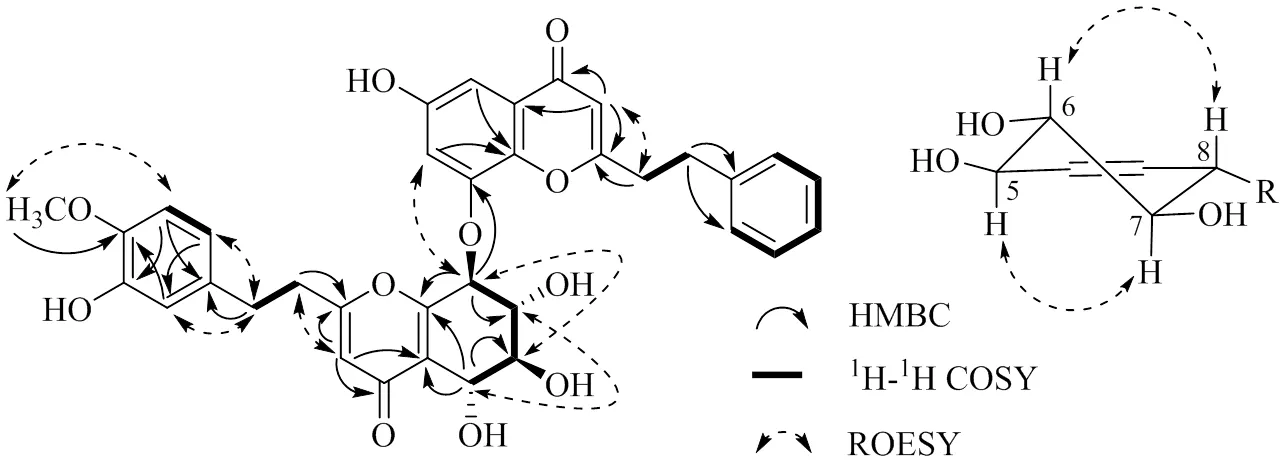
图2 化合物1的关键2D NMR信号
综合分析化合物1的一维和二维核磁数据,化合物1中Unit A和Unit B的结构分别与aquilarone D[16]和6,8-二羟基-2-(2-苯乙基)色酮[17]一致,共20个不饱和度,不含有其他环。由HMBC上H-8到C-8的远程相关,ROESY上H-8到H-7的NOE效应,确定Unit A与Unit B是通过C8--C8连接。化合物1的相对构型通过偶合常数和NOE效应确定。H-5/H-8的偶合常数[35,6(6.8 Hz)、36,7(9.0 Hz)和37,8(7.2 Hz)] 表明以上4个氢原子均位于假直立键,且H-5/H-6、H-6/H-7、H-7/H-8为反式构型。ROESY上H-5/H-7和H-6/H-8的NOE效应进一步证明以上推断,该化合物的相对构型与crassin B[6]一致(图2)。化合物1的CD图谱中Cotton效应[243 (−9.7), 210 (+9.7) nm]与crassin B [236 (−12.65), 214 (+9.88) nm]的一致,表明该化合物与crassin B的绝对构型相同,为5,6,7,8。命名为aquifilarone N。
4 α-葡萄糖苷酶抑制活性测试
α-葡萄糖苷酶抑制剂能选择性的作用于小肠黏膜刷状缘上的葡萄糖苷酶,抑制多糖及蔗糖分解成葡萄糖,延缓碳水化合物的分解,减少葡萄糖的吸收。
采用改进后的pNPG法[21-24]测试化合物1和2的α-葡萄糖苷酶抑制活性。α-葡萄糖苷酶用0.1 mol/L pH 6.8的PBS稀释成0.2 U/mL α-葡萄糖苷酶溶液。取65 μL的待测溶液加入650 μL的α-葡萄糖苷酶溶液,阴性对照组和空白对照组待测溶液为DMSO,摇匀后,取110 μL于96孔板中(4次重复),因以上2个化合物颜色为黄色,需除去本底吸收,多做2组平行。将96孔板于37 ℃放置15 min后,化合物组与阴性对照组加入40 μL的2.5 mmol/L pNPG溶液;空白对照组与化合物本底组加入40 μL 0.1 mol/L PBS溶液。将96孔板于37 ℃放置15 min后,在405 nm波长下检测每孔的吸光度()值。以阿卡波糖(质量分数≥95.0%)、金雀异黄酮(质量分数≥97.0%)为阳性对照。并按照公式计算抑制率。
抑制率=[(DMSO-PBS)-(样品-本底)]/(DMSO-PBS)
DMSO为阴性对照组的值,PBS为空白对照组的值,样品为化合物组的值,本底为化合物本底组的平均值
实验结果显示,化合物1和2均具有显著的α-葡萄糖苷酶抑制活性,半数抑制浓度(median inhibition concentration,IC50)分别为(14.33±0.38) μmol/L和(39.53±2.09)μmol/L。阳性对照阿卡波糖和金雀异黄酮的IC50分别为(1 147.05±185.87)μmol/L和(30.57±1.07)μmol/L。
5 讨论
沉香中2-(2-苯乙基)色酮类化合物结构类型丰富,其中2-(2-苯乙基)色酮二聚体的单体结构类型和聚合方式多样,国产沉香、柯拉斯那沉香、丝沉香等不同来源沉香中2-(2-苯乙基)色酮二聚体结构和相对含量存在差异,可为沉香的鉴别提供依据[3-7]。本研究利用多种现代色谱和波谱学技术从菲律宾产丝沉香中分离鉴定2个2-(2-苯乙基)色酮二聚体aquifilarone N(1)和diaquilariachrome B(2),2个化合物都为5,6,7,8-四氢-2-(2-苯乙基)色酮与flindersia型2-(2-苯乙基)色酮通过C8--C8''连接的二聚体。然而,文献检索发现化合物2曾被错误鉴定为AH15[18]。化合物1和2对α-葡萄糖苷酶都表现出了较强的体外抑制活性,IC50值分别为(14.33±0.38)μmol/L和(39.53±2.09)μmol/L。以上结果丰富了丝沉香的化学成分及α-葡萄糖苷酶抑制活性化合物,为丝沉香鉴定技术体系的建立提供了科学依据,也为丝沉香资源进一步开发利用提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 192-193.
[2] 戴好富. 沉香的现代研究 [M]. 北京: 科学出版社, 2017: 1-2.
[3] Li W, Chen H Q, Wang H,. Natural products in agarwood andplants: Chemistry, biological activities and biosynthesis [J]., 2021, 38(3): 528-565.
[4] Chen L Y, Chen H Q, Cai C H,. Seven new 2-(2-phenethyl)chromone derivatives from agarwood of[J]., 2023, 165: 105421..
[5] Yang H R, Wang P, Liu F Z,. Dimeric 2-(2-phenethyl)chromones from agarwood of[J]., 2023, 165: 105422.
[6] Yang Y, Mei W L, Kong F D,. Four new bi-2-(2-phenylethyl)chromone derivatives of agarwood from[J]., 2017, 119: 20-25.
[7] Liu F Z, Wang H, Li W,. Filarones A and B, new anti-inflammatory dimeric 2-(2-phenethyl)chromones from agarwood of[J]., 2021, 46: 11-14.
[8] 董梦妤, 焦立超, 姜笑梅, 等. 沉香的资源分布、识别与贸易现状 [J]. 木材工业, 2016, 30(4): 20-24.
[9] 戴好富, 梅文莉. 世界沉香产业 [M]. 北京: 中国农业出版社, 2017: 24-25.
[10] 戴好富, 梅文莉. 沉香实用栽培和人工结香技术 [M]. 北京: 中国农业出版社, 2015: 17-18.
[11] Mi C N, Yuan J Z, Zhu M M,. 2-(2-phenylethyl)chromone derivatives: Promising α-glucosidase inhibitors in agarwood from[J]., 2021, 181: 112578.
[12] Mi C N, Mei W L, Wang H,. Four new guaiane sesquiterpenoids from agarwood of[J]., 2019, 135: 79-84.
[13] Mi C N, Mei W L, Yuan J Z,. Chemical constituents from agarwood of[J]., 2021, 30(6): 505-517.
[14] 米承能.(Oken) Merr. 产沉香乙醇提取物化学成分及生物活性研究 [D]. 海口: 海南大学, 2020.
[15] Suzuki A, Miyake K, Saito Y,. Phenylethylchromones withantitumor promoting activity from[J]., 2017, 83(3/4): 300-305.
[16] Chen D, Xu Z R, Chai X Y,. Nine 2-(2-phenylethyl)chromone derivatives from the resinous wood ofand their inhibition of LPS-induced NO production in RAW264.7 cells [J]., 2012(27): 5389-5397.
[17] Konishi T, Konoshima T, Shimada Y,. Six new 2-(2-phenylethyl)chromones from agarwood [J]., 2002, 50(3): 419-422.
[18] Iwagoe K, Kodama S, Konishi T,. The structures of AH15 and AH18, new bi- and tri-phenylethylchromones from agalwood [J]., 1987, 35: 4680-4682.
[19] Shibata S, Sugiyama T, Uekusa Y,. Five new 2-(2-phenylethyl)chromone derivatives from agarwood [J]., 2020, 74(3): 561-570.
[20] He D, Dong W H, Li W,. LC-MS-guided isolation of 2-(2-phenylethyl)chromone dimers from red soil agarwood of[J]., 2022, 158: 105162.
[21] Liao G, Mei W L, Dong W H,. 2-(2-Phenylethyl) chromone derivatives in artificial agarwood from[J]., 2016, 110: 38-43.
[22] Li T, Zhang X D, Song Y W,. A microplate-based screening method for alpha-glucosidase inhibitors [J]., 2005, 10: 1128-1134.
[23] Jong-Anurakkun N, Bhandari M R, Kawabata J. α-glucosidase inhibitors from devil tree () [J]., 2007, 103(4): 1319-1323.
[24] 康科星, 戴好富, 王佩, 等. 柯拉斯那沉香的倍半萜类化学成分研究 [J]. 中草药, 2017, 48(22): 4601-4607.
Two 2-(2-phenylethyl) chromone dimers with α-glucosidase inhibitory activity from agarwood of
WEI Yuan1, 2, DONG Wen-hua2, LI Wei2, ZENG Jun2, CHEN Hui-qin2, YUAN Jing-zhe2, MEI Wen-li2, DAI Hao-fu2, WANG Hao2, GUO Zhi-yong1
1. Hubei Key Laboratory of Natural Product Research and Development, College of Biological and Pharmaceutical Sciences, China Three Gorges University, Yichang 443002, China 2. Hainan Engineering Research Center of Agarwood, International Joint Research Center of Agarwood, Hainan Key Laboratory of Natural Products Research and Development of Li Folk Medicine, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China
To investigate the chemical constituents of agarwood offrom Philippines.All compounds were isolated by using various chromatographic techniques, including silica gel, Sephadex LH-20, semi-preparative high performance liquid chromatography. Their structures were elucidated based on modern spectroscopic methods, such as high-resolution mass spectrometry (HRMS) and nuclear magnetic resonance (NMR). The α-glucosidase inhibition assay was performed by modified pNPG (4-nitrophenyl β--glucopyranoside) method.Two 2-(2-phenylethyl) chromone dimers were isolated from agarwood of, and identified as aquifilarone N (1) and diaquilariachrome B (2). Compounds 1 and 2 exhibited α-glucosidase inhibitory activities, with IC50values of (14.33 ± 0.38)μmol/L and (39.53 ± 2.09) μmol/L, respectively.Compound 1 is a new compound, and compound 2 is isolated fromfor the first time.
(Oken) Merr.; agarwood; 2-(2-phenylethyl) chromone dimer; α-glucosidase inhibitory activity; aquifilarone N; diaquilariachrome B
R284.1
A
0253 - 2670(2023)22 - 7336 - 06
10.7501/j.issn.0253-2670.2023.22.010
2023-07-21
海南省重大科技计划项目(ZDKJ2021031);财政部和农业农村部国家现代农业产业技术体系(CARS-21);海南省自然科学基金高层次人才项目(320RC714);中央级公益性科研院所基本科研业务费专项(1630052023006)
韦 媛(1998—),女,壮族,在读硕士研究生,研究方向为天然产物化学。E-mail: weiyuannpc@126.com
通信作者:郭志勇(1975—),男,教授,从事药用植物及其内生菌活性次级代谢产物研究。E-mail: zhyguoctgu@foxmail.com
王 昊(1990—),男,助理研究员,从事热带药用植物活性次生代谢产物研究。E-mail: wanghao@itbb.org.cn
[责任编辑 王文倩]