高糖、高脂饮食对小鼠肠道屏障功能及炎症的影响
邵君琳,田苗新,王富康,孙奕炜,王光强,艾连中,夏永军
(上海理工大学 上海 200093)
随着生活水平的提高,越来越多的人受肥胖困扰,这与饮食习惯密不可分。高糖、高脂饮食(HSFD)的长期摄入是造成肥胖的元凶之一,同时会伴随一些并发症。HSFD 具有较高能量,短期摄入后会使机体血糖和胰岛素快速上升,脂肪组织积累,而脂肪组织的长期堆积会引起血脂和肝功能异常,进而增加冠心病、肝炎、代谢综合征等发病风险[1]。多项研究显示,长期摄入高糖、高脂的饮食会打破机体固有免疫,引起全身慢性炎症、心血管、神经类等疾病的发生,其作用方式主要通过改变微生物群组成,激活或抑制相关受体和细胞以及影响线粒体功能等[2]。
炎症性肠病(inflammatory bowel diseases,IBD)是一种严重影响患者生活质量的免疫机制失衡的慢性胃肠道疾病,临床上主要将IBD 划分为克罗恩氏病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)两类,其发病机制虽暂未明确,但一致认为遗传、环境、肠道屏障的缺陷是其最主要的致病因素[3]。其临床表现为腹泻、黏液脓血便等,该病治愈难度大且易于复发。目前对UC 常见的药物治疗主要包括抗炎药、免疫抑制药和肾上腺皮质激素等。然而,这些治疗方法具有许多缺点,例如腹部疼痛、高血压和过敏反应等。近年来,益生菌、粪菌移植、多糖、间充质干细胞移植和中医治疗等为研究热点,上述方法有明确的药效和较少的副作用,用来预防和治疗UC 及其并发症[4]。
研究表明,HSFD 与炎症性肠病(IBD)之间存在一定联系,其会引起脂肪过度积累,机体产生炎症反应,肠道菌群紊乱,致病菌破坏黏液层结构并产生相关次级胆汁酸,造成肠上皮细胞功能障碍,从而促进IBD 的发生[5]。肠上皮屏障功能障碍是溃疡性结肠炎的主要致病因素,紧密连接结构作为肠上皮屏障的主要部分,能防止肠腔内的一些致病菌、病毒等进入黏膜固有层和血液循环[6]。然而,HSFD 对小鼠结肠紧密连接结构以及结肠炎症的影响并不明确。本文考察HSFD 对小鼠肠道屏障功能、炎症水平以及结肠的影响,为探究HSFD 与IBD 的内在联系、发生机制以及选择合适的治疗方法奠定基础。
1 材料与方法
1.1 动物、材料与试剂
实验动物采用SPF 级C57BL/6J 小鼠(3 周龄,雄性,平均体质量13 g±2 g),实验动物使用许可证号:SCXK(沪)2018-0006,购于上海市计划生育科学研究所实验动物经营部。标准饲料购自苏州双狮实验动物饲料科技有限公司,为了探讨过多摄入脂肪和糖类对肠道的具体影响,对照饲料选取低糖、低脂饮食,高糖、高脂饮食TP26303 和低糖、低脂饮食TP26342 均购于南通特洛菲饲料科技有限公司,成分表如表1 所示。

表1 饮食成分表Table 1 Diet composition table
髓过氧化物酶(MPO)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒,南京建成生物工程研究所;便隐血试剂盒,贝索企业;阿利新蓝、苏木素,Sigma;伊红Y、包埋石蜡、中性树胶,国药集团;Trizol、DEPC处理水,上海生工生物有限公司;异丙醇、三氯甲烷、无水乙醇(分析纯),Thermo Fisher Scientific;反转录试剂盒、HiScript III RT SuperMix for qPCR,南京诺唯赞生物科技有限公司;qPCR SYBR Green Master Mix,翊圣生物有限公司;引物由华大基因合成异硫氰酸荧光素标记葡聚糖(FITC-Dextran)(分子质量40 000),上海源叶生物科技有限公司;Occludin 抗体、ZO-1 抗体,Abcam;ELISA 试剂盒,上海通蔚。
1.2 仪器与设备
SpectraMax i3x 型酶标仪,奥地利美谷分子仪器有限公司;GT 200 研磨仪,北京格瑞德曼仪器设备有限公司;3-18K 冷冻离心机,德国Sigma 公司;Bio-rad S1000 梯度PCR 仪、电泳仪、凝胶成像仪,美国伯乐Bio-rad 生命医学产品上海有限公司;NanoDrop 2000 分光光度计,美国Thermo Scientific;Light Cycler 实时荧光定量PCR 仪,罗氏制药有限公司;病理切片机,德国Leica RM 2016 轮转式切片机;组织摊烤片机,武汉俊杰JK-6 生物组织摊烤片机;显微镜,尼康E100 型生物显微镜;数码单反相机,佳能550 D。
1.3 动物分组和处理
小鼠生长环境温度控制在(22±2)℃,湿度为(50±10)%,自由饮食、饮水,以4 g/d 进食量为参考,每12 h 昼夜交替。在整个实验期间,动物实验的程序严格按照中国有关实验动物的相关饲养规范和法律规定进行,本研究遵循动物试验委员会所制订的伦理学标准,批准文号为伦审-KYSB-2016-97,许可号:SCXK-(沪)-2013-0006。
小鼠经过1 周的适应性饲养后,随机分为高糖、高脂饮食(HSFD)组,低糖、低脂(LFD)组两组,每组8 只,饮食干预4 周。实验过程中,每周记录小鼠体重。第5 周末,小鼠禁食过夜,第2 天采用眼球取血的方式处死,立刻收集血液样品,置于1.5 mL 的无菌离心管中,室温静置30~40 min 左右,4 ℃下4 500 r/min 离心10 min,小心分离血清,放入-80 ℃环境冷藏备用,避免反复冻融。迅速解剖小鼠,收集肝脏、结肠组织用于后续实验检测。
1.4 实验方法
1.4.1 小鼠疾病活动指数(DAI)评分 为了评估实验期间结肠炎症状的发展,每天对小鼠DAI 进行监测[7]。DAI 包括体重变化、便血情况和粪便形态。隐血试剂盒测量粪便中的潜血,评分标准见表2。

表2 疾病活性指数评分标准Table 2 Disease activity index scoring standards
1.4.2 血清生化指标测定 小鼠血清中TC、TG、LDL-C、HDL-C 含量按照试剂盒要求测定[8]。
1.4.3 肝脏和结肠病理学检测 肝脏进行油红O和HE 染色,结肠采用HE 和阿利新兰染色。油红O 是一种偶氮染料,作为一种强脂溶剂和染脂剂,溶于细胞和组织中的脂质,用于显示组织中脂质的聚集情况[9]。HE 染色能够使细胞核呈蓝紫色,细胞质则呈橙红色。阿利新蓝是一种大分子共轭染料,能将黏液层的黏蛋白染成蓝色,肠道黏蛋白的变化用阿利新蓝进行评估[10]。肝脏和结肠组织采用多聚甲醛固定24 h 后,常规脱水处理、浸蜡包埋、切片,烤片并脱蜡、结肠和肝脏采用苏木精伊红染色,另取一份同样操作的结肠切片进行阿利新蓝(pH 2.5)染色处理,然后在显微镜下观察炎症情况和黏膜损伤情况。
1.4.4 结肠长度的测定 解剖后快速取小鼠结肠部位,卡尺测量盲肠末端至肛门的长度。
1.4.5 髓过氧化物酶活性 准确称量结肠组织质量,按照试剂盒要求进行样品前处理,检测小鼠结肠组织MPO 活性[11]。
1.4.6 FITC-葡聚糖检测小鼠肠道通透性 小鼠禁食、禁水4 h 后,用异硫氰酸荧光素标记葡聚糖(FITC-Dextran)(100 mg/mL,无菌PBS 配制,分子质量40 000),120 μL/只,灌胃小鼠。灌胃4 h 后眼球取血,血液样品静置30~40 min,4 500 r/min 离心15 min,收集100 μL 血清。将100 mg/mL 异硫氰酸荧光素标记葡聚糖(FITC-Dextran)稀释为标准品。在激发波长为485 nm,发射波长为535 nm的条件下,用酶标仪读取吸光度值(OD 值)[15]。
1.4.7 小鼠结肠组织紧密连接蛋白和黏液蛋白基因表达测定 取结肠约1 cm,Trizol 法提取RNA,根据反转录试剂盒反转录为cDNA,将制备好的cDNA 置于-20℃中保存备用,可长期保存于-80℃。根据qPCR SYBR Green Master Mix 使用要求对ZO-1、Occludin、MUC-2 等基因进行PCR 的扩增。HPRT1 作为内参基因,引物信息如表3 所示,2-△△Ct法计算基因的相对表达量。

表3 qPCR 引物序列Table 3 Primer sequence
1.4.8 结肠组织中ZO-1、Occludin、Muc-2、TNFα、IL-10 基因相对表达量的测定 同1.3.8 节的方法,测定结肠中ZO-1、Occludin、Muc-2、TNFα、和IL-10 的基因相对表达量,引物序列见表3。
1.4.9 免疫荧光法观察及测定结肠组织中ZO-1、Occludin 的表达 取1~2 cm 结肠组织进行同1.3.4节的组织包埋、切片后进行室温脱蜡,柠檬酸抗原修复液微波进行修复,自然冷却后PBS 洗涤3 次,每次5 min,甩干水分,加山羊血清封闭液,室温30 min,甩掉封闭液,分别加入按一定比例配好的一抗,4 ℃孵育过夜,室温复温30 min,PBS 洗涤3次,每次5 min,蒸馏水洗涤3 次,每次5 min。加入荧光标记的二抗,室温避光孵育30 min 后PBS 及蒸馏水进行洗涤。荧光显色液中显色10 min,PBS及蒸馏水进行洗涤。再重复以上步骤更换一抗进行第2 次孵育完成荧光双标。随后,DAPI 核复染避光孵育10 min、封片、镜检,在不同染料的激发波长下进行拍照(紫外激发波长330~380 nm,发射波长420 nm;FITC 绿光激发波长465~495 nm,发射波长515~555 nm;CY3 红光激发波长510~560 nm,发射波长590 nm[13]。随后用Image J 进行荧光强度的测定。
1.4.10 ELISA 检测小鼠结肠组织中IL-10、TNFα 的水平 取2~3 cm 结肠准确称重后添加组织匀浆液,一般采用预冷的PBS(pH 7.4),研磨充分后10 000 g 离心10 min,随后按照ELISA 说明书取上清进行检测[14]。
1.5 数据统计分析
所有实验均进行3 次平行实验,数据结果为平均值±标准差。运用Excel 进行基础数据处理,统计软件SPSS 25.0 进行单因素方差分析(Oneway ANOVA),当P≤0.05 时,使用Duncan 检验来比较各组间差异,P≤0.05 有统计学差异。
2 结果与分析
2.1 高糖、高脂饮食对小鼠体质量及肝脏影响
动物实验设计如图1a 所示,经过1 周适应性喂养后进行HSFD 干预4 周。图1c 结果显示,较LFD 组,HSFD 干预组整个周期的体重显著增加(P<0.01)。由图1b 肝脏图片可知,HSFD 干预组小鼠肝脏颜色偏黄,较脆弱,容易出现撕裂现象,这可能是甘油三酯的过度积累造成的[15]。肝脏油红O染色显示,HSFD 小鼠肝脏出现了较多红色脂滴,且脂质液滴发生积聚,LFD 对照组只能观察到少数的红色脂滴,这可能是HSFD 后,肝脂质代谢功能障碍导致脂肪沉积在肝脏中,造成大面积脂滴生成。肝脏HE 染色显示,HSFD 小鼠肝脂肪变性,且出现炎症性细胞局灶性浸润(如图1b 黑色箭头所示)细胞出现膨胀,脂肪变性(图1b 黄色箭头所示),肝索和肝血窦位置无明显边界,而LFD 对照组肝细胞排列整齐,形态完整,可以清晰观察到肝索位置。总的来说,HSFD 会引起小鼠食欲亢进,导致体重迅速增加,对肝脏细胞造成损伤,肝脏部位脂肪的过度积累可能会引起脂肪酸组成变化并影响肝肠轴,进而影响肠道细胞[16]。
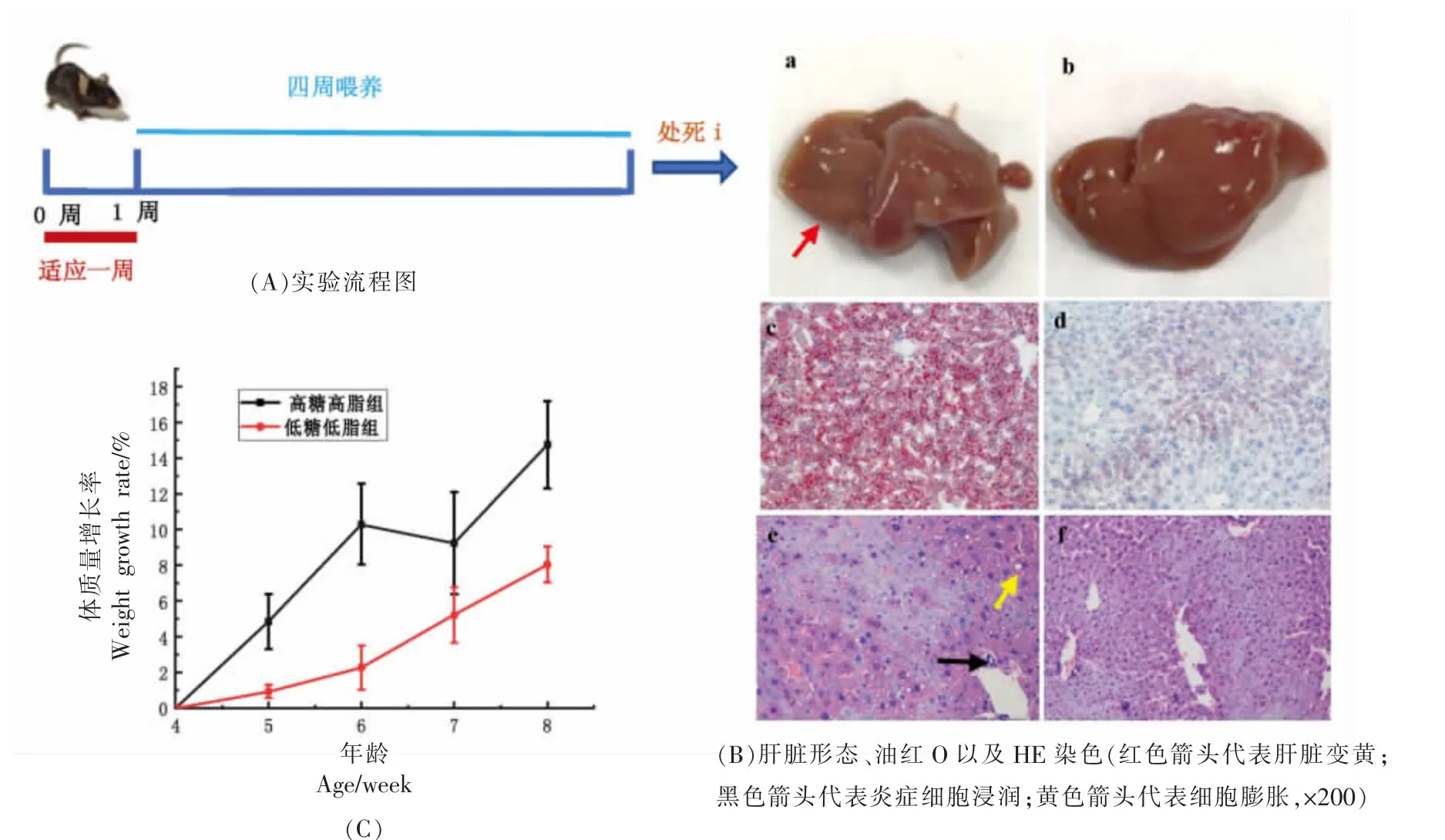
图1 动物喂养周期及高糖、高脂饮食对小鼠体质量及肝脏影响Fig.1 Effects of animal feeding cycle and high-sugar and high-fat diet on weight and liver of mice
2.2 高糖、高脂饮食对小鼠血脂指标的影响
经过4 周的饮食干预之后,对小鼠血脂指标进行测定。结果显示,与LFD 组相比,HSFD 干预组小鼠血清中TC、TG(P<0.05)、LDL-C 含量显著提高(P<0.01),HDL(P<0.01)含量显著下降(图2),其中HSFD 小鼠TC、TG、LDL-C 含量分别显著升高74%,34%,105%,HDL-C 含量显著降低36%,说明HSFD 饮食4 周后显著影响小鼠血脂状态。HSFD 干预后能够导致脂肪积累、脂质代谢异常,进一步可能诱发高血脂症,并可能演变为动脉粥样硬化[17]。

图2 高糖、高脂饮食对血清中TC、TG、HDL、LDL 的影响Fig.2 The influence of high-sugar and high-fat diet on the concentration of TC,TG,HDL-C and LDL-C in serum
2.3 高糖、高脂饮食对小鼠结肠炎状况及肠道通透性的影响
接下来,研究HSFD 是否会对小鼠结肠造成影响。DAI 评分能够在一定程度上表征结肠炎症状。MPO 是一种主要存在于嗜中性粒细胞的溶酶体蛋白,当病原体侵入时,中性粒细胞将病原体吞噬,从而保证机体的正常运行,其活性作为中性粒细胞浸润组织和急性炎症的重要生物标志物之一,酶活的降低代表中性粒细胞积聚得到抑制[18]。肠道通透性增加是结肠炎发生的促进因素之一,利用FITC-Dextran 可以直接测定肠道屏障的完整状况。
对小鼠结肠进行测定,结果显示,HSFD 干预后,DAI 评分、结肠组织MPO 活性显著提高(图3a、3b,P<0.01)、结肠长度缩短(图3c,P<0.05)证明HSFD 能够导致小鼠结肠炎的发生。接着为了探究高糖、高脂引发结肠炎症状是否和小鼠肠道通透性有关,利用FITC-Dextran 对小鼠肠道屏障的通透性进行测定,结果显示,HSFD 干预组小鼠血清中FITC-Dextran 的质量浓度为(0.066±0.006)μg/mL,约为LFD 饮食组的1.73 倍(P<0.05),这证明HSFD 干预后显著提高了小鼠肠道屏障通透性(图3d)。HSFD 的摄入通过提高结肠部分MPO 活性以及肠道屏障通透性,这可能是肠道菌群失衡导致有害菌进入肠腔,导致黏液降解和紧密连接结构遭到破坏,肠道免疫系统失衡,进而导致结肠部位炎症的发生[19]。
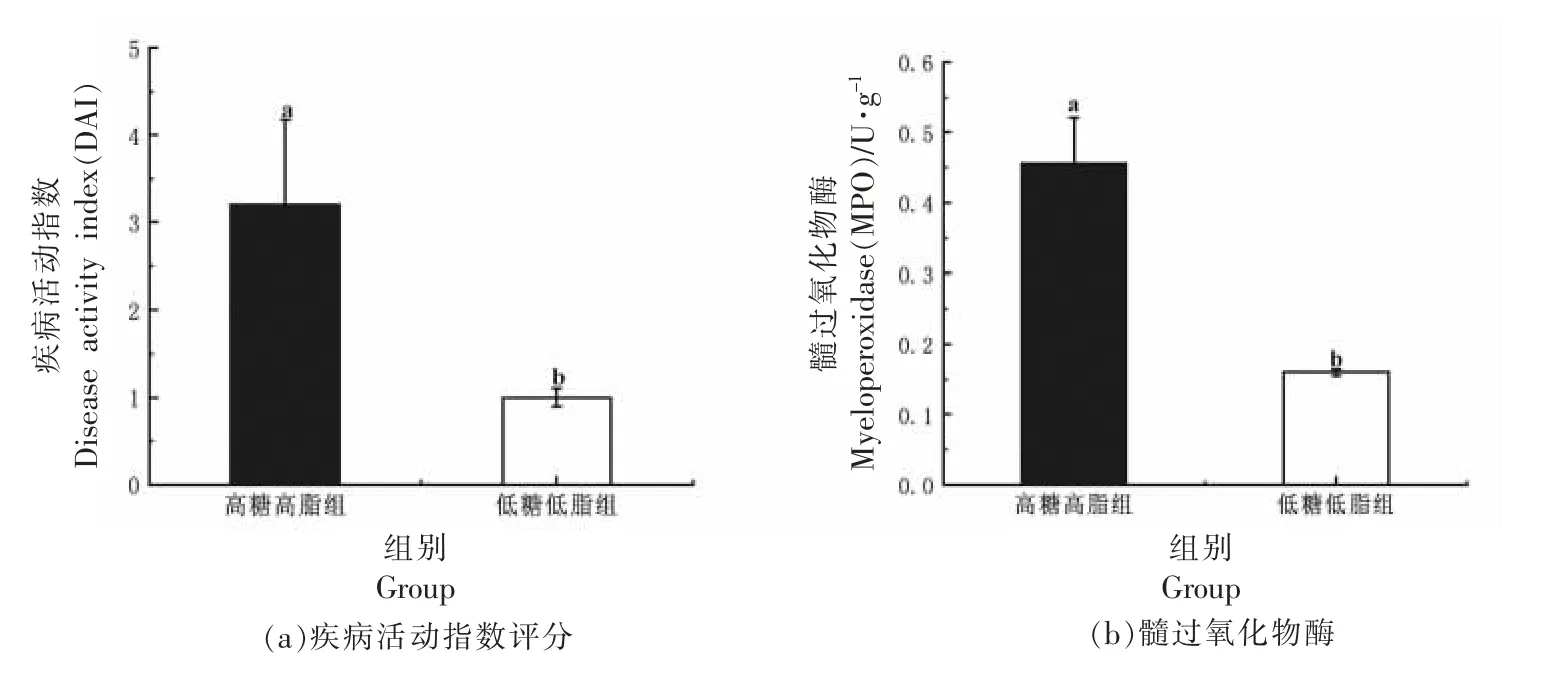
图3 高糖、高脂饮食对小鼠结肠炎症状及肠道通透性影响Fig.3 Effects of high-sugar and high-fat diet on the symptoms of colitis and intestinal permeability in mice
2.4 高糖、高脂饮食对小鼠粪便形态及结肠上皮组织影响
由于小鼠肠道通透性发生了显著变化,因此进一步探究HSFD 干预是否对小鼠的结肠上皮组织和黏液层造成了损伤。首先对小鼠粪便进行观察,如图4A 所示,HSFD 干预组小鼠粪便较为干燥并可观察到血便情况(图4A 红色箭头所示),便隐血测试颜色较深,(蓝紫色越深,便血情况越严重)LFD 组小鼠粪便色泽与形态较好,经便隐血测试没有便血情况,与上述试验结果一致,HSFD 干预导致了小鼠结肠炎的发生。对结肠进行病理学染色,由HE 染色可知,HSFD 干预组小鼠结肠黏膜出现炎症性细胞浸润(图4B 蓝色箭头所示)、部分隐窝结构改变(图4B 黑色箭头所示)、中性粒细胞增多、上皮结构被破坏、杯状细胞减少,LFD 组小鼠肠上皮结构和隐窝完整富含杯状细胞,没有炎症性细胞浸润或黏膜损伤,具有完整的肠上皮结构。黏液降解的增加可以作为IBD 的生物标记。由阿利新兰染色可知(图4C),与LFD 组相比,HSFD 干预组小鼠黏蛋白的分泌量明显减少,黏液层结构被破坏,这与杯状细胞大量损伤有关,黏液层的破坏会导致细菌穿透渗入,侵袭上皮细胞引起肠黏膜损伤[10]。结合以上结果可知,HSFD 的摄入会破坏结肠正常组织结构,导致肠上皮细胞损伤,影响结肠黏液层的生长速度和渗透性导致结肠黏液层迅速恶化。可能是肠道致病菌利用上皮细胞谱系、分泌酶降解黏液并破坏紧密连接结构,从而导致肠道完整性遭到破坏[19]。
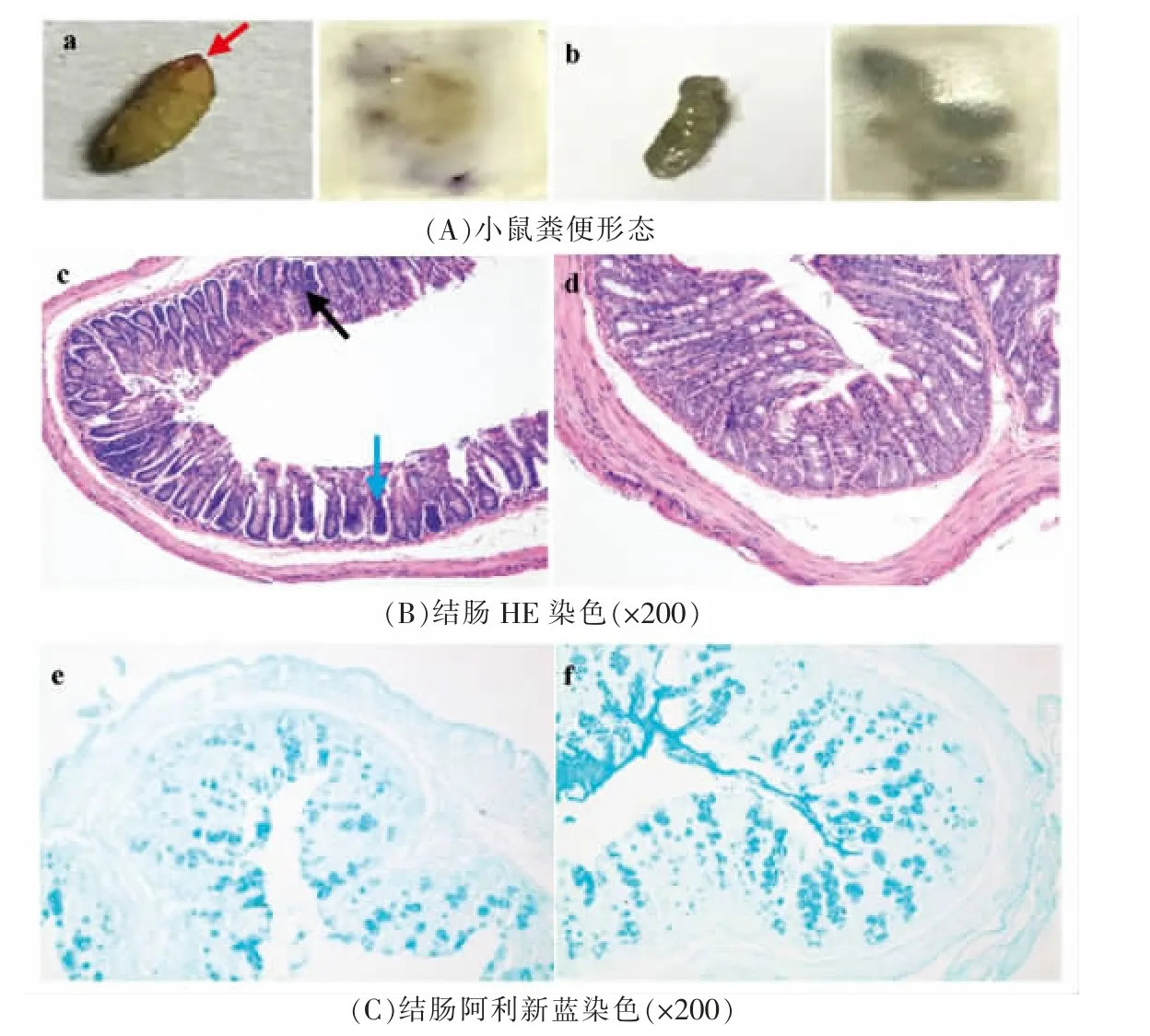
图4 高糖、高脂饮食对小鼠粪便形态及结肠上皮组织影响Fig.4 Influence of high-sugar and high-fat diet on fecal morphology and colonic epithelial tissue of mice
2.5 高糖、高脂饮食对结肠屏障相关蛋白表达的影响
作者研究发现HSFD 破坏肠上皮完整性,接下来探究相关紧密连接蛋白的表达是否会受到影响。肠道通透性的主要决定因素之一是细胞间紧密连接(TJs),能维持上皮细胞的完整性,同时发挥其屏障功能,防止肠腔内的致病菌进入肠道[19]。ZO 蛋白家族是最早被研究的蛋白,ZO-1 是紧密连接的骨架蛋白,呈蜂窝或点状均匀分布在肠上皮细胞周围,在TJs 中起核心连接作用。研究表明,ZO-1 表达的下降先于肠道炎症的发生,其表达的下调意味着TJs 功能极可能受到影响,而TJs功能障碍可能是IBD 发病的起始因素[20]。Occludin在TJs 的屏障功能和调控大分子物质进入肠道中起着重要作用,能维持和调节肠黏膜的通透性并抑制炎症因子的释放。MUC-2 由肠道上皮组织的杯状细胞分泌,遍布小肠和大肠,其水平降低可能与多种肠道疾病有关,敲除MUC-2 的小鼠会导致结肠炎的发生[21]。
为研究在蛋白表达水平上,HSFD 对肠道通透性的影响,对结肠相关蛋白进行了测定。如图5A所示,与LFD 对照组相比,HSFD 干预组ZO-1、Occludin、Muc-2 这3 种屏障蛋白基因的相对表达量均下调且差异显著(P<0.05)。HSFD 对小鼠结肠MUC-2 基因相对表达量的影响与阿利新蓝染色结果一致。免疫荧光结果如图5B 和图5C 所示,HSFD 干预组,这两种紧密连接蛋白表达出现明显减少,且结肠完整形态被破坏,LFD 组ZO-1、Occludin 蛋白排列整齐且表达量高,进一步证明HSFD 影响肠道相关紧密连接蛋白的表达,对小鼠肠道屏障具有一定的破坏性,肠道渗透性的增加,可能是由于过量的脂质积累导致内质网应激从而激活免疫细胞产生炎症反应引起的[19]。

图5 结肠组织中ZO-1、Occludin、MUC-2 基因相对表达量以及ZO-1、Occludin 免疫荧光蛋白染色及定量Fig.5 The relative expression of ZO-1,Occludin,and MUC-2 genes in colon tissue,as well as the staining and quantification of ZO-1 and Occludin immunofluorescent protein
2.6 高糖、高脂饮食对小鼠结肠组织炎症因子表达的影响
已经了解HSFD 的摄入会使机体产生炎症反应,接下来探究肠道部位的炎症因子表达情况。机体正常情况下免疫系统处于稳态,当受到外界干扰时,先天免疫信号会被激活。促炎因子与抑炎因子之间失衡会导致炎症的发生。白细胞介素对免疫细胞的增殖、分化起关键性作用。IL-10 又称细胞因子合成抑制因子,可激活JAK1/STAT3 通路,主要通过调节一些免疫细胞消除微生物的入侵来发挥抑炎作用,与UC 的发生有关[22]。肿瘤坏死因子TNF-α 是主要的炎症驱动因素之一,也是结肠炎发病机制中的一种重要促炎因子,它可以聚集中性粒细胞从而导致炎症的发生,在炎症性肠病的发生中起重要作用[23]。
作者从mRNA 以及蛋白水平方面测定小鼠结肠组织炎症因子。由图6a,RT-PCR 结果可知,与LFD 对照组相比,HSFD 干预组,IL-10 基因表达上调,差异极显著(P<0.01),TNF-α 基因水平也有一定的上调(P<0.05)。虽然IL-10 被认为是一种抗炎因子,但其功能是多方面的。研究表明它是饮食诱导肥胖中产热的一种特殊调节剂。因此HSFD 小鼠IL-10 的上调可能是HSFD 的二次反馈效应[24]。图6b,ELISA 法检测结肠组织,HSFD 干预组显著提高了TNF-α 水平(P<0.05),显著增加了IL-10 水平(P<0.01)。HSFD 干预会促进TNF-α抗炎因子的表达,抑制抑炎因子IL-10 的表达。这与肠道屏障功能失衡的实验结果相对应,HSFD 会引起小鼠肠道通透性增加,使得更多的炎症因子通过肠道屏障,进而引起肠道的炎症反应。

图6 高糖、高脂饮食对小鼠结肠组织炎症因子表达的影响Fig.6 The effect of high-sugar and high-fat diet on the expression of inflammatory factors in mouse colon
3 结论
随着健康意识的逐渐增强,合理及科学的饮食结构和生活方式逐渐受到人们的重视。长期的单一高糖、高脂饮食模式除了导致代谢综合征、糖尿病、神经系统疾病之外,还能增加IBD 的易感性。然而低脂饮食、生酮饮食和地中海饮食等被证明可以治疗肥胖和高脂血症,增强抵抗力减轻体内炎症反应[25-26]。本试验通过高糖、高脂干预以及低糖、低脂饮食作为对照,研究了高糖、高脂饮食对小鼠肥胖、肠道屏障功能、炎症水平以及结肠炎的影响,本次实验结果显示,高糖、高脂饮食在一定程度上会导致小鼠血脂异常、促炎因子分泌增多、肠道屏障被破坏,最终导致肠道炎症的发生,为日常合理膳食,选择结肠炎的治疗方向以及对IBD 患者的饮食干预提供了一定的理论指导。

