CVC1302通过小鼠骨髓源树突状细胞对免疫反应的调控
侯立婷, 于晓明, 杜露平, 张元鹏, 程海卫, 陈 瑾, 郑其升, 侯继波
(1.江苏省农业科学院动物免疫工程研究所,江苏 南京 210014;2.江苏省农业科学院国家兽用生物制品工程技术研究中心,江苏 南京 210014;3.兽用生物制品<泰州>国泰技术创新中心,江苏 泰州 225300;4.省部共建国家重点实验室培育基地——江苏省食品质量安全重点实验室,江苏 南京 210014)
有研究结果表明,免疫增强剂CVC1302能够显著提高O型口蹄疫灭活疫苗的免疫效力[1]。一些病原相关分子模式受体激动剂及细胞因子可作为免疫增强剂的首选来调节机体反应,对先天免疫和适应性免疫反应具有重要的影响[2-3]。有研究结果证实,CVC1302能够引起机体产生长效体液免疫反应,并且在注射部位通过诱导高水平的趋化因子来招募抗原递呈细胞[4]。
树突状细胞(Dentritic cells,DC)不仅能摄取、加工处理和递呈抗原,还能释放多种细胞因子,有效激活T淋巴细胞,具有启动免疫反应和诱导免疫耐受的双向免疫调节作用[5-6]。DC具有未成熟DC和成熟DC 2种形式,未成熟的DC对抗原的内吞、加工处理能力较强;成熟的DC具有较强的抗原递呈能力[7]。近年来,国内外研究者利用GM-CSF、IL-4、Flt3等细胞因子成功诱导分化小鼠骨髓源树突状细胞[8-9]。骨髓源DC的体外诱导技术相对成熟,在免疫增强剂的筛选、抗原递呈及免疫激活相关领域已被广泛应用。
CVC1302诱导机体产生长效体液免疫反应与抗原递呈细胞的招募有关,但在体外该增强剂是否同样具有活化T淋巴细胞的能力呢?本研究拟利用重组鼠源粒细胞/巨噬细胞集落刺激因子(Recombinant mouse granulocyte-macrophage colony-stimulating factor,rm GM-CSF)诱导分化出骨髓源DC,以骨髓源DC为模型,在体外评价免疫增强剂CVC1302对DC激活、抗原的递呈及T淋巴细胞活化的作用,进一步分析机体产生长效体液免疫反应与DC有效激活的相关性,以期为免疫增强剂的筛选提供有效方法,为免疫增强剂的免疫效力评价奠定基础。
1 材料与方法
1.1 试验材料
8周龄的健康雌性C57BL/6小鼠购自扬州大学比较医学中心;RPMI-1640培养基、胎牛血清(FBS)购自Gibco公司;红细胞裂解液购自白鲨生物科技有限公司;rm GM-CSF购自Peprotech公司;流式抗体Anti-mouse CD11b PerCP-Cyanine5.5、Anti-mouse CD11c FITC、Anti-mouse MHCⅠAPC、Anti-mouse CD80 APC、Anti-mouse CD40 APC、Anti-mouse MHCⅡAPC、Anti-mouse CD86 APC、Anti-mouse CD3 FITC 购自BD Biosciences公司;鸡卵清白蛋白(OVA)、异硫氰酸荧光素(FITC)标记的鸡卵清白蛋白(FITC-OVA)购自北京索莱宝科技有限公司;小鼠干扰素γ(IFN-γ)检测试剂盒购自南京奥青生物技术有限公司;免疫增强剂CVC1302由江苏省农业科学院动物免疫工程研究所动物疫苗免疫技术创新团队提供。
1.2 C57BL/6小鼠骨髓源DC的分离诱导及鉴定
取C57BL/6小鼠断颈处死,置于75%乙醇内浸泡5 min,摘取小鼠的股骨、胫骨,剪去骨头两端,用5 ml注射器吸取5 ml磷酸盐缓冲液(PBS),接着将5 ml注射器插入骨髓腔进行反复冲洗直至骨变白。将骨髓反复吹吸直至细胞完全分散,将其过无菌200目滤网后移至15 ml离心管中,1 500 r/min、5 min,取细胞,加到红细胞裂解液中,轻轻混匀,室温下作用5 min,离心,弃上清液,加入5 ml RPMI-1640培养基清洗1次沉淀,离心收集细胞进行计数。细胞密度调整为1 ml 3×105个,置于6孔板中,1个孔4 ml,加入质量浓度为10 ng/ml的rm GM-CSF进行培养,第3 d置换培养基,每天用倒置显微镜观察细胞形态,培养至第7 d时,收获半悬浮及疏松贴壁细胞,用抗鼠CD11c-FITC、CD11b-PE-cy5.5染色后经流式细胞术鉴定DC的纯度。
1.3 DC表面分子MHC I、MHC II、CD40、CD80、CD86的表达
用RPMI-1640培养基调整未成熟骨髓源DC的细胞密度为1 ml 1×106个,接种于6孔板中,加入CVC1302进行刺激。同时设置PBS对照组,于细胞培养箱中培养16 h后,收集细胞,分别加入CD11c-FITC、APC-MHCⅠ、APC-MHCⅡ、APC-CD40、APC-CD80、APC-CD86抗体,置于4 ℃条件下,避光温育30 min后,上机检测并分析结果。
1.4 DC对鸡卵清白蛋白抗原递呈能力的检测
用RPMI-1640培养基调整未成熟骨髓源DC的细胞密度为1 ml 5×105个,接种于6孔板中(装有细胞爬片),培养至第7 d,挑取爬片置于24孔板,用预冷的PBS清洗2遍,加入RPMI-1640培养基,每孔加入1 ml含CVC1302+OVA-FITC或OVA-FITC的预热RPMI-1640培养基。孵育60 min后,用预冷的PBS清洗2遍,加入80%丙酮固定10 min,用预冷的PBS清洗2遍,封片,观察。
1.5 CVC1302对T淋巴细胞的活化
无菌条件下采集小鼠脾脏,分离T淋巴细胞,用RPMI-1640培养基调整T淋巴细胞的细胞密度约为1 ml 4×106个。取分离诱导第7 d的DC,调整细胞密度为1 ml 1×106个,接种于6孔板中,每孔加入1 ml含CVC1302+OVA或OVA的预热RPMI-1640培养基,孵育16 h后收集细胞,调整细胞密度为1 ml 1×106个。分别取100 μl脾脏淋巴细胞和DC置于96孔板共培养3 d后半数换液,同时在培养基中添加佛波醇酯类多克隆刺激剂(PMA)和离子霉素,终质量浓度分别为50.0 ng/ml和0.5 μg/ml,培养18 h后分别收集细胞和上清液,细胞中加入CD3-FITC抗体,置于4 ℃条件下,避光孵育30 min,细胞清洗3遍后,用流式细胞仪检测并分析结果。用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)试剂盒检测上清液中IFN-γ的分泌水平。
2 结果与分析
2.1 C57BL/6小鼠骨髓源DC形态及鉴定
每只C57BL/6小鼠中分离到的骨髓细胞有1 ml 2×107~5×107个,添加rm GM-CSF进行诱导分化。在诱导的当天与诱导第3 d、第7 d利用倒置显微镜观察细胞形态,结果(图1)表明,诱导当天,细胞呈现规则形态,体积较小,圆形,悬浮于细胞培养基中(图1A);诱导第3 d时,细胞呈现不规则形态,可观察到明显的细胞聚集,集落较小,聚集成团生长的细胞数量明显增多(图1B);诱导第7 d时,细胞团体积增大,形态不规则,有毛刺状突起,形成明显的集落细胞团(图1C)。收集诱导第7 d的DC,经流式细胞仪检测分析,分离诱导的细胞为树突状细胞,并且cDC1(CD11c+CD11b-)的比例为21.3%,cDC2(CD11c+CD11b+)的比例为48.4%(图1D),二者占淋巴细胞的比例具有极显著差异(P<0.001)(图1E)。
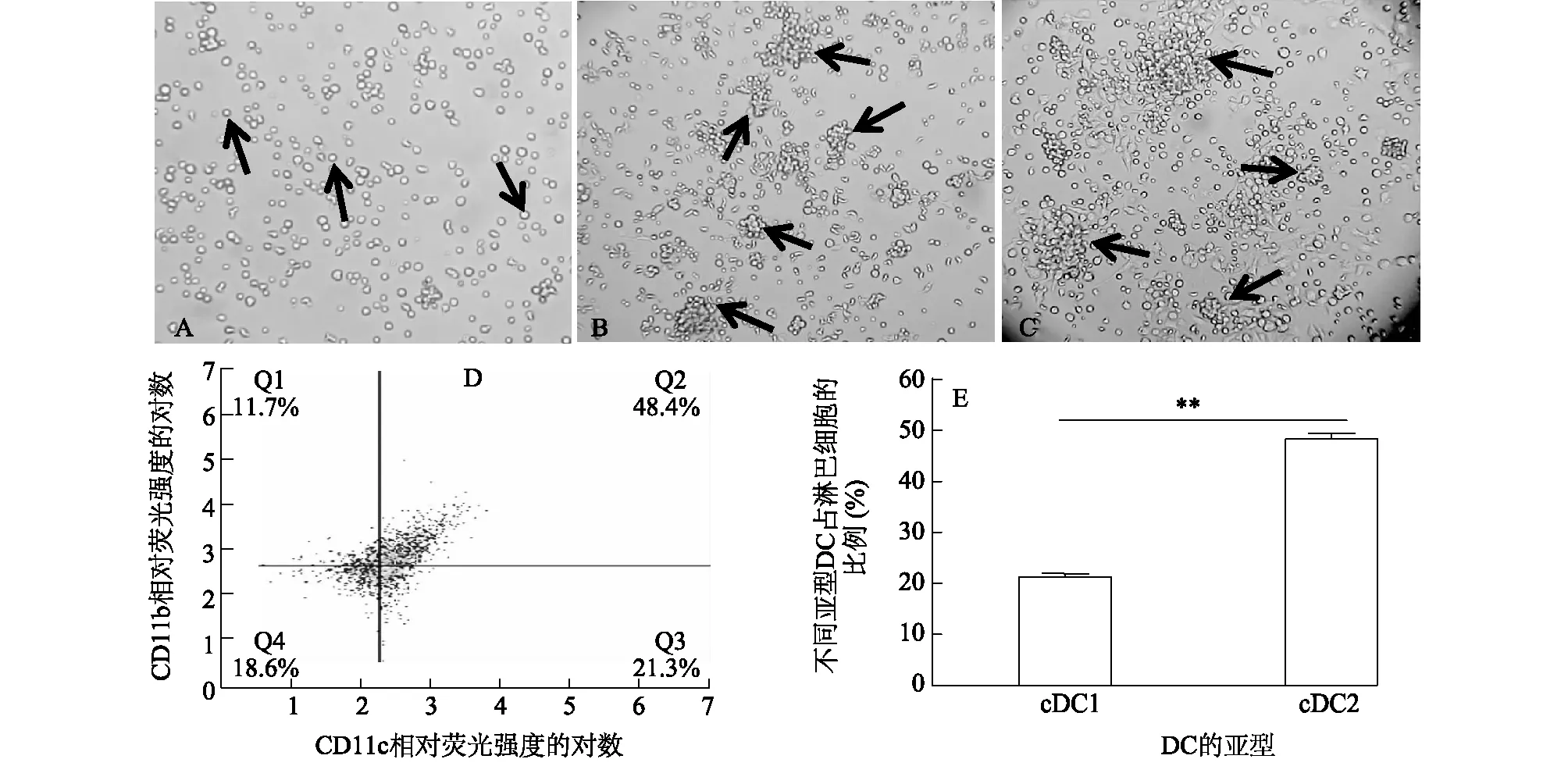
A:重组鼠源粒细胞/巨噬细胞集落刺激因子(rm GM-CSF)诱导当天的细胞形态(×200);B:rm GM-CSF诱导第3 d时的细胞形态(×200);C:rm GM-CSF诱导第7 d时的细胞形态(×200);D:树突状细胞的流式分析结果;E:不同亚型DC的对比分析图。DC:树突状细胞。**:不同亚型树突状细胞占淋巴细胞的比例差异极显著(P<0.01)。Q1~Q4表示象限。
2.2 DC表面分子鉴定
成熟的DC表面高表达MHCⅠ、MHCⅡ及共刺激分子CD40、CD80、CD86,利用流式细胞术检测CVC1302对DC表面分子MHCⅠ、MHCⅡ、CD40、CD80、CD86的表达情况。本研究设置添加CVC1302的试验组和PBS对照组。图2显示,在CVC1302试验组中,CD11c+MHCⅠ+的占比为66.50%,CD11c+MHCⅡ+的占比为65.10%,CD11c+CD40+的占比为20.20%,CD11c+CD80+的占比为55.90%,CD11c+CD86+的占比为41.00%,其表面分子的表达水平都显著或极显著高于PBS对照组。试验结果表明CVC1302能够上调小鼠骨髓源DC表面分子的表达,刺激DC的成熟。
2.3 DC对OVA抗原递呈能力的检测
DC是专职的抗原递呈细胞,能够激发免疫应答。利用超高分辨率显微镜检测CVC1302对DC递呈OVA抗原的影响,对荧光的数量和强度进行分析,结果(图3)表明,CVC1302-OVA组的荧光强度高于OVA对照组,说明CVC1302能够促进DC对OVA抗原的递呈,调节机体的免疫应答反应。

A:OVA对照组;B:CVC1302-OVA组。
2.4 T淋巴细胞活化检测
T淋巴细胞增殖分化为效应性T淋巴细胞,进而促进机体免疫反应,IFN-γ的分泌是T淋巴细胞活化的标志之一。分别利用流式细胞术和ELISA方法,检测T淋巴细胞的活化数量及IFN-γ分泌水平。图4显示,将刺激成熟的DC与T淋巴细胞共培养后,CVC1302-OVA组的T淋巴细胞的活化数量为1 ml (3.84±0.24)×105个,IFN-γ分泌含量为(181.400±8.165) pg/ml,OVA组的T淋巴细胞的活化数量为1 ml (1.91±0.19)×105个,IFN-γ分泌含量为(46.780±1.136) pg/ml,CVC1302-OVA组的T淋巴细胞活化数量及IFN-γ分泌含量均极显著高于OVA组(P<0.01),表明CVC1302能够促进T淋巴细胞的活化。
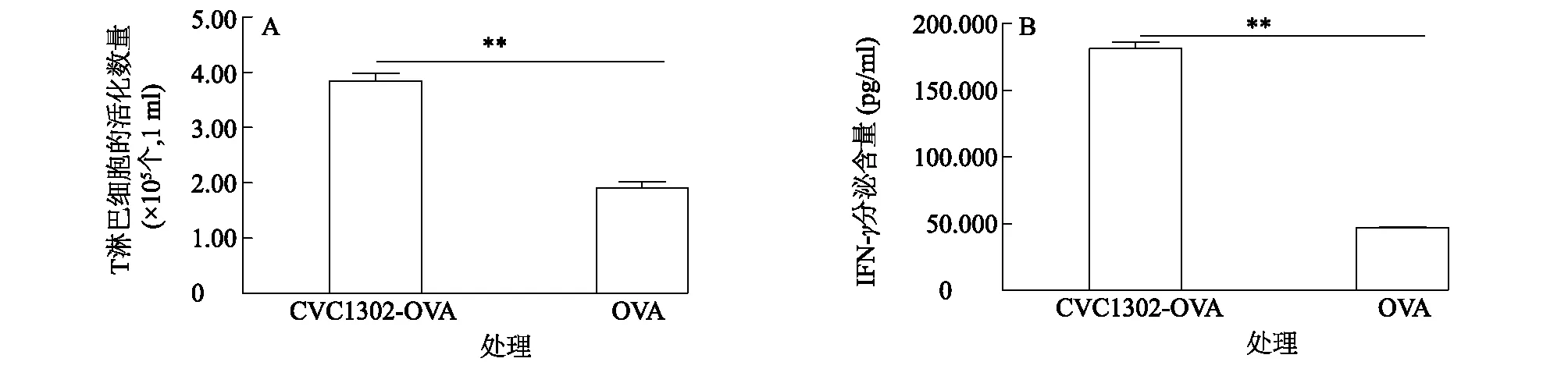
A:T淋巴细胞的活化数量;B:IFN-γ的分泌水平。**:不同处理间差异极显著(P<0.01)。OVA:鸡卵清白蛋白。
3 讨论
DC作为机体免疫应答的启动者,对机体的免疫防御具有重要作用[10]。近年来,随着众多学者对DC研究的深入,发现其在抗肿瘤、过敏性免疫反应、疫苗佐剂及免疫增强剂研究等方面都具有重要的作用[11-12]。经典的DC分为cDC1和cDC2 2个亚群,cDC1和cDC2对于T淋巴细胞的激活至关重要[13-15]。有研究结果表明,利用Flt3、GM-CSF和IL-4能够诱导分化小鼠骨髓源DC,并且无论是成熟还是未成熟的DC,CD11c的表达均为阳性[16]。本研究经过摸索,通过体外分离小鼠骨髓源细胞,利用rm GM-CSF刺激诱导的细胞具有典型的DC形态特征,与韦莉等[17]研究结果一致。流式细胞仪检测结果表明,培养的细胞为DC,并且cDC1和cDC2亚群都占有一定的比例,这为后续研究体液和细胞免疫反应机理提供了体外模型。
免疫增强剂的研发是快速提高疫苗免疫效力的有效手段之一。近几年,笔者所在实验室系统阐明了免疫增强剂CVC1302介导长效体液免疫应答的机理,证明CVC1302是一种安全、有效的免疫增强剂[18-19]。经CVC1302刺激后,成熟的DC高表达MHCⅠ、MHCⅡ及共刺激分子CD40、CD80、CD86。DC表面分子表达水平的显著提升能更加有效地触发效应T淋巴细胞的激活,在共刺激信号的作用下增殖、分化,分泌更多抗病原体细胞因子(IFN-γ和TNF-α),从而更加有效地提升机体抵抗病原体的能力,并且T淋巴细胞分泌的IFN-γ有利于进一步介导抗原的递呈过程[20-21]。本研究结果证实了免疫增强剂CVC1302对DC表面分子表达水平有明显提升作用,添加CVC1302后,DC对OVA抗原的递呈也增多,并且CVC1302激活后的DC能促进T淋巴细胞的活化。本研究结果表明,免疫增强剂CVC1302在体外同样具有促进T淋巴细胞活化的功能,这与前期体内的研究结果[18]相一致。
综上所述,本研究成功建立了C57BL/6小鼠骨髓源DC的稳定培养方法,并对其表型进行有效的鉴定;体外试验结果证实了免疫增强剂CVC1302能够促进DC的活化,进一步有效活化T淋巴细胞。本研究结果为后续新型免疫增强剂的筛选及评价提供了参考。

