重症新型冠状病毒感染及其预后的预测指标
段丹丹
山东第一医科大学第三附属医院呼吸与危重症医学科,山东 济南 250031
2019 年底首次出现的冠状病毒肺炎(coronavirus disease 2019, COVID-19)具有较高的病死率[1]。2020 年1 月7 日,中国疾病预防控制中心从患者喉咙拭子中发现了一种新型β-冠状病毒[2],命名为SARS-CoV-2。2021 年11 月在南非首次发现SARS-CoV-2的变异株奥密克戎[3],奥密克戎成为目前主要的新冠感染致病株。虽然奥密克戎致病性较前期变异株致病力有所减弱,但研究发现奥密克戎感染患者的总加重比例高达13.08%[4]。鉴于COVID-19 传播迅速,突变频繁且新冠病毒感染患者特别是在重症患者中死亡率仍然较高,因此迫切需要继续完善和丰富其临床诊疗研究。本研究旨在探讨重症COVID-19及其预后的预测指标。
1 资料与方法
1.1 研究对象
纳入2022年12月1日至2023年3月31日于山东第一医科大学第三附属医院住院治疗的178 例COVID-19确诊患者,其中女性患者72例,男性患者106 例。研究对象纳入标准包括:(1)年龄 > 18 岁。(2)2022 年12 月1 日至2023 年1 月5 日COVID-19确诊标准符合《新型冠状病毒感染诊疗方案(试行第九版)》,即COVID-19 核酸检测阳性或未接种COVID-19 疫苗者COVID-19 特异性IgM 抗体和IgG抗体均为阳性[5];2023年1月6日至2023年3月31日COVID-19确诊标准符合《新型冠状病毒感染诊疗方案(试行第十版)》[6],即具有COVID-19的相关临床表现;COVID-19 核酸检测阳性或COVID-19 抗原检测阳性或COVID-19 分离、培养阳性或恢复期COVID-19 特异性IgG 抗体水平为急性期4 倍或以上升高。(3)有完整的临床资料。排除标准包括:有慢性肾功能衰竭史、慢性肝病史、不遵医嘱请假、转诊至医疗机构和入院24 h内死亡的患者。
1.2 研究方法
1.2.1 研究对象分组 将所有研究对象分为重症组(50例)与非重症组(128例)。分组标准分为2个时间段,分别为:(1)2022年12月1日至2023年1月5日重症组依据《新型冠状病毒感染诊疗方案(试行第九版)》中的重型标准[5],即成人符合下列任何一条:出现气促,呼吸频率 ≥ 30次/分;静息状态下,吸空气时指氧饱和度 ≤ 93%;氧合指数≤ 300 mmHg(1 mmHg = 0.133 kPa);临床症状进行性加重,肺部影像学显示24 ~ 48 h内病灶明显进展 > 50%者。非重症组依据《新型冠状病毒感染诊疗方案(试行第九版)》中的轻型和普通型标准,轻型:临床症状轻微,影像学未见肺炎表现;普通型:具有临床表现,影像学可见肺炎表现[5]。(2)2023年1月6日至2023年3月31日的重症组依据《新型冠状病毒感染诊疗方案(试行第十版)》中的重型和危重型标准,重型包括符合下列任何一条且不能以COVID-19 感染以外的其他原因解释:出现气促,呼吸频率 ≥ 30次/分;静息状态下,吸空气时指氧饱和度 ≤ 93%;氧合指数 ≤ 300 mmHg;临床症状进一步加重,肺部影像学显示24 ~ 48 h内病灶明显进展 > 50%。危重型包括符合以下情况之一者:出现呼吸衰竭,且需要机械通气;出现休克;合并其他器官功能衰竭需ICU监护治疗[6];非重症组依据《新型冠状病毒感染诊疗方案(试行第十版)》中的轻型和中型标准,轻型:以上呼吸道感染为主要表现,如咽干、咽痛、咳嗽、发热等。中型:持续高热 > 3 d或(和)咳嗽、气促等,但呼吸频率 < 30次/分,静息状态下吸空气时指氧饱和度 > 93%,影像学可见特征性COVID-19感染肺炎表现[6]。以入院后第7天患者的存活或死亡状态作为时间节点,将重症组患者分为死亡组(16例)与存活组(34例)。
1.2.2 研究对象一般临床特征 从医院信息系统中收集患者的伴随疾病,包括高血压病、冠心病及糖尿病;一般临床症状,包括胸闷、发热、咳嗽、乏力、肌肉酸痛及恶心呕吐。
1.2.3 研究对象实验室指标及影像检查 所有患者入院第1 天行胸部CT 检查,采集血液样本,并在实验室用标准方法进行分析。实验室检查指标包括高敏肌钙蛋白T、肌红蛋白、肌酸激酶同工酶(creatine kinase isoenzyme, CK-MB)、降钙素原(procalcitonin, PCT)、C 反应蛋白(C-reactive protein, CRP)、D-D 二聚体、白细胞计数、中性粒细胞计数、血小板、淋巴细胞绝对值、血红蛋白、白蛋白、尿素氮(urea nitrogen, BUN)、肌酐、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、乳酸脱氢酶(lactate dehydrogenase, LDH)。通过中性粒细胞计数及淋巴细胞计数计算得出中性粒细胞与淋巴细胞计数比值(neutrophil/lymphocyte count ratio, NLR)。
1.3 统计学处理
数据分析使用SPSS 22.0软件,以±s(符合正态分布的计量资料)、M(P25,P75)(符合偏态分布的计量资料)及例数(百分比)(计数资料)表示各数据。采用t检验、Mann-whitneyU检验、Fisher 精确检验及χ2检验进行COVID-19 重症组与非重症组,重症组中死亡组与存活组之间数据比较;采用多因素logistic回归模型分析重症COVID-19及其预后的独立危险因素,检验水准α= 0.05。考虑到本研究重症患者为50例,重症患者中死亡人数为16例,为防止模拟过拟合,需选取部分在单因素logistic回归结果中差异有统计学意义的变量进行重症COVID-19 及其死亡风险的多因素logistic 回归分析。由于P值越小,参与比较的2 组研究对象之间存在差异的可能性越大,2 组比较的差异越强,因此,本研究在重症COVID-19单因素logistic分析差异有统计学意义的指标中,选取P值相对于其他变量更小的5个变量(即LDH、NLR、CRP、白蛋白和白细胞)进行重症COVID-19 多因素logistic 回归分析。在重症COVID-19 患者住院死亡相关危险因素的单因素logistic 分析差异有统计学意义的指标中,选取P值相对于其他变量更小的2 个变量(即BUN 和LDH)进行重症COVID-19患者住院死亡相关危险因素的多因素logistic 回归分析。通过测量受试者工作特征曲线(receiver operating characteristic curve, ROC)下面积来评估各指标对重症COVID-19及其预后的预测价值,通过计算约登指数得到相应阈值。
2 结 果
2.1 COVID-19 重症组与非重症组一般临床特征比较
共有178例COVID-19患者纳入研究,其中非重症组患者128 例,重症组患者50 例。研究结果显示,非重症组年龄76(68.00, 86.00)岁显著低于重症组83(74.00, 89.25)岁(P< 0.05)。两组在发热、咳嗽、肌肉酸痛等症状方面差异具有统计学意义(P< 0.05)(表1)。重症组与非重症组COVID-19患者的胸部CT表现见图1。
表2 新型冠状病毒感染重症组与非重症组实验室指标比较[M(P25,P75)/ ( ± s)]
变量高敏肌钙蛋白T/(ng/L)肌红蛋白/(ng/mL)肌酸激酶同工酶/(ng/mL)降钙素原/(ng/mL)C反应蛋白/(mg/L)D-D二聚体/[mg/L(FEU)]白细胞/( × 109L-1)中性粒细胞绝对值/( × 109L-1)血小板/( × 109L-1)淋巴细胞绝对值/( × 109L-1)血红蛋白/(g/L)白蛋白/(g/L)血尿素氮/(mmol/L)肌酐/(μmol/L)谷丙转氨酶/(U/L)谷草转氨酶/(U/L)乳酸脱氢酶/(U/L)中性粒细胞/淋巴细胞计数所有患者(n = 178)17.750(10.203, 36.650)41.300(25.775, 83.705)1.545(1.018, 2.618)0.067(0.038, 0.179)24.375(6.573, 74.253)1.180(0.560, 2.715)6.070(4.240, 8.175)4.295(2.660, 6.485)188.000(144.500, 242.000)0.915(0.640, 1.280)124.000(109.000, 137.000)32.750 ± 6.1341 5.600(4.175, 9.025)68.000(55.000, 88.250)16.650(10.900, 28.025)22.450(15.075, 30.650)218.500(175.000, 277.250)4.048(2.533 ~ 8.574)非重症组(n = 128)15.385(9.615, 30.323)36.435(22.745, 62.823)1.395(0.995, 2.140)0.050(0.034, 0.107)19.315(4.653, 56.800)0.875(0.463, 2.140)5.475(3.723, 6.955)3.720(2.428, 5.343)188.000(143.500, 250.000)0.950(0.732, 1.288)123.500(107.250, 136.000)34.003 ± 6.0083 5.000(4.000, 7.375)67.000(55.000, 82.000)15.750(10.750, 26.850)21.390(14.525, 28.800)209.500(174.000, 253.000)3.390(2.390, 5.905)重症组(n = 50)35.430(17.963, 49.075)77.685(39.473, 141.225)2.560(1.263, 4.995)0.1659(0.076, 0.480)72.145(23.158, 146.395)2.340(0.847, 5.533)8.240(5.425, 12.133)6.800(4.630, 10.828)189.500(144.500, 234.000)0.730(0.408, 1.133)124.000(111.000, 139.250)29.542 ± 5.2681 7.400(5.200, 10.800)72.000(54.000, 101.500)18.350(11.075, 34.575)23.750(18.325, 48.775)280.000(198.000, 445.250)9.590(4.812, 20.511)t/Z−4.430−4.970−3.690−5.230−4.570−3.860−5.050−5.330−5.790−2.920−0.410 4.600−3.400−0.960−1.270−2.100−4.380−5.440 P< 0.001< 0.001< 0.001< 0.001< 0.001< 0.001< 0.001< 0.001 0.428 0.003 0.685< 0.001 0.001 0.337 0.203 0.036< 0.001< 0.001
2.2 COVID-19 重症组与非重症组实验室指标比较
重症组高敏肌钙蛋白T、肌红蛋白、PCT、CRP、D-D二聚体、白细胞计数、中性粒细胞计数、CK-MB、淋巴细胞计数、BUN、NLR、AST 及LDH 高于非重症组;而白蛋白水平与之相反,非重症组高于重症组,差异均具有统计学意义(P< 0.05)。两组之间血小板、血红蛋白、血肌酐及ALT 水平差异无统计学意义(P> 0.05)。
2.3 重症COVID-19相关危险因素分析
单因素logistic 回归分析结果显示,与重症COVID-19 相关的危险因素包括年龄、发热、肌红蛋白、CK-MB、PCT、D二聚体、白细胞计数、中性粒细胞计数、BUN、AST、LDH 及NLR(P< 0.05)。通过多因素logistic回归分析结果发现,与重症COVID-19相关的独立危险指标为LDH(OR= 1.01,95%CI1.00 ~1.01,P< 0.001),NLR(OR= 1.06,95%CI1.00 ~1.12,P= 0.040)(表3,4)。
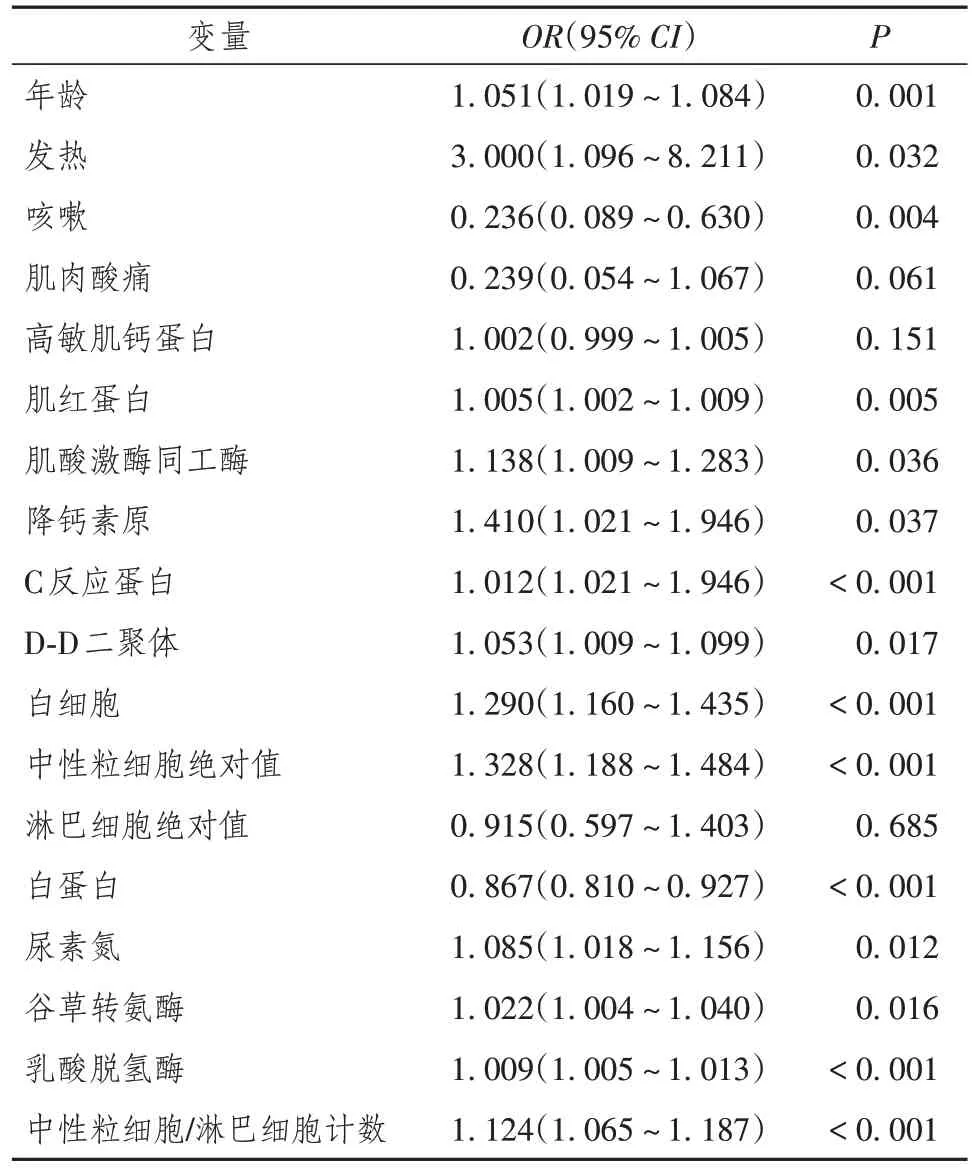
表3 重症新型冠状病毒感染单因素logistic回归分析
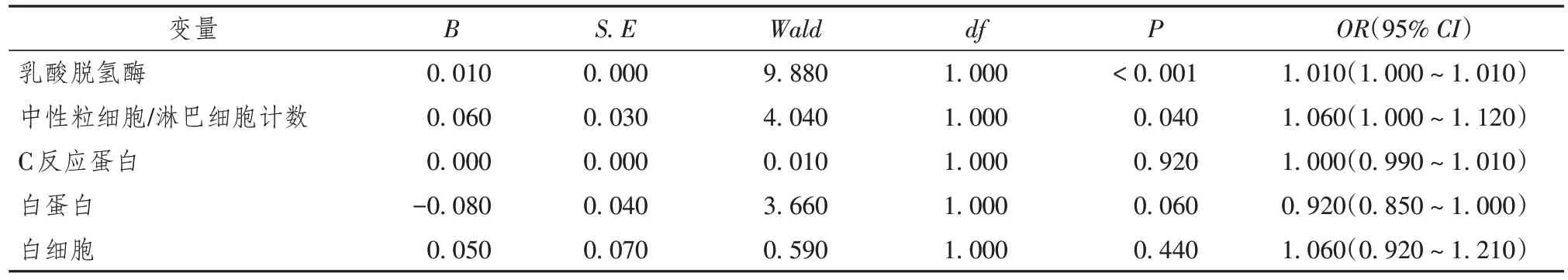
表4 重症新型冠状病毒感染多因素logistic回归分析
2.4 重症COVID-19的预测指标
ROC分析结果显示,LDH、NLR能够显著预测重症COVID-19,AUC 分别为0.71 (95%CI0.615 ~0.808)、0.76 (95%CI0.672 ~ 0.853)。LDH、DLR 的临界值分别为256.5 U/L(敏感性,62%;特异性,80%),6.57(敏感性,68%;特异性,81%)(表5,图2,3)。
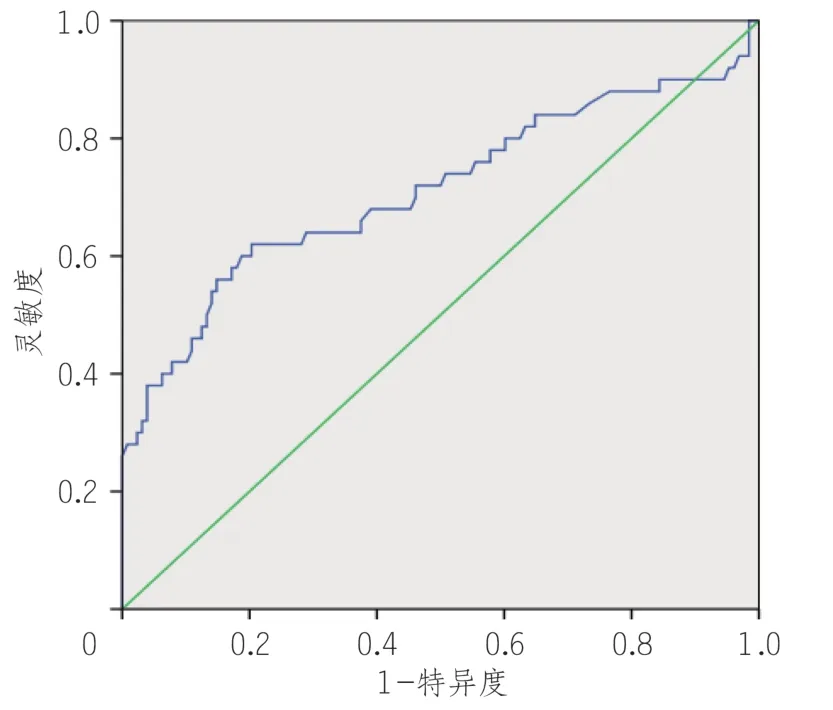
图2 乳酸脱氢酶预测重症新型冠状病毒感染风险的ROC曲线
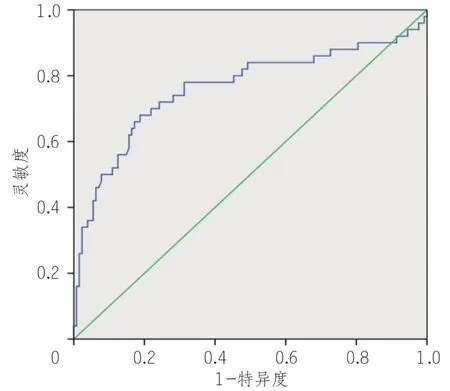
图3 中性粒细胞/淋巴细胞计数比值预测重症新型冠状病毒感染风险的ROC曲线

表5 预测重症新型冠状病毒感染的受试者工作特征曲线
2.5 重症COVID-19 患者死亡组与存活组的一般临床特征比较
重症患者存活组与死亡组患者年龄、性别、临床表现等一般临床特征差异无统计学意义(P>0.05)(表6)。
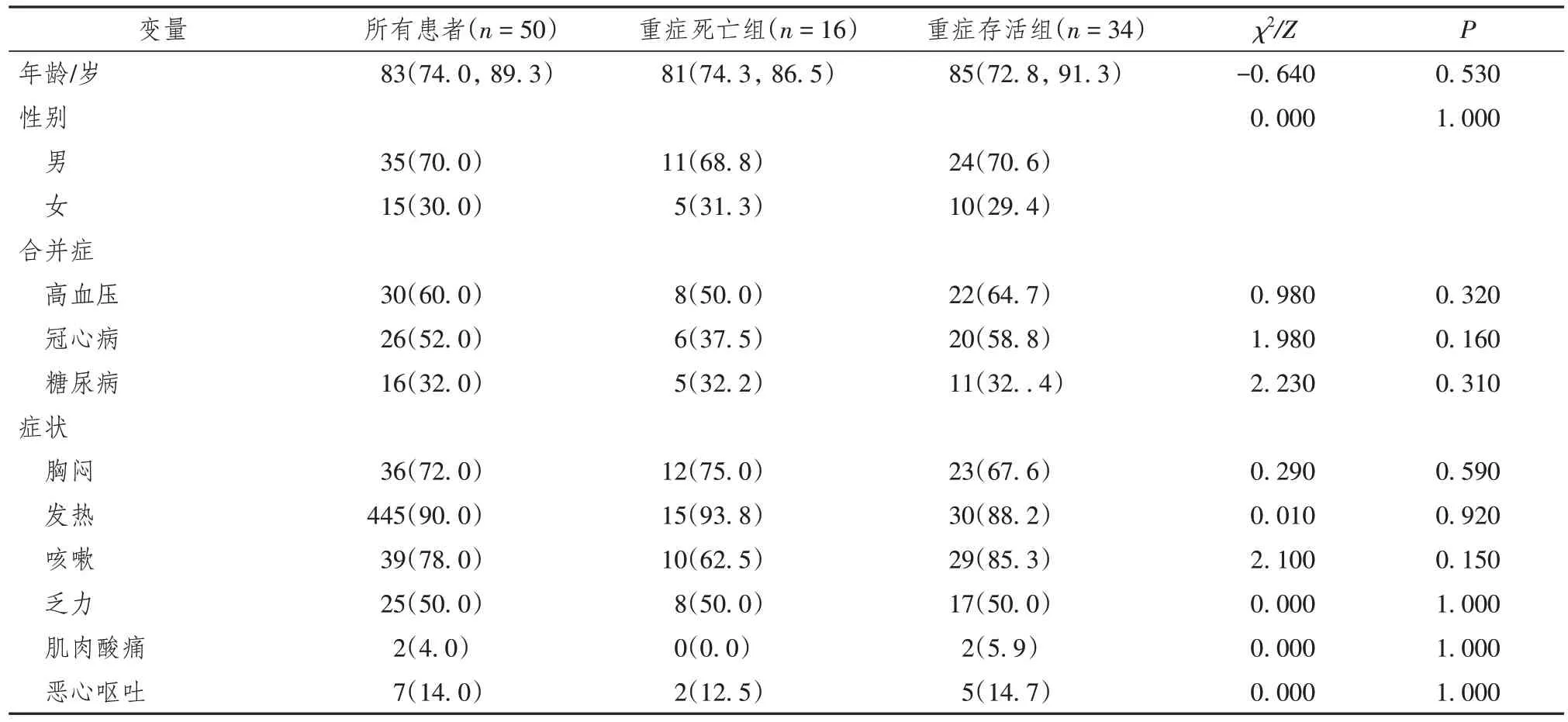
表6 重症新型冠状病毒感染患者死亡组与存活组临床特征比较[M(P25,P75)/ n(%)]
2.6 重症COVID-19 患者死亡组与存活组实验室指标比较
重症COVID-19 死亡组高敏肌钙蛋白T、肌红蛋白、PCT、D-D 二聚体、中性粒细胞绝对值、BUN、肌酐、AST、LDH 及NLR 显著高于重症存活组,差异均有统计学意义(P< 0.05),而重症死亡组淋巴细胞计数水平显著低于重症存活组(P<0.05)(表7)。
表7 重症新型冠状病毒感染患者死亡组与存活组实验室指标比较[M(P25,P75)/ ( ± s)]
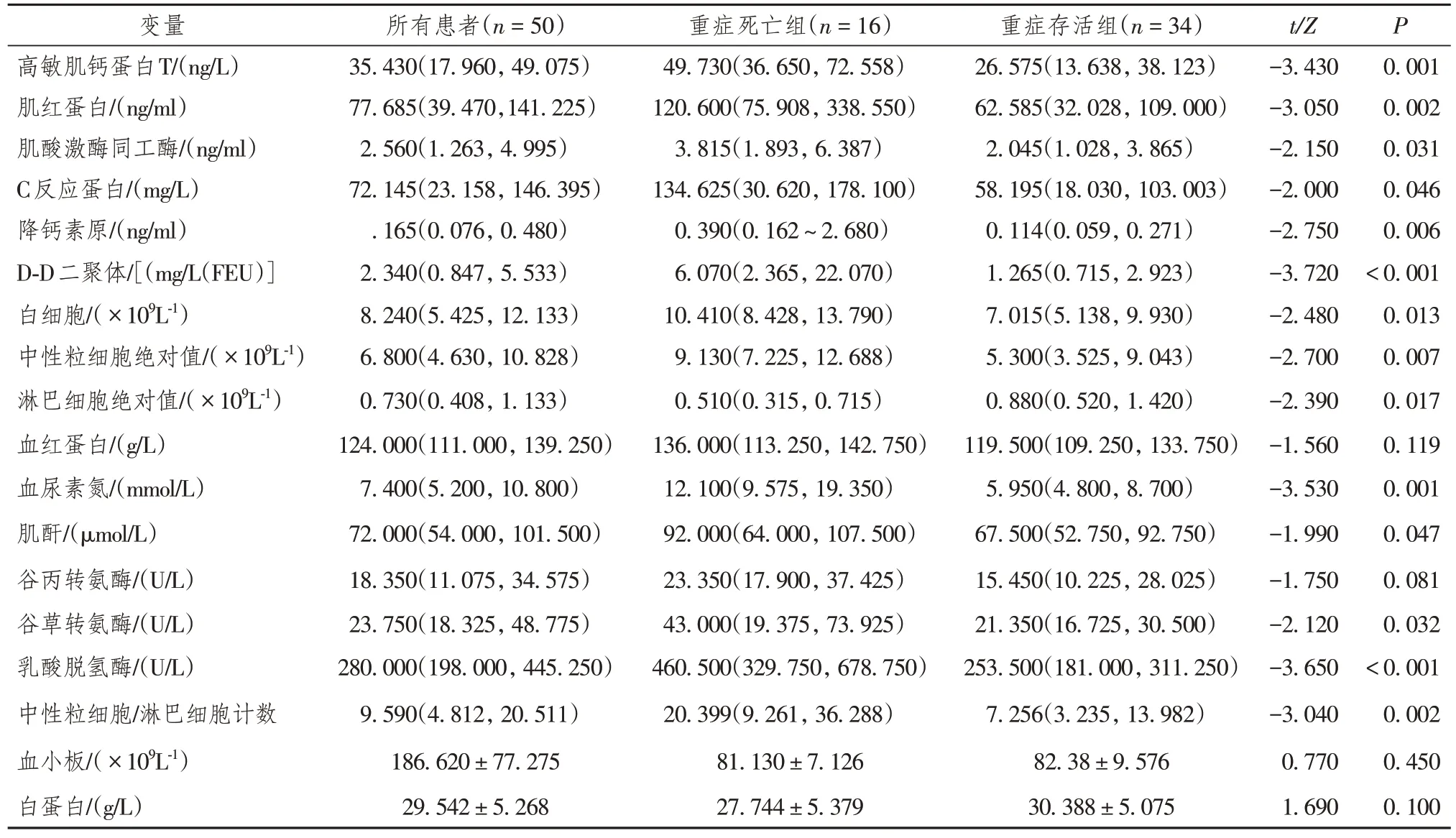
表7 重症新型冠状病毒感染患者死亡组与存活组实验室指标比较[M(P25,P75)/ ( ± s)]
变量高敏肌钙蛋白T/(ng/L)肌红蛋白/(ng/ml)肌酸激酶同工酶/(ng/ml)C反应蛋白/(mg/L)降钙素原/(ng/ml)D-D二聚体/[(mg/L(FEU)]白细胞/( × 109L-1)中性粒细胞绝对值/( × 109L-1)淋巴细胞绝对值/( × 109L-1)血红蛋白/(g/L)血尿素氮/(mmol/L)肌酐/(μmol/L)谷丙转氨酶/(U/L)谷草转氨酶/(U/L)乳酸脱氢酶/(U/L)中性粒细胞/淋巴细胞计数血小板/( × 109L-1)白蛋白/(g/L)所有患者(n = 50)35.430(17.960, 49.075)77.685(39.470,141.225)2.560(1.263, 4.995)72.145(23.158, 146.395).165(0.076, 0.480)2.340(0.847, 5.533)8.240(5.425, 12.133)6.800(4.630, 10.828)0.730(0.408, 1.133)124.000(111.000, 139.250)7.400(5.200, 10.800)72.000(54.000, 101.500)18.350(11.075, 34.575)23.750(18.325, 48.775)280.000(198.000, 445.250)9.590(4.812, 20.511)186.620 ± 77.275 29.542 ± 5.268重症死亡组(n = 16)49.730(36.650, 72.558)120.600(75.908, 338.550)3.815(1.893, 6.387)134.625(30.620, 178.100)0.390(0.162 ~ 2.680)6.070(2.365, 22.070)10.410(8.428, 13.790)9.130(7.225, 12.688)0.510(0.315, 0.715)136.000(113.250, 142.750)12.100(9.575, 19.350)92.000(64.000, 107.500)23.350(17.900, 37.425)43.000(19.375, 73.925)460.500(329.750, 678.750)20.399(9.261, 36.288)81.130 ± 7.126 27.744 ± 5.379重症存活组(n = 34)26.575(13.638, 38.123)62.585(32.028, 109.000)2.045(1.028, 3.865)58.195(18.030, 103.003)0.114(0.059, 0.271)1.265(0.715, 2.923)7.015(5.138, 9.930)5.300(3.525, 9.043)0.880(0.520, 1.420)119.500(109.250, 133.750)5.950(4.800, 8.700)67.500(52.750, 92.750)15.450(10.225, 28.025)21.350(16.725, 30.500)253.500(181.000, 311.250)7.256(3.235, 13.982)82.38 ± 9.576 30.388 ± 5.075 t/Z−3.430−3.050−2.150−2.000−2.750−3.720−2.480−2.700−2.390−1.560−3.530−1.990−1.750−2.120−3.650−3.040 0.770 1.690 P 0.001 0.002 0.031 0.046 0.006< 0.001 0.013 0.007 0.017 0.119 0.001 0.047 0.081 0.032< 0.001 0.002 0.450 0.100
2.7 重症COVID-19患者住院死亡相关危险因素
单因素logistic回归分析结果显示,重症COVID-19患者中,住院死亡相关危险因素包括CRP、D-D二聚体、BUN、LDH 及NLR(P< 0.05)。通过多因素logistic回归分析结果发现, LDH(OR= 1.01,95%CI1.000 ~ 1.010,P= 0.020),BUN(OR= 1.160,95%CI1.000~1.350,P= 0.040)是与重症COVID-19患者住院死亡相关的独立危险因素(表8,9)。
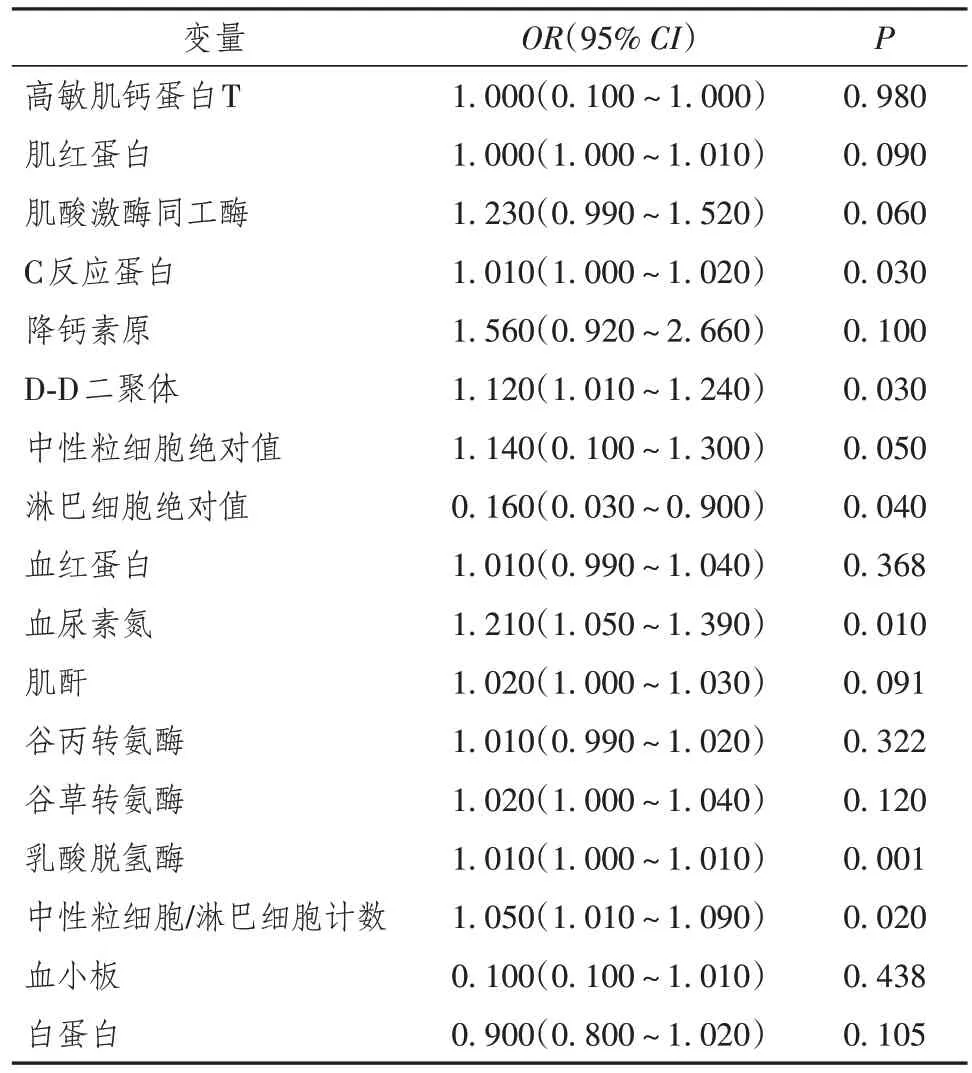
表8 重症新型冠状病毒感染患者住院死亡相关危险因素的单因素logistic回归分析

表9 重症新型冠状病毒感染患者住院死亡相关危险因素的多因素logistic回归分析
2.8 重症COVID-19 患者住院死亡风险的预测指标
ROC 曲线分析结果显示, LDH、BUN 能够显著预测重症COVID-19 患者的住院死亡风险,AUC 分别为0.82(95%CI0.700 ~ 0.950)、0.81(95%CI0.660 ~ 0.960)。LDH、BUN 的临界值为312.50 U/L(敏感性,81%;特异性,76%),9.45 mmol/L(敏感性,81%;特异性,91%)(表10,图4,5)。
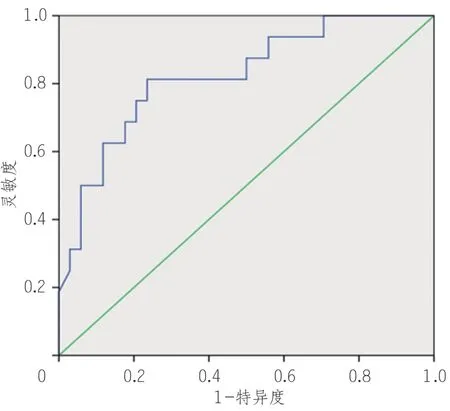
图4 乳酸脱氢酶预测重症新型冠状病毒感染患者住院死亡风险的ROC曲线

图5 血尿素氮预测重症新型冠状病毒感染患者住院死亡风险的ROC曲线

表10 预测重症COVID-19患者住院死亡的受试者工作特征曲线
3 讨 论
本研究的主要研究结果分为2个方面,一方面,LDH 及NLR 能够显著预测重症COVID-19,临界值分别为256.5 U/L(敏感性,62%;特异性,80%),6.57(敏感性,68%;特异性,81%);另一方面,重症COVID-19 患者中,LDH 及BUN 能够显著预测其住院死亡风险,临界值分别为312.50 U/L(敏感性,81%;特异性,76%),9.45 mmolL(敏感性,81%;特异性,91%)。
NLR 在机体炎症反应中发挥重大作用。炎症在COVID-19相关的器官功能障碍和死亡中起着极其重要的作用[7]。本研究发现,NLR是重症COVID-19的独立危险因素,并可预测COVID-19发展为重症的风险。这一研究结果与前期研究结果一致,Khedar 等[8]研究表明,在COVID-19 患者中,高表达水平的NLR 与严重的疾病结局相关。前期文献报道,在大多数研究中,与其他生物标志物相比,NLR对重症COVID-19的预测价值较高,重症标志包括入住ICU、进展为急性呼吸窘迫综合征、需要机械通气以及长期住院时间等[9]。Meta 分析显示,重症COVID-19 患者NLR 显著升高[10]。Qin 等[11]研究发现,与非重症相比,重症COVID-19 患者的NLR更高。
重症COVID-19患者NLR较高的原因一方面可能由于COVID-19 引起炎性细胞因子的异常表达、与淋巴细胞死亡通路相关基因的高表达以及病理性低密度中性粒细胞异常增加[12];另一方面,由于 COVID-19 的血管收缩素转化酶2(angiotensin‐converting enzyme 2, ACE2)受体在淋巴细胞上表达,淋巴细胞作为新冠病毒的攻击靶点,造成淋巴细胞数目减少[13]。以上2个方面的综合作用,导致中性粒细胞计数升高,而淋巴细胞计数下降,从而造成重症COVID-19 患者NLR 升高。因此,对于COVID-19 患者,采取适时有效的抗炎治疗至关重要,可有效阻止疾病进展,从而改善患者临床结局。
本研究发现,BUN 可有效预测重症COVID-19患者的住院死亡风险。Swarnima 等[14]研究发现,COVID-19 确诊患者中,死亡患者的BUN 水平显著高于存活者。Küçükceran 等[15]发现,在602 例COVID-19研究对象中,死亡患者的BUN水平较高。Cheng等[16]发现,BUN升高是COVID-19不良结局的独立危险因素,可以预测COVID-19 患者的住院死亡。Cheng 等[17]研究表明,5.1%的COVID-19 患者发生急性肾功能损伤,Kaplan- Meier分析表明,合并肾脏疾病的患者住院死亡风险明显更高。因此,临床医生应提高对重症COVID-19患者合并肾脏疾病的认识,从而为患者提供更加准确、有效的诊疗方案,防止疾病进一步恶化。
重症COVID-19死亡患者BUN水平较高的原因尚未完全阐明,BUN 是蛋白质代谢的最终产物,常被用作评价肾功能的生物标志物,急性肾损伤与COVID-19死亡风险息息相关[18]。COVID-19肾脏受累的机制可分为3个方面,即细胞因子损伤、肺泡损伤与肾轴之间的相互影响以及全身系统反应。持续肾脏替代疗法可减少细胞因子损伤,去除内毒素,改善肾功能,在重症COVID-19患者治疗中推荐使用,ECMO为心脏和肺提供支持,可与持续肾脏替代疗法联合使用,从而改善患者预后[19]。
本研究表明, LDH 既能预测重症COVID-19 风险,也可预测重症COVID-19患者的住院死亡风险。Deng 等[20]发现,入院时高浓度的LDH 与发展为重症COVID-19 相关。Liu 等[21]发现,LDH 增高是COVID-19 死亡的危险因素。Zhou 等[22]发现,与COVID-19存活者相比,死亡者的LDH明显升高,并随着病情恶化而升高。Henry 等[23]研究显示,COVID-19患者中,与LDH水平正常患者相比,LDH水平升高患者发生严重疾病的概率增加约6 倍,死亡概率增加约16倍。
LDH 是一种细胞内酶,几乎存在于所有细胞,主要存在于肝脏、心脏及骨骼肌中,是一种具有高度敏感性的炎性标志物[24]。多种肺部疾病LDH显著升高,且与疾病预后相关[25]。LDH升高是重症COVID-19的标志之一[26]。随着COVID-19进展,LDH水平持续增高,LDH水平升高可导致多器官损伤和衰竭,这可能是LDH水平较高的重症COVID-19患者临床预后较差的原因之一[23]。作为心脏及肝脏功能的指标之一, LDH 升高也在一定程度上反映了COVID-19患者心、肝功能存在一定程度的损伤。前期文献报道, COVID-19 患者血清的mRNA 清除率与血清中LDH 水平下降呈正相关,这表明LDH 下降可预示COVID-19患者病情的好转[27-28],这也为COVID-19患者的治疗提供了新的思路。
综上所述, LDH 及NLR 可作为重症COVID-19的辅助预测指标;LDH 及BUN 可预测重症COVID-19 患者的死亡风险。当LDH > 256.5 U/L,NLR >6.57时,提示COVID-19患者存在疾病恶化风险;当LDH > 312.50 U/L, BUN > 9.45 mmol/L 时,提示重症COVID-19患者存在住院死亡风险。此时应采取及时有效的治疗措施,阻止病情进一步进展恶化。因此,这些生物标志物将为临床医生对COVID-19患者的诊治提供参考意义。同时,本研究尚具有局限性,首先,由于本研究的研究类型是观察性研究,残留混杂偏倚的可能性尚不能完全排除;其次,本研究病例纳入数量相对不足且为单中心研究,仍需扩大病例样本数量,从而为预测重症COVID-19 及其预后提供更多临床参考价值。
利益冲突所有作者均声明不存在利益冲突