四维透视2023年高考中熠熠生辉的氯硅烷
孙 晶
(山东省日照市莒县第四中学)
高纯硅广泛应用于信息技术和新能源技术等领域.目前我国制备高纯硅主要采用三氯甲硅烷(Si HCl3)氢还原法、四氯化硅(Si Cl4)氢还原法和硅烷热解法.Si Cl4氢还原法工艺中,由合成炉里出来的Si Cl4中常含有各种硅氯化物和非硅氯化物杂质.Si Cl4沸点为57.7 ℃,遇水发生强烈水解,生成两种酸;Si HCl3沸点为31.8℃,能与H2O 发生强烈反应,在空气中易自燃.如何结合Si HCl3和Si Cl4的性质,安全高效地制备、提纯硅是高考命题的热点.本文从4个角度予以阐释.
1 融合化学键、熵变和物质分离考查高纯硅的制备
例1(2023年湖北卷3)工业制备高纯硅的主要过程如图1所示.下列说法错误的是( ).

图1
A.制备粗硅的反应方程式为
B.1 mol Si含Si—Si键的数目约为4×6.02×1023
C.原料气HCl和H2应充分去除水和氧气
D.生成Si HCl3的反应为熵减过程
【思路导引】Si元素原子序数为14,基态原子的简化电子排布式为[Ne]3s23p2,核外电子的空间运动状态有8种;单晶硅为共价晶体,晶体中每个Si原子以sp3杂化,分别与4个相邻的Si原子形成4个σ键,Si原子的配位数为4.

Si O2和C在高温下发生反应生成Si和CO,因此,制备粗硅的反应方程式为Si O2+,选项A 说法正确.在晶体硅中,每个Si原子与其周围的4个Si原子形成共价键,并形成立体空间网状结构,因此,用均摊法计算,平均每个Si原子形成2个共价键,1 mol Si含Si—Si键的数目约为2×6.02×1023,选项B说法错误.HCl易与水形成盐酸,在一定的条件下氧气可以将HCl氧化,H2在高温下遇到氧气能发生反应生成水,且其易燃易爆,H2与Si HCl3在高温下反应生成硅和HCl,因此,原料气HCl和H2应充分去除水和氧气,选项C说法正确.Si+3 HClSi HCl3+H2,该反应是气体分子数减少的反应,因此,生成Si HCl3的反应为熵减过程,选项D 说法正确.答案为B.
2 融合实验基本操作和定量计算考查高纯硅的制备
例2(2023年山东卷18)三氯甲硅烷(Si HCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解.实验室根据反应Si+3 HClSi HCl3+H2,利用图2所示装置制备Si HCl3粗品(加热及夹持装置略).回答下列问题.
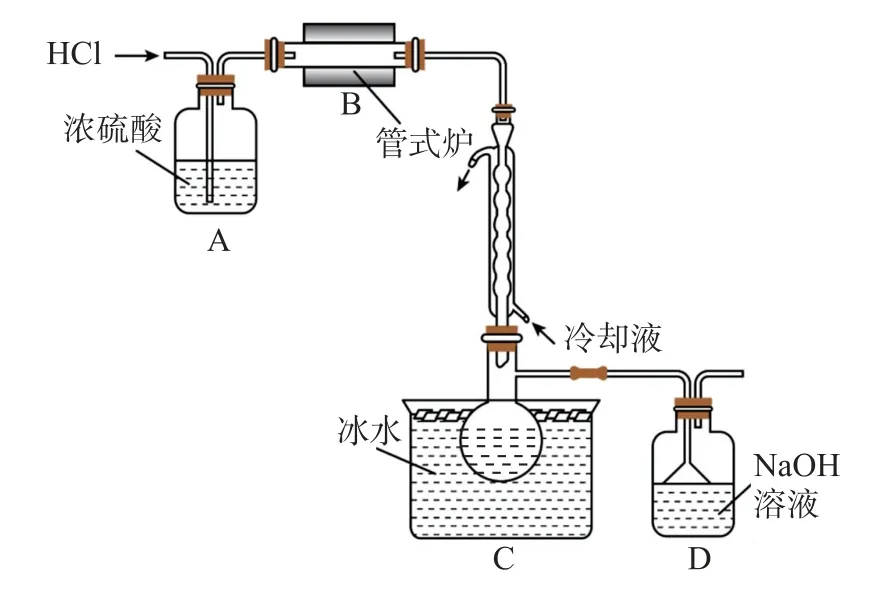
图2
(1)制备Si HCl3时进行操作:
(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应.
操作(ⅰ)为_________;判断制备反应结束的实验现象是_________.图示装置存在的两处缺陷是_________.
(2)已知电负性Cl>H>Si,Si HCl3在浓Na OH溶液中发生反应的化学方程式为_________.
(3)采用如下方法测定溶有少量HCl的Si HCl3纯度:将m1g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_________,②________(填操作名称),③称量等,测得所得固体氧化物质量为m2g.从下列仪器中选出①②中需使用的仪器,依次为_________(填标号).测得样品纯度为_________(用含m1、m2的代数式表示).

【思路导引】解答本题的思维流程如表1所示.

表1

氯化氢气体通入浓硫酸干燥后,在管式炉中和硅在高温条件下反应,生成三氯甲硅烷和氢气,由于三氯甲硅烷沸点为31.8 ℃,熔点为-126.5 ℃,在球形冷凝管中可冷却成液态,在装置C中收集起来,氢气则通过D 装置排出,同时D 可处理多余的氯化氢气体.
(1)制备Si HCl3时,组装好装置后,要先检查装置的气密性,然后将盛有硅粉的瓷舟置于管式炉中,通入氯化氢气体,排出装置中的空气,一段时间后,接通冷凝装置,加热开始反应,当管式炉中没有固体剩余时,即硅粉完全反应.Si HCl3易水解,所以需要在C、D 之间加一个干燥装置,防止D 中的水蒸气进入装置C中,另外氢氧化钠溶液不能吸收氢气,需要在D后面加处理氢气的装置.(2)已知电负性:Cl>H>Si,则Si HCl3中氯元素和H 元素的化合价均为-1,硅元素的化合价为+4,所以Na OH 溶液和Si HCl3发生氧化还原反应,化学方程式为Si HCl3+5 Na OH =Na2Si O3+3 Na Cl+H2↑+2 H2O.(3)m1g样品经水解、干燥等预处理过程得到硅酸水合物后,高温灼烧,在干燥器中冷却后,称量,所用仪器包括坩埚和干燥器,所得固体氧化物为Si O2,质量为m2g,则,样品纯度为
答案(1)检查装置的气密性;当管式炉中没有固体剩余,球形冷凝管中不再有无色液体滴落;C、D之间没有干燥装置,没有处理氢气的装置.
【归纳总结】在设计制备纯硅的实验题中,常遇到以下知识点.
1)粗硅与干燥HCl气体反应制得Si HCl3:
2)Si HCl3与过量H2在高温下反应制得纯硅:
3)Si O2+2 Mg2 Mg O+Si.
4)Si HCl3、Si Cl4能与水发生反应:
5)Si H4在空气中易自燃,制备时要隔绝氧气.
3 融合工艺流程考查四氯化硅
例3(2023年湖北卷16,节选)Si Cl4是生产多晶硅的副产物.利用Si Cl4对废弃的锂电池正极材料Li Co O2进行氯化处理以回收Li、Co等金属,工艺流程如图3所示.
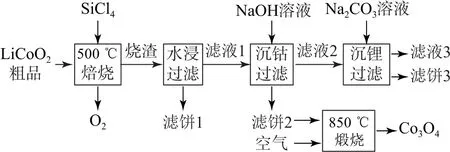
图3
回答下列问题:
(1)烧渣是Li Cl、Co Cl2和Si O2的混合物,“500 ℃焙烧”后剩余的Si Cl4应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因________.
(2)导致Si Cl4比CCl4易水解的因素有_________(填标号).
A.Si—Cl键极性更大
B.Si的原子半径更大
C.Si—Cl键键能更大
D.Si有更多的价层轨道
【思路导引】由题干可知,Li Co O2粗品与Si Cl4在500 ℃焙烧时生成氧气和烧渣,烧渣是Li Cl、Co Cl2和Si O2的混合物;烧渣经水浸、过滤后得滤液1和滤饼1,滤饼1的主要成分是Si O2和H2Si O3;滤液1用Na OH 溶液沉钴,过滤后得滤饼2(主要成分为Co(OH)2)和滤液2(主要溶质为Li Cl);滤饼2置于空气中850 ℃煅烧得到Co3O4;滤液2经碳酸钠溶液沉锂,得到滤液3和滤饼3,滤饼3为Li2CO3.

(1)“500 ℃焙烧”后剩余的Si Cl4应先除去,否则水浸时会产生大量烟雾.由此可知,Si Cl4可与水反应,化学方程式为Si Cl4+3 H2O=H2Si O3↓+4 HCl↑(或Si Cl4+4 H2O=H4Si O4↓+4 HCl↑或Si Cl4+(2+n)H2O=Si O2•nH2O↓+4 HCl).(2)Si—Cl键极性更大,易受到极性强的H2O影响,则Si—Cl键更易断裂,因此,Si Cl4比CCl4易水解,选项A 符合题意.Si的原子半径更大,因此,Si Cl4中的共用电子对更加偏向于Cl,从而导致Si—Cl键极性更大,且Si原子更易受到水电离出的OH-进攻,因此,Si Cl4比CCl4易水解,选项B 符合题意.通常键能越大,化学键越稳定且不易断裂,因此,Si—Cl键键能更大不能说明Si—Cl更易断裂,故不能说明Si Cl4比CCl4易水解,选项C 不符合题意.Si原子有3d空轨道,可以接受O 原子的孤对电子,而C 原子没有d轨道,不能接受O 原子的孤对电子,从而导致Si Cl4比CCl4易水解,选项D 符合题意.故导致Si Cl4比CCl4易水解的因素有A、B、D.
4 以我国航天事业为命题载体,考查四氯化硅的结构
例4(2023年全国乙卷35,节选)中国第一辆火星车“祝融号”成功登陆火星.探测发现火星上存在大量橄榄石矿物(MgxFe2-xSi O4).已知一些物质的熔点数据如表2所示.
Na与Si均为第三周期元素,Na Cl熔点明显高于Si Cl4,原因是_________.分析同族元素的氯化物Si Cl4、Ge Cl4、Sn Cl4熔点变化趋势及其原因________.Si Cl4的空间结构为_________,其中Si的轨道杂化形式为________.
【思路导引】由表中的数据可知,Si Cl4、GeCl4、Sn Cl4熔点变化趋势为随着同族元素电子层数的增多,其熔点依次升高.原因是Si Cl4、GeCl4、Sn Cl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,随着相对分子质量增大,其分子间作用力依次增大,熔点依次增高.

Na与Si均为第三周期元素,Na Cl熔点明显高于Si Cl4,原因是钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而Si Cl4为分子晶体,其熔点较低.Si Cl4的空间结构为正四面体,其中Si的价层电子对数为4,因此Si的轨道杂化形式为sp3.
答案Na的电负性小于Si,Na Cl为离子晶体,而Si Cl4为分子晶体,离子晶体的熔点高于分子晶体;随着同族元素的电子层数的增多,其熔点依次升高,其原因是:Si Cl4、Ge Cl4、Sn Cl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,随着其相对分子质量增大,其分子间作用力增大,分子间作用力越大则其熔点越高;正四面体;sp3.
链接练习
设NA为阿伏加德罗常数的值.工业上制备高纯度硅的反应有
已知:H、Si的电负性依次为2.1、1.8.下列有关说法正确的是( ).
A.①中,30 g氧化剂含极性键数目为NA
B.②中,生成1 g H2时转移电子数为NA
C.②和③互为可逆反应
D.②和③的目的是除去粗硅中的杂质
链接练习参考答案
D.
(完)
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

