突破化学工艺流程题的思路和方法
尹晓亮 郭宁宁 王志庚(正高级教师)
(1.河北省唐山市滦南县第一中学 2.河北省唐山市开滦一中 3.河北省唐山市教育局教研室)
化学工艺流程题以真实的化工生产为载体,复原和模拟化工生产的原理,借助相应的文字信息及流程图的形式呈现,实现对物质性质、反应原理、实验操作等化学知识的综合考查,是高考中考查核心素养的优质试题.本文结合高考实例,重点研究物质转化线和操作线,以期对试题进行重点突破.
1 流程图中物质转化线的分析
通过题头找到原料和产品,通过流程图,明确核心化学反应(离子反应、氧化还原反应、电化学等),从元素角度确定物质转化线中的核心物质.
例1(2022 年河北卷,节选)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料.工艺流程如图1所示.还原工序中,不生成S单质的反应的化学方程式为________.


图1
黄铁矿FeS2是工业制硫酸中的原料,所以不难分析出焙烧黄铁矿时生成了Fe2O3,故红渣主要成分为Fe2O3和Si O2;将红渣粉碎后加入足量的H2SO4溶液,加热并酸浸,Si O2不反应,Fe2O3与H2SO4反应生成Fe2(SO4)3;向滤液中加入黄铁矿,将Fe3+还原为Fe2+,已知在还原工序中,不生成S单质,则可以判断S元素被氧化为,这样就明确了“两剂两产物”:Fe3++FeS2→Fe2++.再结合电子守恒关系进行部分配平:14Fe3++FeS2→15Fe2++.下一步结合环境(酸性)进行电荷守恒的配平:14Fe3++FeS2→15Fe2+++16 H+.最后一步根据原子守恒配平:14Fe3++FeS2+8 H2O=15Fe2+++16 H+.故化学方程式为
思路方法化工生产流程题中从原料到核心反应,再到产品的各个环节均可涉及化学方程式的书写问题,需要学生通过判断元素价态变化来明确反应类型,尤其是陌生氧化还原反应的配平,难度大、易丢分,学生感觉无从下手.思维模型如下.
第一步:电子守恒.结合题中信息,明确“两剂两产物”,即氧化剂+还原剂=氧化产物+还原产物.
第二步:电荷守恒(看环境).根据题中信息,明确酸碱环境.
第三步:原子守恒.反应前后各元素的原子个数相等.
2 流程图中工业流程操作线的分析
化工生产流程问题是工艺与实验的融合,常考查原料预处理、反应条件的控制、产品获得阶段等问题.
2.1 原料预处理
例2(2022年福建卷,节选)粉煤灰是火电厂的大宗固废.以某电厂的粉煤灰为原料(主要含Si O2、Al2O3和Ca O 等)提铝的工艺流程如图2所示.

图2
(1)“浸出”时适当升温的主要目的是_________,Al2O3发生反应的离子方程式为________.
(2)“浸渣”的主要成分除残余Al 2 O3 外,还有________.

(1)“浸出”时适当升温,可以增大粉煤灰的溶解速率,提高粉煤灰的浸出率;“浸出”时加入了硫酸,Al2O3和Ca O 与H2SO4反应生成硫酸盐和水,Si O2不反应,Al2O3发生反应的离子方程式为Al2O3+6 H+=2Al3++3 H2O.(2)通过分析可知,“浸渣”中还存在未参与反应的Si O2和微溶物CaSO4.
思路方法原料预处理环节出现了很多工业术语(焙烧、灼烧、煅烧,研磨、粉碎、搅拌,水浸、酸浸、碱浸等),明确预处理目的是这部分研究的重点(如表1).

表1
2.2 反应条件的控制
例3(2023 年全国乙卷,节选)Li Mn2O4作为一种新型锂电池正极材料受到广泛关注.由菱锰矿(Mn CO3,含有少量Si、Fe、Ni、Al等元素)制备Li Mn2O4的流程如图3所示.

图3
已知:Ksp[Fe(OH)3]=2.8×10-39,
Ksp[Al(OH)3]=1.3×10-33,
Ksp[Ni(OH)2]=5.5×10-16.
溶矿反应完成后,反应器中溶液的p H=4,此时c(Fe3+)=_________mol•L-1;用石灰乳调节至p H≈7,除去的金属离子是_________.

加入硫酸将菱锰矿溶解,使杂质中的Fe、Ni、Al等元素转化为离子形式,同时,加入的Mn O2将溶液中的Fe2+氧化为Fe3+;工业上常利用氢氧化物溶解性的差异,通过调节p H 的方法,将离子转化成沉淀,实现离子的分离.溶液的p H=4 时,1.0×10-10mol•L-1,再结合Ksp计算出溶液中溶液中的c(Fe3+)<1.0×10-5mol•L-1,因为当离子浓度小于10-5mol•L-1时,认为沉淀完全,所以Fe3+已经沉淀完全;再用石灰乳调节溶液至p H≈7,此时溶液中
Al3+沉淀完全,Ni2+未完全沉淀,所以该阶段除去的金属离子是Al3+.
思路方法反应条件的控制主要有两种情况(如表2).合适的条件有利于去除杂质或产品的生产.

表2
2.3 产品获得阶段的分析
例4(2022年湖北卷,节选)全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视.某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有Na+、Li+、Cl-和少量Mg2+、Ca2+),并设计了图4所示流程,通过制备碳酸锂来提取锂.

图4
已知:25℃时相关物质的参数如表3 所示;H2CO3的溶解度曲线如图5 所示;Li OH 的溶解度为12.4 g/100 g H2O.
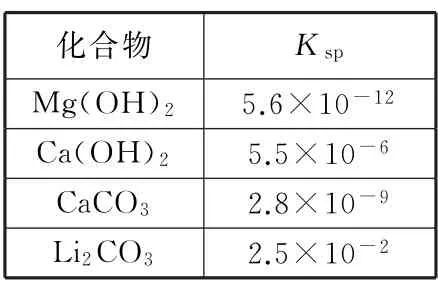
表3

图5 H2 CO3 的溶解度曲线
(1)“沉淀1”为________.
(2)向“滤液1”中加入适量固体Li2CO3的目的是_________.
(3)为提高Li2CO3的析出量和纯度,“操作A”依次为_________、________、洗涤.

(1)首先向浓缩卤水中加入石灰乳,Mg2+与其反应转化为Mg(OH)2沉淀.(2)过滤后向滤液1 中加入适量固体Li2CO3,将Ca2+转化成CaCO3沉淀除去,同时还不引入新的杂质.(3)通过Li2CO3的溶解度曲线可知,温度越高,Li2CO3的溶解度越小,即在温度高时,更有利于Li2CO3的析出,所以为提高Li2CO3的析出量和纯度,需要在较高温度下析出并过滤得到沉淀,即依次蒸发浓缩,趁热过滤,洗涤.
思路方法一定要搞清楚工艺流程的生产目的,即希望通过一系列转化获得某种产品.围绕产品的分离、提纯常常会有不同的设问,而分离提纯常用的方法如过滤、萃取、冷却结晶、蒸发结晶、蒸馏等,则需要我们重点掌握(如表4).
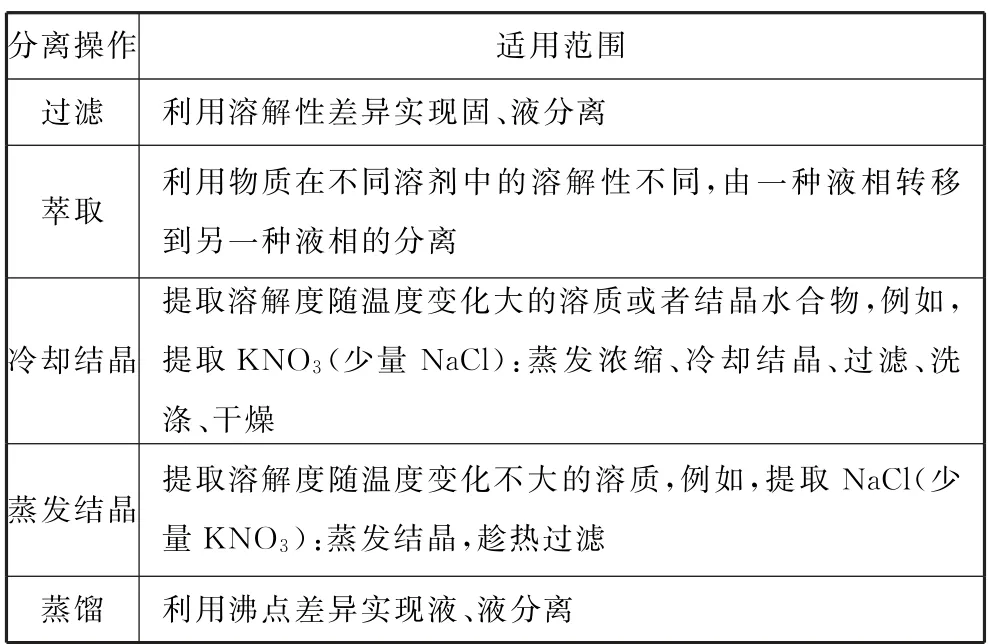
表4
综上,整体理解、把握化工生产流程题的试题结构,明确各环节的目的、方法、措施,构建思维模型(如图6),从题目中获取有用信息,用规范准确的化学用语进行答题,突破学习难点,做到看题不慌,解题不乱,以不变应万变.

图6
(完)

