血小板与淋巴细胞比值联合中性粒细胞与淋巴细胞比值在消化系统恶性肿瘤中的诊断价值
周 阳 张业霞 王宗军
1 菏泽医学专科学校药学与检验系 山东 菏泽 274000;2 菏泽医学专科学校免疫学检验教研室 山东 菏泽 274000;3 菏泽医学专科学校附属医院检验科 山东 菏泽 274000;4 菏泽医学专科学校病原微生物学与免疫学教研室 山东 菏泽 274000
随着生活环境的改变及各种致癌因素的增多,恶性肿瘤疾病发生率也不断增加,而消化系统恶性肿瘤是临床常见的一类恶性肿瘤疾病,现已成为我国主要的公共卫生问题[1]。目前国内消化系统恶性肿瘤发病率及致死率均明显高于全球平均水平,所以临床必须重视恶性肿瘤疾病的诊疗工作[2]。消化系统恶性肿瘤由于缺乏典型临床表现,一旦发现已处于中晚期,恶性肿瘤病理过程涉及多因素、多阶段,其临床检测及诊断仅依靠影像学技术,较易引起误诊或漏诊[3]。当前除了采用影像学检测之外,消化道内镜也是检测及诊断消化道肿瘤疾病的有效方式之一,但该检测方式存在局限性,如在评估肿瘤转移、肿瘤侵犯方面疗效不理想,加之该检测方式具有创伤性,使得其无法在癌症早期及健康体检者中进行早期筛查[4]。现今临床学者们正通过深入探究恶性肿瘤诱发因素、发生、发展、诊治及转归,期望能寻找增加肿瘤疾病治疗效果及延长预后生存期的方式或方法[5-6]。近几年研究报道,肿瘤疾病的发生、发展与机体全身炎性反应关系密切[7-8]。临床上目前评估全身炎性反应的常见血清学指标包括C反应蛋白、白细胞、中性粒细胞、血小板及淋巴细胞等[9]。其中血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)是临床反映机体炎性反应的常见指标,临床中易于获取。有研究发现,PLR、NLR可能与肿瘤疾病的发生、发展及复发等有着密不可分的关系[10-12]。然而目前国内外有关PRL、NLR与消化系统恶性肿瘤的相关性以及两者在消化系统恶性肿瘤中的临床诊断价值的研究相对较少。本研究旨在通过对我院收治的100例消化系统恶性肿瘤患者以及同期体检的50例健康者临床病例资料进行分析,比较两组患者PLR、NLR差异,并探讨中性粒细胞、血小板、淋巴细胞等炎性标志物联合检测对消化系统恶性肿瘤疾病的诊断价值。现将相关研究总结如下:
1 资料与方法
1.1 一般资料 选取100例消化系统恶性肿瘤患者作为研究组,根据肿瘤类型分为胃癌组(40例)、胰腺癌组(30例)、结直肠癌组(30例),根据有无转移将研究组患者分为转移组(60例)与未转移组(40例)。100例消化系统恶性肿瘤患者中男57例,女43例,年龄(33~67)岁,平均年龄为(54.19±10.27)岁。选取同期体检的50例健康者作为对照组,男26例,女24例,年龄(31~68)岁,平均年龄为(54.39±10.17)岁。两组性别及年龄比较差异无统计学意义(P>0.05)。纳入标准:经术后组织病理学检查确诊为消化系统恶性肿瘤者,以术后病理结果作为肿瘤转移判断的金标准,患者未有近期感染、肾脏及血液等影响血常规指标的疾病,近期无外伤史及手术史,患者有完整的血常规检验分析报告,随访资料完整。排除标准:术后病理学检查资料不全者,近6个月内有动脉或静脉栓塞者,正接受化疗、抗凝治疗者,其他部位的原发性恶性肿瘤者。
1.2 治疗方法 采集纳入的消化系统恶性肿瘤患者及健康体检者晨起空腹状态下肘静脉血2 mL,置入含有乙二胺四乙酸二钾抗凝剂的收集管,随后采用XE-2100型血细胞分析仪(日本SYSMEX公司)及相关配套的试剂检测淋巴细胞、血小板及中性粒细胞计数,检测方法为荧光染色、激光散色及直流电阻抗等,计算PLR、NLR。
1.3 观察指标 比较胃癌、胰腺癌、结直肠癌等消化系统恶性肿瘤患者以及健康体检者间的PLR、NLR水平。比较消化系统恶性肿瘤转移、未转移患者及健康体检者间的PLR、NLR水平。采用受试者工作曲线(ROC)分析PLR与NLR诊断消化系统恶性肿瘤的临床意义。

2 结果
2.1 两组患者PLR、NLR水平比较 胃癌组、胰腺癌组、结直肠癌组等消化系统恶性肿瘤患者PLR、NLR水平明显高于对照组(P<0.05),胃癌组、胰腺癌组、结直肠癌组间PLR、NLR水平比较差异无统计学意义。见表1。
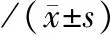
表1 消化系统恶性肿瘤患者与健康体检者PLR、NLR水平比较
2.2 消化系统恶性肿瘤有无转移者与对照组PLR、NLR水平比较 将消化系统恶性肿瘤患者有无转移分为转移组与未转移组,结果发现,三组患者PLR、NLR水平比较差异有统计学意义(P<0.05),消化系统恶性肿瘤转移组患者其PLR、NLR水平明显高于非转移组及对照组(P<0.05),非转移组患者其PLR、NLR水平明显高于对照组(P<0.05)。见表2。
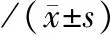
表2 消化系统恶性肿瘤有无转移与对照组PLR、NLR水平比较
2.3 ROC评估PLR和NLR对消化系统恶性肿瘤的诊断价值 PLR对消化系统恶性肿瘤的曲线下面积AUC为0.841,95%CI(0.912,0.971),截断值为146.87,敏感度、特异性为68.90%、90.00%。NLR对消化系统恶性肿瘤的曲线下面积AUC为0.780,95%CI(0.713,0.847),截断值为2.21,敏感度、特异性为51.10%、98.90%。联合检测对消化系统恶性肿瘤的曲线下面积AUC为0.848,95%CI(0.920,0.976),敏感度、特异性为81.10%、92.20%。见表3和图1。
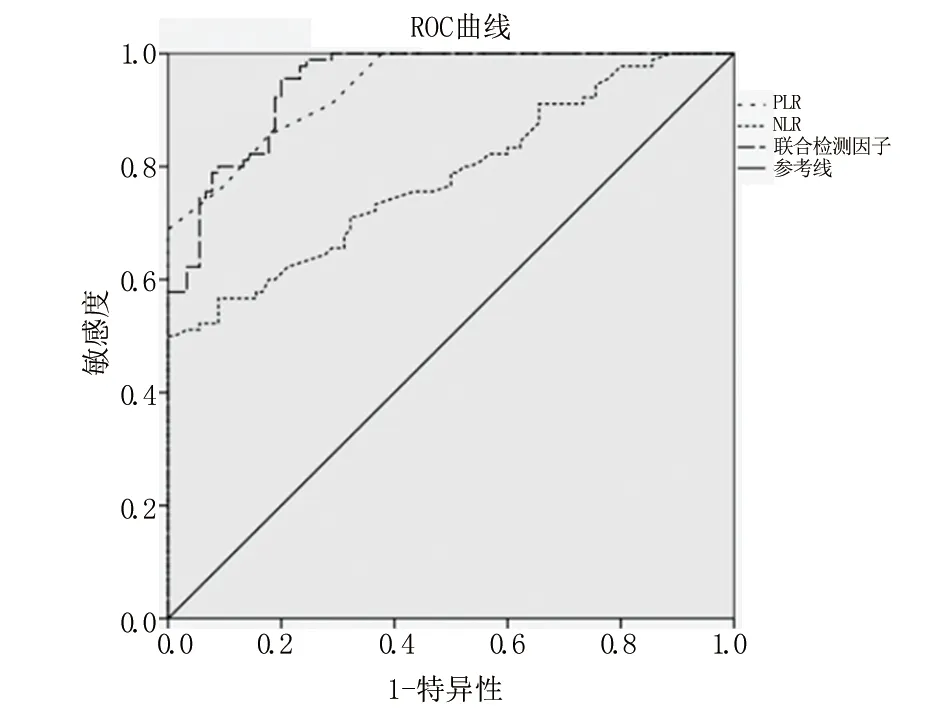
图1 ROC评估PLR和NLR对消化系统恶性肿瘤的诊断价值

表3 PLR和NLR对消化系统恶性肿瘤的诊断价值
3 讨论
消化系统恶性肿瘤是一种因环境、个体生活习惯及遗传因素共同作用所引起的常见恶性肿瘤疾病之一。由于消化系统恶性肿瘤晚期患者生存率较低,所以尽早且及时明确诊断对改善患者预后具有重要意义。随着人工智能及医学影像学技术的迅猛发展,超声内镜、增强多层螺旋及扩散加权核磁共振成像技术等已成为诊断消化系统肿瘤疾病的有效工具,且获得较好的认可度[13]。然而病理检测结果与单一的影像学检测结果的一致性往往并不满意,且影像学检测技术耗时较长、价格相对昂贵,因此创伤小、检测简单、方便且低廉的血清生化标注物逐渐被用于诊断恶性肿瘤疾病[14]。近几年来的研究发现,肿瘤与炎症间存在的密切相关性,系统性炎症反应在肿瘤发生、形成及进展中可能发挥重要作用,同时对肿瘤患者的预后生存时间造成影响[15]。PLR以及NLR作为反映机体炎性反应的指标,现被发现在抗肿瘤及机体免疫状态中发挥关键作用[16]。基于此,本研究探讨消化系统恶性肿瘤患者与健康体检者PLR、NLR水平差异,分析PLR、NLR对预测与诊断消化系统恶性肿瘤患者的价值。
中性粒细胞是白细胞中一类主要亚型,有研究报道,中性粒细胞可生成促肿瘤生长因子,并对机体抗肿瘤免疫产生抑制,从而加速肿瘤细胞的增殖及生长,同时中性粒细胞还能加速毛细血管增殖,使肿瘤细胞转移及运动[17]。而淋巴细胞也参与了机体免疫反应,诱导自然杀伤细胞及巨噬细胞释放细胞因子或直接杀灭肿瘤细胞[18]。炎性反应是机体肿瘤细胞微环境中的重要因素,在肿瘤组织形成期间,淋巴细胞减少,中性粒细胞相应增多[19]。中性粒细胞水平升高,会产生肿瘤坏死因子、白细胞介素等趋化因子,并刺激肿瘤进展[20]。血小板同样也是与肿瘤有关的炎性反应标志物之一,特别是晚期肿瘤患者通常伴有血小板增多[21]。血小板可能通过释放外周血中血小板因子4、转化生长因子-β1、血管内皮生长因子及增加血管生成来引起炎性反应,并促进肿瘤细胞黏附、增殖,促进肿瘤血行播散[22]。本研究结果显示,研究组患者PLR、NLR水平显著高于对照组(P<0.05),肿瘤转移患者其PLR、NLR水平明显高于非转移组及对照组(P<0.05),提示中性粒细胞、血小板与淋巴细胞比例失衡可能与肿瘤发生和转移有关,PLR、NLR可反映消化系统恶性肿瘤患者抗肿瘤及促肿瘤炎性间的动态失衡。分析其原因为PLR、NLR水平升高说明机体抗肿瘤能力降低,炎性反应会向着加速肿瘤进展的方向发展,进而导致肿瘤组织血管增生、肿瘤侵袭及转移[23]。此外本研究还发现,PLR对消化系统恶性肿瘤的曲线下面积AUC为0.841,95%CI(0.912,0.971),截断值为146.87,敏感度、特异性为68.90%、90.00%;NLR对消化系统恶性肿瘤的曲线下面积AUC为0.780,95%CI(0.713,0.847),截断值为2.21,敏感度、特异性为51.10%、98.90%;联合检测对消化系统恶性肿瘤的曲线下面积AUC为0.848,95%CI(0.920,0.976),敏感度、特异性为81.10%、92.20%;结果提示PLR、NLR联合检测对消化系统恶性肿瘤诊断具有较高的临床价值。
综上所述,PLR与NLR在消化系统恶性肿瘤患者中具有较高的表达水平,并与是否转移有一定相关性,两者联合检测在预测或诊断消化系统恶性肿瘤方面有较高的临床价值。

