杂交鲟“鲟龙1 号”(Huso dauricus ♀×Acipenser schrenckii ♂)atp1α1 与atp1β1 基因的克隆、序列分析及碱胁迫下鳃的表达特征
杨合霖,刘霞飞,2,张颖,吕伟华,王念民,丰超杰,徐伟,曹顶臣
(1.中国水产科学研究院黑龙江水产研究所,黑龙江省特殊生境鱼类种质特性与抗逆育种重点实验室,黑龙江 哈尔滨 150070;2.大连海洋大学,辽宁 大连 116023)
我国盐碱水域分布广泛,尤其黑龙江省的碳酸型盐碱水域资源丰富,极大制约了我国东北地区水产养殖业的健康发展[1]。为进一步拓展水产养殖空间和实现盐碱水域鱼类养殖增产,开发优质耐盐碱鱼类已经成为近年来的重要研究课题[2]。鲟个体大、抗逆性强,广盐性,已被列为II 类盐碱水养殖鱼类,养殖技术相对成熟,已有多个高原和低洼等盐碱水域成功养殖的实例,具有一定盐碱驯化潜力[3-5]。杂交鲟“鲟龙1 号”(Huso dauricus♀×Acipenser schrenckii♂)为中国自主研发的第一个杂交鲟新品种,兼具生长快和性腺品质高等优势,为优质养殖品种[6,7]。
水体碱度变化影响鱼类的生长和发育[8-10],甚至会威胁鱼类的生存[11,12],在过高的碱度下,养殖鱼类的食用价值也会下降[13]。大量研究表明,鱼类的Na+/K+-ATP 酶(Na+/K+-ATPase,NKA)响应碱度的变化。当碱度超过鱼类的耐受范围时,mRNA 表达水平下降,NKA 的酶活力减弱[14-16]。项目组前期研究发现,在碳酸盐碱度胁迫下“鲟龙1 号”鳃的Na+/K+转运相关的代谢通路变化明显,atp1α1 基因与atp1β1 基因表达下调,其中atp1α1 基因与atp1β1基因分别注释到了NKA 蛋白的NKAα1 亚基和NKAβ1 亚基[17]。
NKA 为普遍存在于动物细胞膜上的跨膜结合蛋白,参与细胞膜内外的Na+和K+运输,可调节细胞内外的静息电位与离子平衡[18]。NKAα 亚基为NKA 的催化亚基,是Na+与K+的结合位点。NKAα1为NKAα 的一种亚型[19,20];NKAβ 亚基主要参与辅助NKAα 亚基正确折叠、靶向和插入到细胞膜,稳定其构型及调节其活性。NKAβ1 为NKAβ 的一种亚型[21-23]。研究证实,NKA在尼罗罗非鱼(Oreochromis niloticus)[10]、松江鲈(Trachidermus fasciatus)[24]、大鳞鲃(Luciobarbus capito)[15]、俄罗斯鲟(Acipenser gueldenstaedti)[25]与大黄鱼(Larimichthys crocea)[26]等鱼类的渗透压平衡与盐碱适应调节中发挥重要作用,但关于鲟的研究较少。因此,本研究克隆了“鲟龙1 号”的atp1α1 基因与atp1β1 基因的cDNA全长序列,分析了其序列特征,比较了不同碳酸盐碱度胁迫下atp1α1 基因和atp1β1 基因的表达特征,以期为揭示鲟科鱼类耐盐碱胁迫响应机制提供基础数据。
1 材料与方法
1.1 材料及分组
本研究中涉及鱼类处理的所有实验均获得了中国水产科学院黑龙江渔业研究所动物护理和使用委员会(HRFRI)的批准,并按照指南进行。30 日龄”鲟龙1 号”幼鱼体长(133.17±16.75)mm,体质量(12.43±3.99)g,取自中国水产科学研究院鲟鱼工程繁育中心。试验前在水温(17±2)℃、溶氧量大于6 mg L-1下暂养2 周。试验分4 组,每组3 个重复,对照组为提前曝气的自来水,实际测定碱度为(3.16±0.03)mmol·L-1(C 组);依据II 类盐碱水质养殖鱼类适应碱度标准(SC/T 9406-2012)和前期预实验结果,在3 个试验组中添加99%纯度的食用小苏打(哈尔滨市呼兰区三鑫制碱厂),实测碱度分别为(7.61±0.12)mmol·L-1(T1 组)、(12.10±0.05)mmol·L-1(T2 组)和(15.30±0.85)mmol·L-1(T3 组)。于养殖第30 d,采集对照组的鳃、皮肤、肌肉、心脏、肝脏、脾脏、头肾、肠道、眼、胃和肾脏和3 个试验组的鳃,每个重复各取5 尾混合,每组共采集15 尾鱼,装入冻存管后用液氮速冻,转入-80 ℃冰箱保存备用。
1.2 总RNA 提取和cDNA 合成
采用北京康为世纪生物科技有限公司的试剂,采用Trizol 法提取总RNA,按照说明书方法操作。使用nanodrop 8000 仪器检测各RNA 样品的纯度和浓度,采用琼脂糖凝胶电泳检测RNA 的完整性,并于-80 ℃分装保存备用。以总RNA 为模板,采用PrimeScriptTMRT reagent Kit with gDNA Eraser 的说明进行反转录,将合成的cDNA 稀释1/10 后于-20 ℃分装保存。
1.3 “鲟龙1 号”atp1α1 与atp1β1 基因的全长克隆
根据转录组数据中的部分CDS 序列设计引物,由苏州金唯智生物科技有限公司(苏州)合成(表1)。采用5× Es Taq MasterMix(TaKaRa)进行PCR扩增,反应程序为:94 ℃变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,35 个循环;终延伸2 ℃,延伸7 min;采用1%琼脂糖凝胶电泳检测产物,使用琼脂糖凝胶DNA 回收试剂盒(CWBIO)对目的片段进行切胶回收,纯化片段连接到pMD18-T载体(TaKaRa),转染至大肠杆菌DH5a 感受态细胞(TaKaRa),在含Amp 的LB 固体平板培养基上37℃过夜培养;采用菌落PCR 鉴定阳性克隆,送菌液至苏州泓迅生物科技股份有限公司测序。

表1 实验使用的引物及序列Tab.1 Sequences of primers used in the experiment
根据测序获得的CDS 区的部分片段设计5’RACE 和3’RACE 的特异性引物(GSP 和NGSP)(表1),按 照SMARTer RACE 5’/3’Kit(TaKaRa,clontech)试剂盒的方法进行两轮PCR 扩增,获得5’/3’末端序列正确片段后,进行胶回收、连接载体、转化、鉴定阳性及送测序。
1.4 “鲟龙1 号”atp1α 与atp1β 基因的序列分析
使用DNAMAN 软件将atp1α1 与atp1β1 基因的5’RACE 和3'RACE 测序结果与部分CDS 区进行拼接与去冗余,得到cDNA 全长序列;采用NCBI ORF finder 平台分析开放阅读框并翻译为相应的氨基酸序列,用NCBI 中的BLAST 程序比对获得的序列;使用蛋白在线分析系统(Expert Protien Analysis System,Ex PASy)分析氨基酸序列的理化参数;使用在线分析平台(SOPMA)分析蛋白二级结构等信息;用TMHMM Server v.2.0 预测蛋白跨膜区;用Net-Phos-3.1 平台预测磷酸化位点,分数阈值为0.5;采用Mega7 软件和最大似然法(Maximum-Likehood)构建系统进化树,Bootstrap Replications 为1 000。
1.5 实时荧光定量PCR 检测atp1α 与atp1β 基因的表达
根据CDS 序列设计定量引物(表1),以不同碱度组的鳃、对照组鳃、皮肤和肌肉等11 个组织提取的总RNA 反转录得到的cDNA 作为荧光定量PCR模板,以β-actin 基因为内参,使用ABI 7500(Applied Biosystems,USA)荧光定量PCR 仪,并采用TB GreenPremix Ex TaqTMII(TaKaRa)试剂盒,按照说明书进行实验操作。相对表达量的结果采用2-ΔΔCT的方法计算,数据采用平均值±标准差(Mean±SD)表示。使用Excel 2019 软件统计分析数据,使用SPSS 22 软件进行单因素方差分析及Dunnett 多重比较,显著性水平为P<0.05。使用GraphPad Prism9进行表达水平结果可视化。为保证试验的准确性和可重复性,设15 个生物重复,5 个生物重复为一个混样,并做3 个技术重复。
2 结果与分析
2.1 “鲟龙1 号”atp1α1 和atp1β1 基因的cDNA 全长序列信息
本研究扩增获得“鲟龙1 号”的atp1α1 基因和atp1β1 基因均为单一产物,无多态性扩增。其中atp1α1 基因的cDNA 全长序列为3 417 bp(GenBank登录号为OM808728),其中5’端非编码区(5’UTR)为126 bp,3’端非编码区(3’UTR)为207 bp,开放阅读框(ORF)为3 084 bp,共编码1 027 个氨基酸(图1);atp1β1 基因的的cDNA 全长序列为2 170 bp(GenBank 登录号为OM808729),其中5'UTR 为180 bp,3'UTR 为1 075 bp,ORF 为915 bp,共编码304 个氨基酸(图2)。

图1 “鲟龙1 号”atp1α1 基因序列Fig.1 Sequence of atp1α1 gene of the hybrid sturgeon

图2 “鲟龙1 号”atp1β1 基因cDNA 全长序列Fig.2 Full-length cDNA sequence of atp1β1 gene of the hybrid sturgeon
2.2 “鲟龙1 号”atp1α1 与atp1β1 基因的蛋白结构预测
对atp1α1 与atp1β1 基因的开放阅读框蛋白质的预测结果显示,NKAα1 蛋白质分子式为C5041H803N1337O1498S52,相对分子质量为113.01KDa,理论PI 值为5.37;NKAβ1 蛋白质分子式为C1578H2428N412O457S10,相对分子质量为34.80KDa,理论PI 值为8.80;跨膜结构与蛋白信号肽预测结果显示,NKAα1 蛋白有8 个跨膜区,跨膜片段为TM1(102~124 aa)、TM2(134~153 aa)、TM3(294~316 aa)、TM4(326~348 aa)、TM5(854~876 aa)、TM6(917~936 aa)、TM7(957~974 aa)与TM8(989~1 005 aa)。NKAβ1 蛋白有1 个跨膜区,跨膜片段为TM(34~56 aa)(图1~ 图3);蛋白质磷酸化位点预测结果显示,NKAα1 与NKAβ1 蛋白均以丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)为潜在磷酸化位点(图4)。二级结构预测结果显示,NKAα1与NKAβ1 蛋白的二级结构主要为α-螺旋与无规则卷曲,β-转角仅局部分布(图5)。

图3 “鲟龙1 号”NKAα1 和NKAβ1 跨膜蛋白Fig.3 Transmembrane protein of NKAα1 and NKAβ1 of the hybrid sturgeon

图4 “鲟龙1 号”NKAα1 和NKAβ1 氨基酸潜在磷酸化位点Fig.4 Potential phosphorylation sites of amino acids of NKAα1 and NKAβ1 of the hybrid sturgeon

图5 “鲟龙1 号”NKAα1 和NKAβ1 蛋白二级结构Fig.5 Secondary structure of protein of NKAα1 and NKAβ1of the hybrid sturgeon
2.3 NKAα1 与NKAβ1 蛋白的同源性分析
系统进化树结果显示,“鲟龙1 号”的NKAα1蛋白和NKAβ1 蛋白与小体鲟(Acipenser ruthenus)的亲缘关系最近(图6、图7)。其中“鲟龙1 号”的NKAα1 蛋白与小体鲟、匙吻鲟(Polyodon spathula)、苇栖多鳍鱼(Erpetoichthys calabaricus)、鳄雀鳝(Atractosteus spatula)、欧洲鳗鲡(Anguilla_anguilla)和大海鲢(Megalops_cyprinoides)的同源性较高(图6);“鲟龙1 号”的NKAβ1 蛋白与小体鲟、匙吻鲟、噬人鲨(Carcharodon carcharias)、点纹斑竹鲨(Chiloscyllium punctatum)、鲸鲨(Rhincodon typus)和虎纹猫鲨(Scyliorhinus torazame)的的同源性较高(图7)。
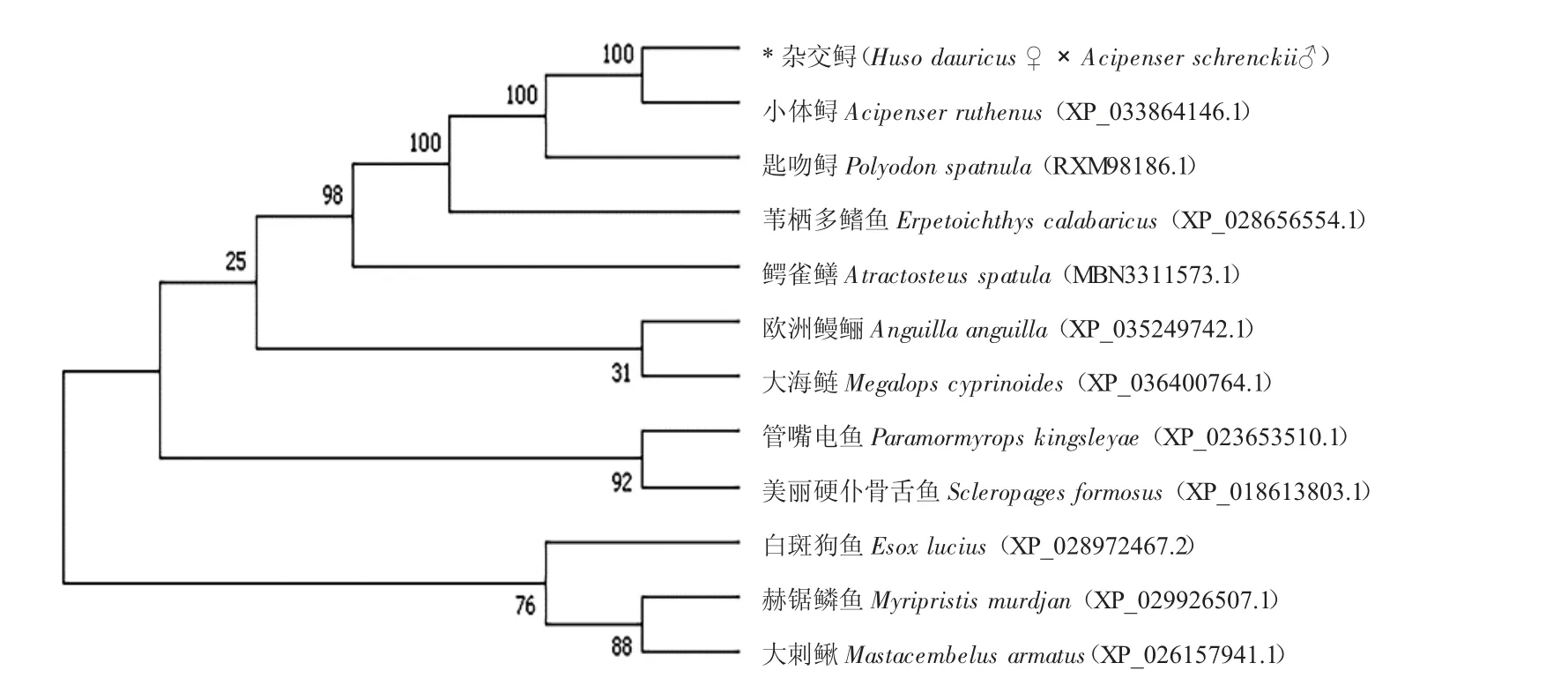
图6 “鲟龙1 号”NKAα1 与其他鱼类NKAα1 的系统进化树Fig.6 Phylogenetic tree of NKAα1 between the hybrid sturgeon and other fish

图7 “鲟龙1 号”NKAβ1 与其他鱼类NKAβ1 的系统进化树Fig.7 Phylogenetic tree of NKAβ1 between the hybrid sturgeon and other fish
2.4 “鲟龙1 号”atp1α1 和atp1β1 基因的组织表达 特征
采用荧光定量PCR 方法检测“鲟龙1 号”的atp1α1 基因和atp1β1 基因的组织表达特征。结果显示,atp1α1 基因和atp1β1 基因在鳃、皮肤、肌肉、心脏、肝脏、脾脏、头肾、肠道、眼、胃和肾脏中均表达,其中atp1α1 基因在鳃中表达水平最高,其次为肾脏和肠,鳃与其他组织的表达量均差异显著(P<0.05);atp1β1 基因在心脏中表达水平最高,其次为肝脏、肠、肾脏和鳃等组织(图8)。

图8 “鲟龙1 号”atp1α1 基因与atp1β1 基因组织表达差异Fig.8 Tissue expression difference of atp1α1 gene and atp1β1 gene in the hybrid sturgeon
2.5 不同碱度下“鲟龙1 号”鳃atp1α1 基因和atp1β1 基因的表达特征
不同碳酸盐碱度下,“鲟龙1 号”鳃中atp1α1 基因和atp1β1 基因的表达特征显示,atp1α1 基因的表达水平随碱度升高呈先上升后下降趋势,其中T1组的atp1α1 基因表达水平显著高于对照组(P<0.05),T2 组与T3 组的atp1α1 基因表达水平均低于对照组,差异不显著(P>0.05);atp1β1 基因的表达水平随碱度升高而下降,组间表达水平差异不显著(P>0.05)(图9)。

图9 “鲟龙1 号”鳃atp1α1 与atp1β1 基因在不同碱度下的表达特征Fig.9 Expression characteristics of atp1α1 and atp1β1 genes in gill of the hybrid sturgeon exposed to different alkalinities
3 讨论
鲟形目鱼类的染色体核型复杂,鲟鱼的基因组大小与染色体倍型仍有争议。主流观点认为达氏鳇核型为四倍体,施氏鲟核型为八倍体。然而杂交鲟“鲟龙1 号”的染色体核型仍尚未被阐明,这给杂交鲟的基因研究工作增加一定了难度[27]。研究证实,动物远缘杂交后代的表型和基因型都会发生改变,表现为介于父母本的杂交特征。在雌性白鲫(Carassius auratus cuvieri Temminck et Schlegel)和雄性红鲫的杂交研究中,其杂交子代序列兼有双亲特异碱基位点,表现出了重组现象[28,29]。本研究发现,杂交鲟“鲟龙1 号”的atp1α1 基因和atp1β1 基因无多态性扩增,推测其基因重组稳定,但由于目前亲本基因组信息较少,杂交子代的基因重组机制仍有待进一步研究。由于动物杂交导致易遗传水平的基因组失衡,故不同倍体杂交也可能发生不兼容现象[30],但在生产实践中,“鲟龙1 号”的子代两性可育,表型稳定遗传,可能得益于鲟科鱼类复杂的染色体倍型,符合孙大江等的猜想[27]。
鱼类的NKA 主要由分子量约为100 KDa 的α催化亚基和分子量约为40 KDa 的β 辅助亚基组成[31]。其中,云斑尖塘鳢(Oxyeleotris marmorata)[32]的NKAα1 亚基分子量为112.5 KDa,攀鲈(Anabas testudineus)[33]的NKAα1 亚基分子量为113 KDa,遮目鱼(Chanos Chanos)[34]的NKA α1 亚基分子量为100 kDa,NKA β1 亚基分子量为40 KDa。与其它鱼类的研究结果相似。本研究中,“鲟龙1 号”的NKAα1 亚基分子量为113.01 KDa,NKA β1 亚基分子量为34.80 KDa。NKA 在执行离子转运功能的过程中,需要通过cAmp 依赖性蛋白激酶(PKA)和蛋白激酶C(PKC)等的作用下被磷酸化和去磷酸化,改变NKA 亚基的构型,而泵入钾离子和泵出钠离子[18]。NKA 磷酸化位点的分布与数量具有物种差异性,如攀鲈NKA 亚基的磷酸化位点为丝氨酸(Ser),果蝇(Drosophila virilis)的磷酸化位点为苏氨酸(Thr),在NkAα1 和NkAβ1 中保守[35]。本研究中,“鲟龙1 号”的NKA 具有多个潜在磷酸化位点,包括丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr),与攀鲈NKA 功能相同。鲟NKA 磷酸化位点数量决定了其较强的盐碱适应能力。
研究证实,NKA 中的α1 亚基与β1 亚基广泛分布于鱼类的各组织中[36,37]。本研究中,“鲟龙1 号”atp1α1 和atp1β1 基因在鳃、心脏等11 个组织中均有分布,其中atp1β1 基因在心脏与肝脏中高表达,推测其可能参与调控心肌与肝脏中的生物过程[38,39]。鱼类在响应非等渗透介质胁迫时会发生不同的NKA表达模式。对遮目鱼[35]、鳉(Oryzias latipes)[40]与攀鲈[41]等鱼类的研究结果表明,鳃中NKAα1 和NKAβ1 参与了渗透压转换调节,且NKAα1 和NKAβ1 亚基的mRNA 表达水平与蛋白质含量在鱼类由海水至淡水转移过程中逐渐升高,被视为“高渗介质NKA 低表达型”鱼类,而对瓦氏雅罗鱼(Leuciscus waleckii)[42]的研究结果表明,其NKA 活性随盐碱浓度增加而增加,被视为“高渗介质NKA高表达型”鱼类。与遮目鱼[35]等鱼类相似,“鲟龙1号”鳃组织中atp1α1 和atp1β1 基因的mRNA 表达水平随碱度上升而下降,碱度达到12.10 mmol·L-1时均开始低于对照组水平,推测“鲟龙1 号”为“高渗介质NKA 低表达型”鱼类。值得注意的是,碱度为7.61 mmol·L-1的条件下,“鲟龙1 号”的鳃中atp1α1 基因的mRNA 表达水平显著高于对照组和高碱度组(P<0.05),而atp1β1 基因的表达水平无显著变化。研究发现,当大西洋鲑(Salmo salar)和虹鳟(Oncorhynchus mykiss)等鲑科鱼类逐渐暴露于海水中时,在Nka1b 基因的mRNA 表达水平上升之前,NKA 活性已经增强,表明NKAα 亚基可能已经优先发生响应[18,43]。与鲑科鱼类相似,“鲟龙1 号”的NKAα 亚基在低碱度下优先发生响应,而NKAβ亚基作为辅助亚基,起到稳定NKAα 亚基构型及调节NKAα 亚基活性的作用,变化不明显。当碱度上升到12.10 mmol·L-1时,atp1α1 基因的mRNA 表达水平下降,推测NKA 功能已受阻,该结果与大鳞鲃[15]相似。
综上所述,杂交鲟“鲟龙1 号”NKAα1 和NKAβ1 具有高度保守区域,与小体鲟的亲缘关系最近;atp1α1 和atp1β1 基因表达具有组织表达特异性,其中atp1α1 基因在鳃组织中表达水平最高,atp1β1 基因在心脏中表达水平为最高。不同碳酸盐碱度下,“鲟龙1 号”的atp1α1 基因在碱胁迫下优先发生响应,表明NKA 参与了“鲟龙1 号”的碳酸盐碱度胁迫应答。

