雷公藤组织培养外植体可溶性糖含量研究
黄淑燕, 江龙
福建林业职业技术学院,福建 南平 353000
雷公藤(Tripterygium wilfordiiHook.f.),卫矛科(Celastraceae)雷公藤属(Tripterygium),又称黄藤根、黄腊藤、水莽草、红药、断肠草、菜虫药等,多年生落叶蔓性灌木[1]。植物体内的碳素营养状况常以糖含量作为重要的指标,可溶性糖是植物光合作用的主要产物,在植物细胞内作为一种能源消耗及储藏物质,属于非结构性碳水化合物,参与着多种代谢活动,为代谢活跃的胚性细胞提供充足的能源[2,3]。可溶性糖中的蔗糖是植物有机物运输、贮藏及积累的主要形式[4],其代谢含量的变化反映了植物细胞对碳源及能源的吸收和利用情况。组织培养过程中,培养基中可溶性糖的消耗与植物种类、培养体系及所处生长状态状况密切相关,含量因生长阶段的不同而有所差异[5]。相关研究表明,碳水化合物中的可溶性糖类,可为大量植物不定根的形成提供必需的营养物质[6],是生根过程不可或缺的。目前,研究证明糖在细胞内是以一种信号分子存在的,其在植物的生长发育等许多过程中均发挥着调控的作用,其还可以作为细胞内许多基因表达的重要调节因子。因此,对植物组织培养各阶段的可溶性糖含量的测定,可为今后的研究工作提供一定的参考依据。
1 材料与方法
1.1 试验材料
雷公藤组织培养无菌外植体:即雷公藤外植体置于事先配制好的培养基上,培养至0、7、14、21、28、35 d时,取不同培养时期的外植体进行重复3次的可溶性糖含量测定。
1.2 试验方法
2011年8月,采用蒽酮法作为可溶性糖含量测定的方法[10],样品溶液测定方法见表1。
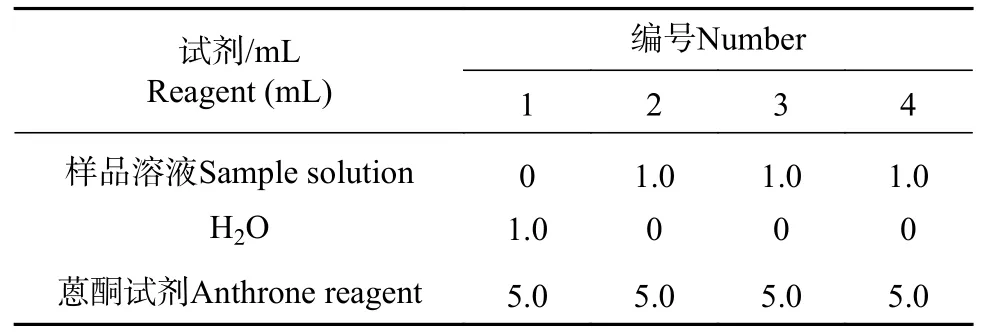
表1 样品溶液制定方法Tab. 1 Methods for preparing sample solution
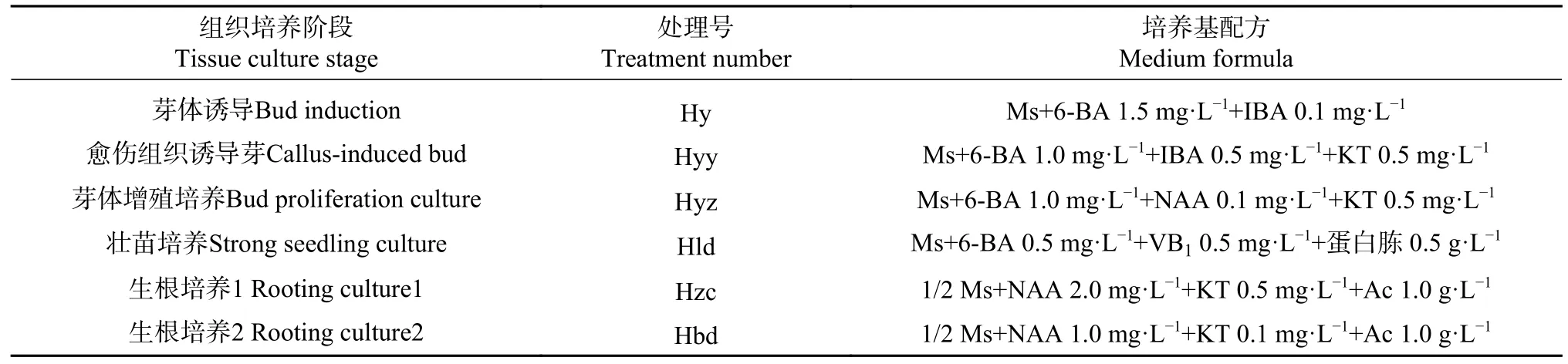
表2 组织培养各阶段培养基配方Tab. 2 Culture medium formula in different stages of tissue culture

表3 不同碳源对可溶性糖含量影响培养基配方Tab. 3 Effects of different carbon sources on soluble sugar content in culture medium formula
说明:1. 温度控制在100℃;2. 从100℃开始准确计时20 min,然后迅速冷却,于室温中平衡10 min;3. 蒽酮注意避光保存,当天配制当天使用;4. 试管干燥清洁;5. 在冰浴条件下加入蒽酮,生成的颜色较稳定,在4 h内无明显变化;6. 每个试验重复3次[10]。
1.3 试验方案
以雷公藤组织培养各过程最佳配方对无菌外植体进行培养,每培养7 d,测定各处理可溶性糖含量变化,利用标准曲线及相关公式计算出可溶性糖含量值。经过35 d的6次测定后,对结果进行分析对比,探讨可溶性糖含量的变化。
1.3.1 组织培养各阶段培养基配方
基本培养基为:MS+蔗糖∶30 g·L-1+琼脂∶8 g·L-1;pH=5.8;处理号Hy、Hyy、Hyz、Hld、Hzc、Hbd对应组织培养阶段中芽体诱导、愈伤组织诱导芽、芽体增殖培养、壮苗培养、1号生根培养和2号生根培养的培养阶段。
1.3.2 生根培养阶段不同碳源配方
基本培养基为:1/2 MS+琼脂8 g·L-1;碳源:蔗糖、葡萄糖;pH值5.8;激素:NAA、KT。根据试验需要,建立6种培养基组合方式,对比可溶性糖含量变化,以处理号Z1、Z2、Z3、P1、P2、P3表示。
2 结果与分析
2.1 不同组织培养阶段外植体可溶性糖含量变化
雷公藤芽诱导分化阶段,对培养0、7、14、21、28、35 d的外植体进行可溶性糖含量测定。据图1显示,当芽诱导培养至第7 d时,可溶性糖含量上升,表明此时外植体正储备营养物质来满足芽体诱导;第14 d时,含量最低,表明在7~14 d时间段内,已完成芽体诱导过程;在第21 d出现第二次峰值表明此时外植体的分化增值需要大量营养物质。在14~21 d期间,外植体通过光合作用及培养基中的糖含量为可溶性糖合成提供一定基础,因而,第21 d出现峰值要高于第7d含量。第21~35 d期间,可溶性糖含量呈下降的趋势,表明此期间芽体营养和增粗生长同步进行。
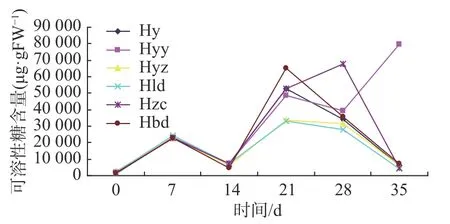
图1 不同组织培养阶段可溶性糖含量变化曲线图Fig. 1 Variation curve of soluble sugar content at different tissue culture stages
愈伤组织诱导芽阶段,可溶性糖含量出现三次高峰值,当外植体培养至7 d过程中,愈伤组织逐渐吸收营养物质,表明愈伤组织诱导芽初期需要大量可溶性糖;当到第14 d时愈伤组织逐渐变大且愈伤组织表面有许多小芽分化,因而这两个时间段可溶性糖先上升后下降。由于芽体纵向生长需大量营养物质,因此14 d~21 d期间,外植体处于营养物资积累准备阶段而出现第二个峰值。
Hy、Hyz及Hld阶段可溶性糖含量比较发现,与芽体培养相关的这三个阶段,可溶性糖含量变化趋势基本是一致的,其峰值及低谷出现时间是一样的,所不同的是在第21~28 d培养时间段内,芽诱导可溶性糖含量下降幅度大于增殖及壮苗培养,而壮苗下降幅度大于增殖培养。可知,芽体处于营养生长时期的芽诱导阶段需要的糖含量大于增殖及壮苗培养阶段,壮苗培养对糖含量的需求大于增殖培养。图1所示,培养35 d后,壮苗培养的可溶性糖含量最低,其次为增殖培养,最后为芽诱导,因而在营养生长后期,应及时适度地增加营养物质以保证芽体的快速良好生长。
图1 Hzc和Hbd曲线所示,生根初期,可溶性糖是外植体进行正常的新陈代谢及保证根原基分化必不可少的营养及能量物质来源,该阶段,植物体内将淀粉转化为可溶性糖,引起第一次上升即培养的第7 d;根系诱导过程,对可溶性糖含量的吸收导致其下降,培养的第7 d-14 d;当根系诱导完成后,其需要吸收培养基内的碳源即将蔗糖转化为可溶性糖,同时植株本身进行正常的新陈代谢,随着光合作用增强,体内的可溶性糖的含量逐渐上升,且比第一次的峰值高。随着不定根的迅速伸长及增粗,促进了呼吸作用,加快外植体内可溶性糖转化利用,此时可溶性糖应处下降趋势,但1号生根培养在培养第21 d后,可溶性糖含量继续上升,比较两个生根方案发现,较高浓度外源激素对根系增殖分化起到促进作用,促使两种生根方案可溶性糖变化趋势不同。这也表明在21~28 d期间,1号生根培养外植体继续进行根系诱导过程。
2.2 不同碳源及浓度对生根培养阶段外植体可溶性糖含量影响
雷公藤生根培养阶段不同碳源及浓度处理,外植体生长结果如表4所示,可溶性糖含量趋势变化如图2所示。
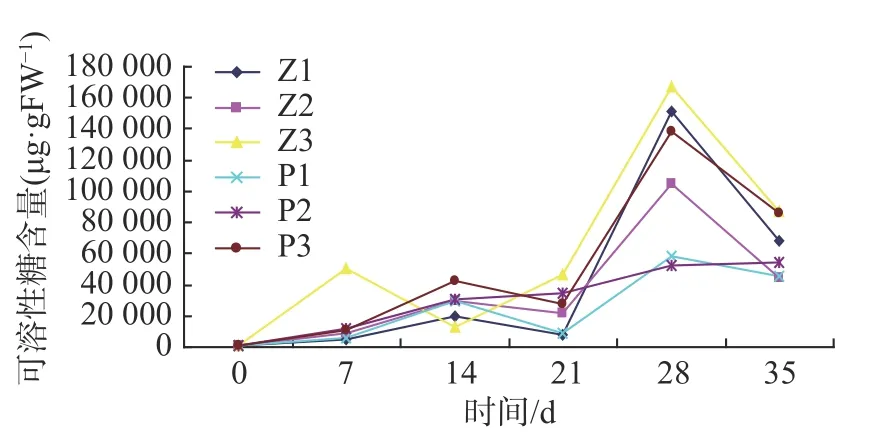
图2 不同碳源及浓度处理可溶性糖含量变化曲线图Fig. 2 Variation curve of soluble sugar content under different carbon sources and concentrations
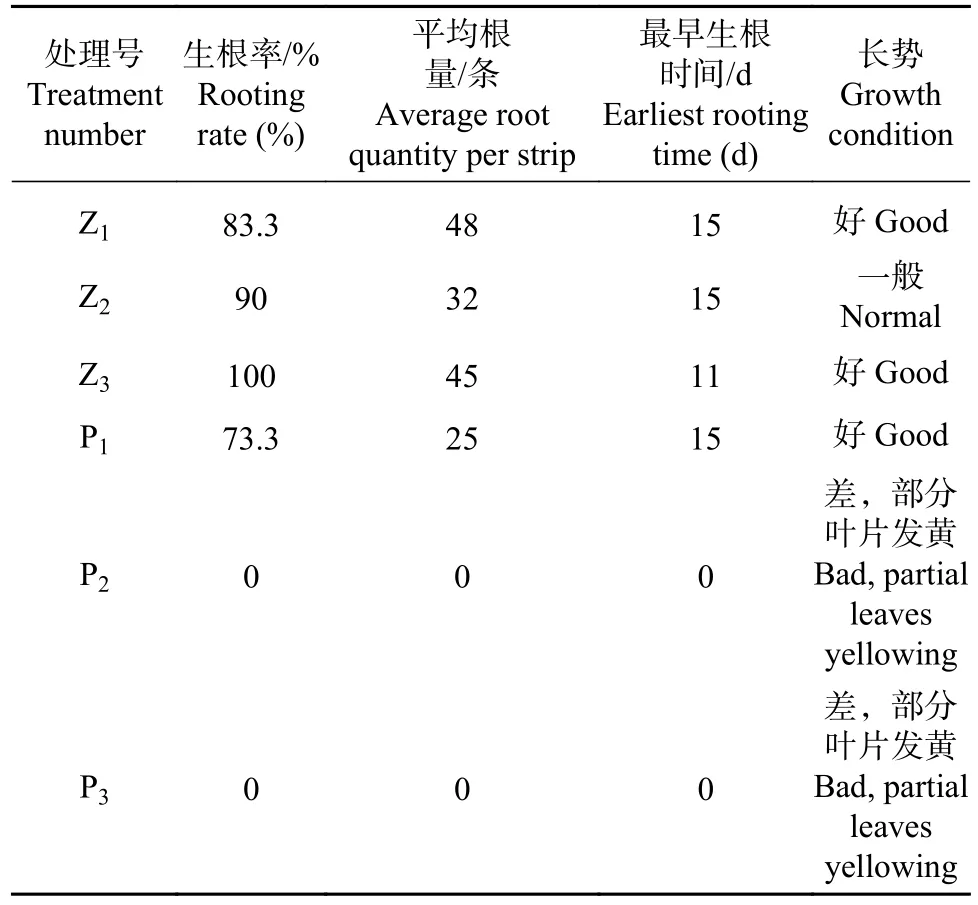
表4 各处理组织培养观察结果Tab. 4 Observation results of tissue culture treatment
据表4数据可得,生根培养周期内,葡萄糖的添加雷公藤生根效果(生根率、最早生根时间)不佳且外植体长势差、根量低。且生根培养的最佳碳源是蔗糖,浓度以30 g·L-1最佳。
图2所示,除P2(20 g·L-1葡萄糖)处理外,其余处理均在0-35 d培养期间出现可溶性糖含量的双峰值,但峰值出现的时间不同。除Z3(30 g·L-1蔗糖)处理外,其余四个处理双峰值出现时间为培养的第14 d及第28 d,而Z3处理峰值出现于培养第7 d以及培养第28 d。第一个峰值出现时间意味着第一次根系诱导的开始。如表4所示,Z3处理的生根时间最早(培养第11 d)。培养第28 d峰值的出现是为了提供根系的增殖及营养生长,因而其可溶性糖含量高。同时,由图2可得,葡萄糖添加处理的在0-14 d培养时间段内,可溶性糖含量明显高于蔗糖处理,因而,葡萄糖是雷公藤组织培养前期的优质碳源来源,其利用转化率高。
可溶性糖虽能为外植体提供大量营养物质,但应处于最佳含量,过高或过低均不利于生根。P2(20 g·L-1葡萄糖)处理可溶性糖一直呈上升趋势,原因在于过高含糖量,导致植物细胞内外环境渗透压失调,抑制了植物对营养物质的吸收,导致了外植体因营养缺失而生长发育不良。同时从以上图2及表4可知,可溶性糖含量的变化7 d为一个周期,因而,对于雷公藤组织培养来说,7 d为其植物体生长发育的小周期,应适时根据实际情况更换培养基。
3 结论与讨论
3.1 可溶性糖含量变化与愈伤组织诱导芽之间关系
愈伤组织不管是增殖生长还是分化生长,其必须有一个内外糖含量趋于平衡的浓度,因为只有细胞内外糖浓度处于平衡状态,细胞培养方能处于最佳生长状态,此时也正是愈伤组织生长分化最有利时期[11-12]。观察发现,雷公藤外植体中糖浓度一个时间段的上升就伴随着另一时间段的下降以求平衡。研究表明,随培养天数增加,外植体中可溶性糖总体趋势处于上升而非下降趋势,因而在后期培养中,外植体需要更多的营养物质来提供其生长发育。本试验中,利用愈伤组织诱导所得的芽体进行光合作用来为其提供更多的养分,因而培养天数增加,糖含量不仅不减少,反而增加,但若只有愈伤组织而没有芽体的存在,外植体将会缺失营养,此时应及时更换培养基。
3.2 可溶性糖含量变化与不定芽分化、增殖及生长发育之间关系
当外植体接种到芽生长发育培养基上后,有关碳水化合物合成的酶活性增强,促进了植物组织细胞内可溶性糖的合成。导致可溶性糖含量在一段时间内,呈迅速增长趋势。芽体分化及增殖阶段的完成伴随着可溶性糖含量随着上升—下降—上升。可溶性糖含量反映了体内作为有效态营养物的碳水化合物和能量水平,高浓度的糖可能会抑制芽点的增多,如果芽点数量过多会消耗大量的可溶性糖,使得分化较好的处理可溶性糖含量降到最低。只有适量的糖含量才能更好地促进芽的生成,这与郭维明研究花烛愈伤组织不同继代培养的再分化差异的结果是一致的[14]。
3.3 可溶性糖含量变化与生根培养之间关系
生根前期,茎段根部有愈伤组织生成,因而必须进行细胞分裂,此时植物体内的淀粉溶解,为其提供了大量营养物质,因而植物体内可溶性糖含量上升;根系诱导过程中,随着茎段基部对可溶性糖的吸收,体内糖含量便不断下降;随后植物体对培养环境的适应及外植体叶片进行光合作用,令外植体内可溶性糖含量上升;不定根伸长增粗及增殖生长,令植物体呼吸作用增强,便消耗了大量营养物质,因而糖含量再次下降且不再上升。
观察发现,1号生根培养中,外植体在培养至第7d时及28d时,可溶性糖含量达峰值,在培养至第14d及35d时,可溶性糖含量最低,可能由于较高外源激素添加,使得培养基中糖含量在21d时上升,进而呈现的生根效果优于2号生根培养。
3.4 不同碳源及浓度添加对雷公藤生根培养可溶性糖含量变化影响
外源糖类的存在与否及使用浓度的大小对生根产生的影响我们解释为是由于碳源缺乏引起异养无根苗的饥饿和或渗透压处于亚最适水平或超最适水平。在植物组织培养中,不同植物种类的不同培养阶段,需要的糖浓度及种类不同。据报道,如果向发育阶段幼苗的外部环境提供过量的葡萄糖会引起幼苗生长的停滞和分化的中断,这可能和ABA合成的增多和一些ABA信号基因活化有关[15]。本文中,最佳碳源的使用浓度及种类为30 g·L-1蔗糖,其次为20 g·L-1蔗糖,再者是10 g·L-1蔗糖。葡萄糖的使用,外植体不仅生根效果差,还令植物体处于营养缺乏状态,抑制其生长发育。

