分子标记辅助选择小麦赤霉病抗病基因聚合体
陈天青, 李红艳, 王 伟, 隋建枢, 罗永露, 吴文强, 程 斌, 何庆才
(1.贵州省农业科学院旱粮研究所, 贵阳 550006; 2.贵州医科大学, 贵阳 550025)
条锈病(Stripe rust,SR)和赤霉病(Fusarium head blight,FHB)分别是由条形柄锈菌(Pucciniastriiformisf.sp.tritici)和禾谷镰刀菌(Fusariumgraminearum)引起的小麦病害[1-2]。条锈病会破坏叶片的表皮组织,使植株叶面积指数减少,光合作用降低,导致小麦生长发育受阻、产量降低[3]。赤霉病主要为害穗部,影响籽粒储藏物质的合成,籽粒被侵染后产生的真菌毒素会严重危害人畜安全[4]。贵州省因气候潮湿多雨,一直是小麦多种病害(条锈病、白粉病、叶锈病)重发区,近年来小麦赤霉病由我国长江中下游冬麦区、华南冬麦区西扩,已上升为贵州省小麦的主要病害[5]。
抗病基因的发掘和抗病育种是防治小麦病害的有效方法。国内外众多学者长期从事于抗病基因发掘工作。目前,国际上已正式命名了83个抗条锈病基因(Yr1~Yr83)[6],7个赤霉病抗病基因(Fhb1~Fhb7)[7-12]。
由于许多条锈病抗病基因具有小种专化性,随着新的条锈菌强毒性小种条中34的出现,很多已知的条锈病抗病基因的抗性正在丧失[13]。贵协2号是贵州大学张庆勤教授通过野生二粒小麦与光稃野燕麦远缘杂交、普通小麦回交等方法选育而成的小麦新品系,经田间成株期抗性鉴定对条锈病免疫至高抗水平,目前抗病基因虽不明确,但仍作为贵州主要的小麦条锈病抗源使用。
小麦赤霉病抗性是多基因控制的数量性状,容易受环境的影响,目前已命名的主效基因中,Fhb1、Fhb2、Fhb4、Fhb5为报道较多、且较为稳定的主效基因,而Fhb1又是其中效应最大、抗性最稳定、并在国内外应用最广泛的抗病基因[14]。目前,贵州省对赤霉病的研究仅限于材料的抗性鉴定和筛选,鲜有赤霉病抗性改良和聚合育种的报道。NMAS22是南京农业大学马正强教授团队以山东背景材料PH691为受体,赤霉病抗病品种望水白为供体,经杂交、不断与PH691回交,分子标记辅助选育而成的新品系,对赤霉病表现为高抗,摆脱了望水白的不利农艺性状,且携带有Fhb1、Fhb2、Fhb4、Fhb5等4个赤霉病抗病基因。
本研究将条锈病新抗源贵协2号和赤霉病新抗源NMAS22杂交,并构建了F2代临时分离群体,采用田间鉴定与分子标记辅助选择相结合的方法,筛选条锈病与赤霉病兼抗的植株,为新种质创制提供基础材料。
1 材料与方法
1.1 试验材料
小麦材料为贵协2号、NMAS22及以其构建的F2代临时群体;禾谷镰刀菌菌株(PH-1、F0609、F0980)由贵州省农业科学院植物保护研究所陈文博士惠赠。
1.2 试验设计
将贵协2号和NMAS22杂交获得的F2代的籽粒播种,试验采用单行区,行长2 m,行距0.3 m,点播,每5 cm播种1粒,每行播种40粒,播种20行。在小区的四周种植条锈病诱发材料SY95-71。
1.3 小麦条锈病田间鉴定
采用自然诱发鉴定,在自然发病的情况下对F2代群体进行成株期调查,待SY95-71充分发病后,观察记录群体植株对条锈病的反应型。抗条锈性评价分级参考0~4级判定标准[15]。
1.4 小麦赤霉病田间鉴定
在小麦扬花初期,采用单花滴注法接种小麦赤霉病致病菌。将禾谷镰刀菌菌株分生孢子液(105个/mL)滴入中选单株麦穗中部小穗的单侧小花中。小麦黄熟前(接种后约21 d)调查接种穗的病小穗率和病害发生等级,计算平均严重度[16]。根据划分标准划分为免疫(I)、高抗(HR)、中抗(MR)、中感(MS)、高感(HS)[17]。
平均严重度(S)=∑(各病级穗数×相应病级数)/总调查总穗数。
1.5 分子标记检测
取具有条锈病抗性植株的叶片装入离心管,经液氮冷冻后用植物组织研磨仪研磨成粉末,CTAB法[18]提取DNA。采用与Fhb1、Fhb2、Fhb4、Fhb5连锁的标记(表1)对中选植株进行赤霉病抗病基因分子检测。PCR扩增采用10 μL体系,即2×TaqMaster Mix 5 μL,5 μmol/L正反向引物各0.2 μL,DNA模板(35 ng/μL) 2 μL,加ddH2O 2.6 μL补足10 μL。PCR扩增程序:94 ℃预变性5 min,94 ℃变性1 min,退火1 min(退火温度根据引物设置),72 ℃延伸2 min,共35个循环,72 ℃终延伸10 min,4 ℃保存。
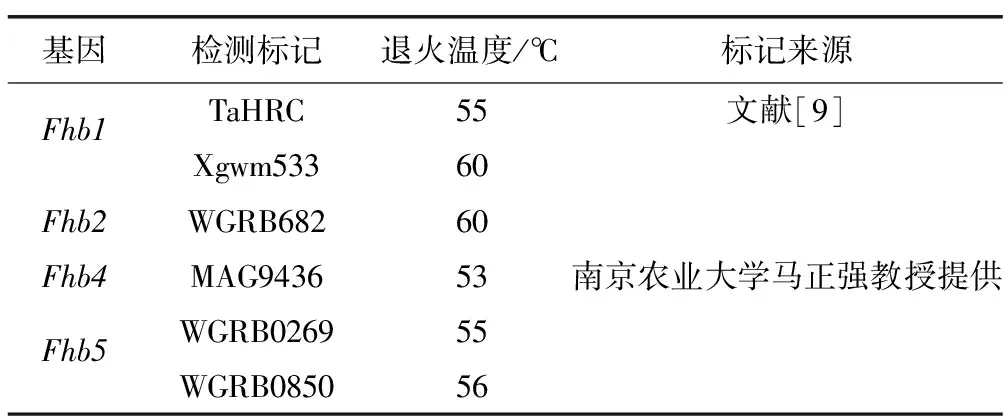
表1 抗赤霉病基因检测标记信息
采用1.5%琼脂糖凝胶或8%非变性聚丙烯酰胺凝胶电泳分析扩增产物。把F2代群体的带型与亲本NMAS22、贵协2号的带型相比较,与NMAS22带型相同记录为R,与贵协2号带型相同记录为S,杂合型记录为H,未有效扩增记为N。对于单标记检测的基因(Fhb2和Fhb4),带型为R、H的单株,认为其携带有抗病基因;对于双标记检测的抗病基因(Fhb1和Fhb5),两个标记的带型为R/R、H/H或R/H的单株,认为其携带有抗病基因,其中R/R为基因纯合型,H/H和R/H为基因杂合型。
数据分析方法:一般统计分析采用Excel2013软件进行,赤霉病抗病基因型与田间抗性的相关分析采用SPSS version20软件进行。
2 结果与分析
2.1 小麦群体赤霉病与条锈病田间抗性表现
采用自然诱发法对732个NMAS22×贵协2号F2代单株进行条锈病抗性鉴定,结果显示,在该群体中有349株表现为抗病(0~2级),有383株表现为感病(3~4级)。
采用单花滴注法完成了对F2代群体中685个单株的赤霉病抗性鉴定,结果表明,332个植株表现为高抗赤霉病,占群体总数的48.4%,135个植株表现为中抗赤霉病,占群体总数的19.6%,46个植株表现为中感赤霉病,占群体总数的6.7%,172个植株表现为高感赤霉病,占群体总数的25.1%。
2.2 赤霉病抗病基因的分子标记检测及遗传分析
用与抗赤霉病基因Fhb1、Fhb2、Fhb4、Fhb5相关的6对分子标记,对挑选出的具有条锈病抗性的植株样本进行检测,结果如图1和表2所示。经对双标记检测基因的合并分析,在349份被检测植株中,检测到携带Fhb1、Fhb2、Fhb4、Fhb5的单株分别为201,245,248,194株,占被检测植株的57.6%,70.2%,71.1%,55.6%,其中纯合基因型植株分别为48,104,92,57株,占被检测植株的13.8%,29.8%,26.4%,16.3%。
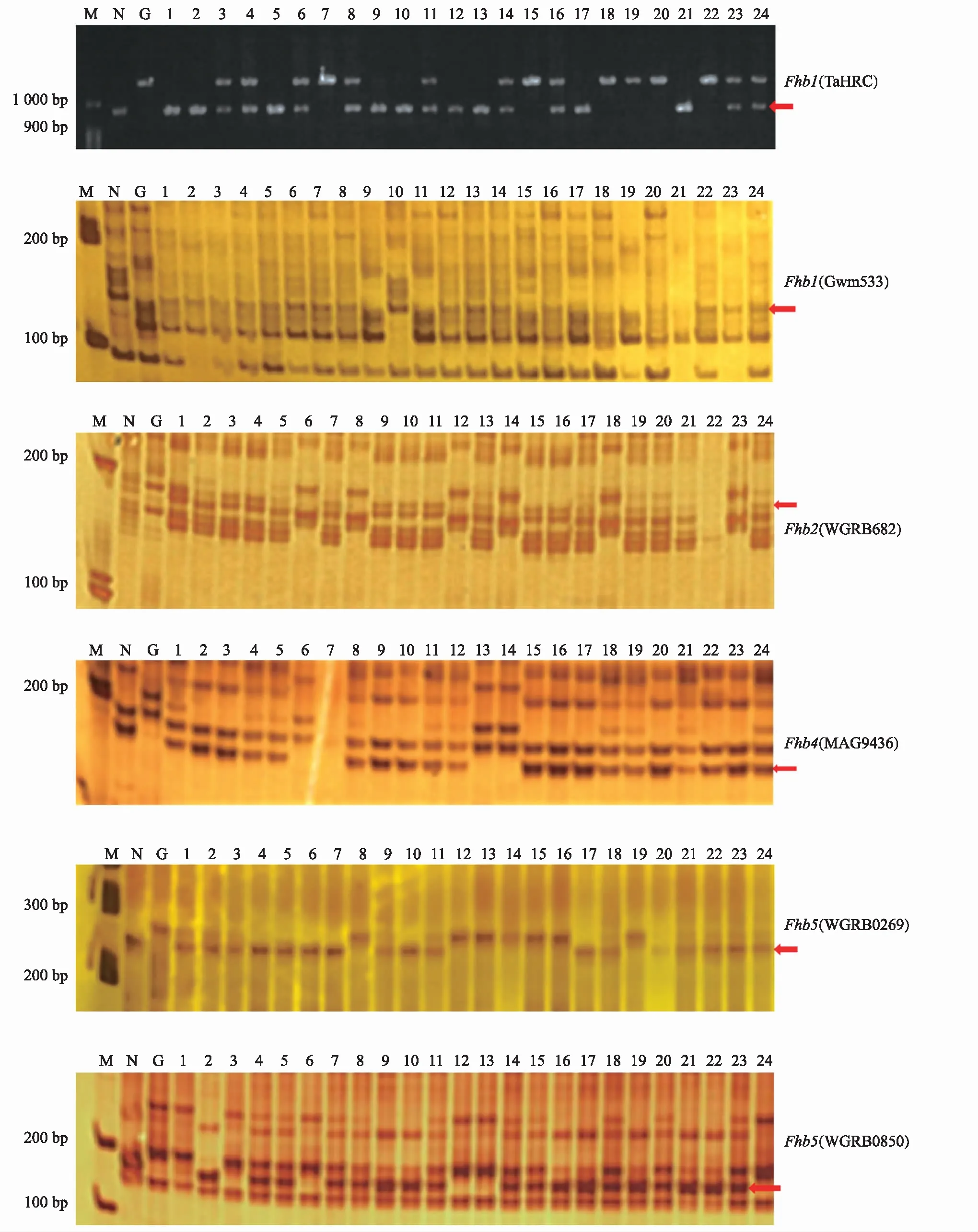
注:红色箭头指示抗病基因条带;M为Marker;N为NMAS22;G为贵协2号;1~24号为F2代群体的部分单株。
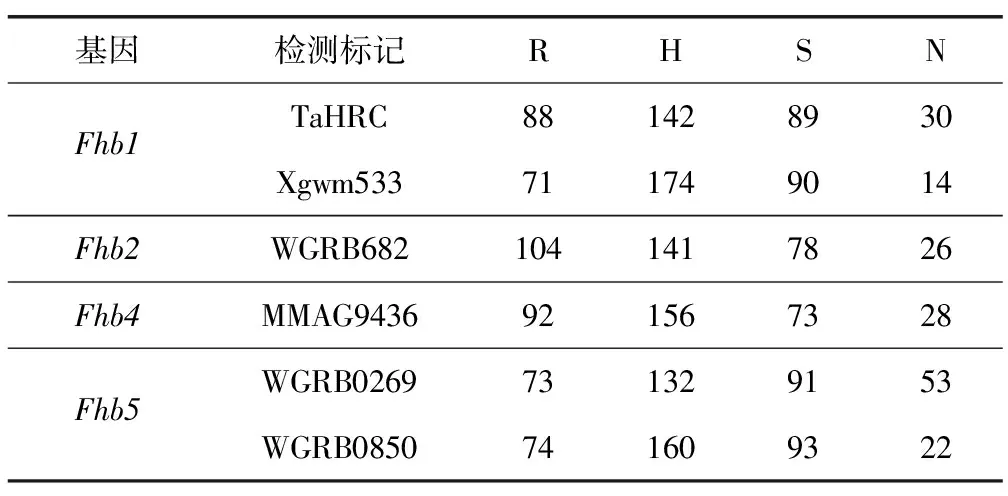
表2 抗赤霉病分子标记检测结果
对以上标记不同基因型统计结果分别进行分离比的适合度测验,结果(表3)显示,Fhb1基因位点的TaHRC标记和Xgwm533标记、Fhb2基因位点的WGRB682标记、Fhb4基因位点的MAG9436标记、Fhb5基因位点的WGRB02659标记和WGRB0850标记的卡方值分别为3.85,2.66,5.57,2.50,5.65,2.36,均小于p=0.05水平的卡方值,F2代群体各单株基因型符合预期的1∶2∶1的分离比,表明其结果遵循孟德尔遗传定律,即在F2代群体中对条锈病抗性单株的筛选不会引发Fhb1、Fhb2、Fhb4、Fhb5基因位点偏分离。
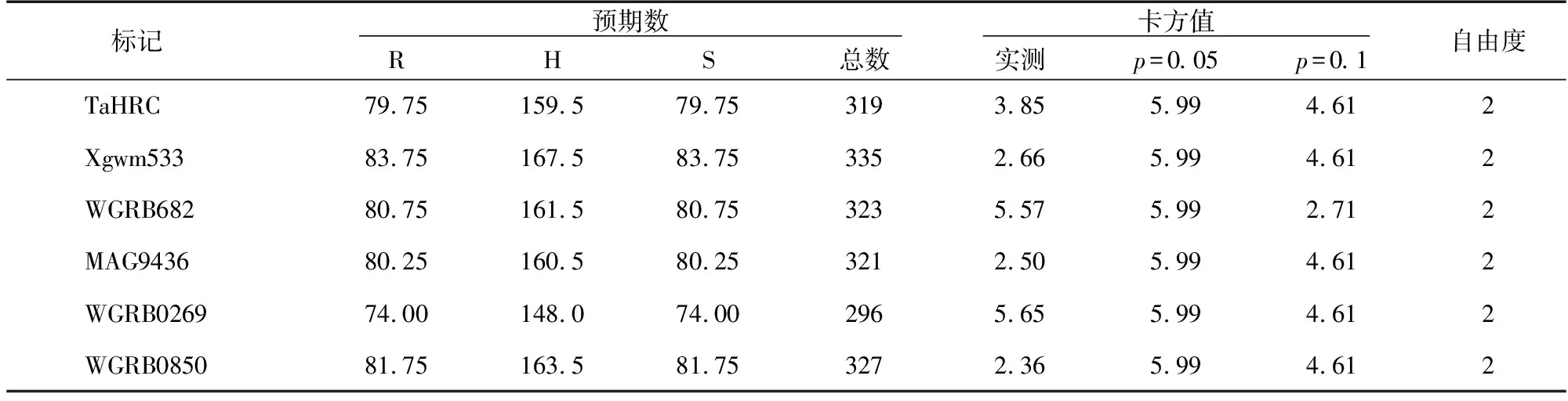
表3 卡方测验分析结果
2.3 赤霉病抗病基因组合类型分析
由表4可见,三基因组合类型的单株最多,占被检测单株的40.1%,其次为四基因组合和双基因组合,分别占被检测单株的24.4%和22.6%,而只携带1个抗病基因或不携带抗病基因的单株较少,仅占被检测单株的10.6%和2.3%。
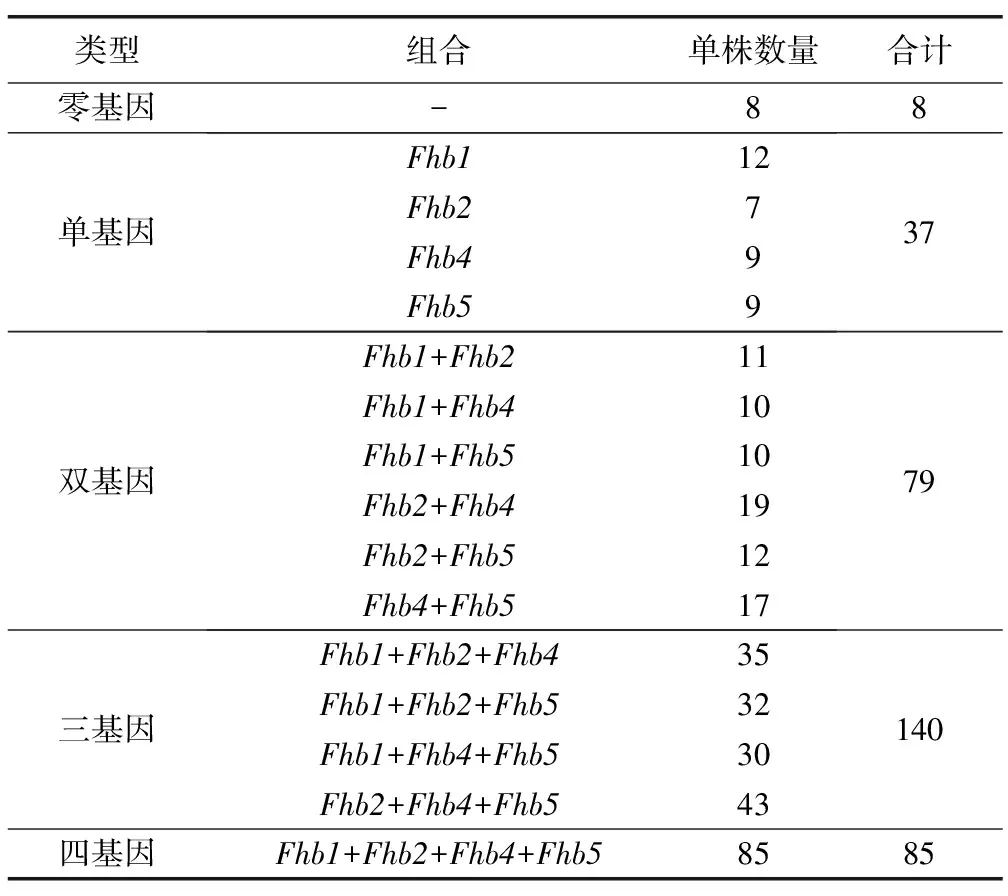
表4 赤霉病抗病基因组合分析
2.4 抗性相关性分析
将田间性状鉴定结果与分子标记检测结果做相关性分析,结果(表5)显示,Fhb1基因位点的TaHRC标记和Xgwm533标记与病小穗率相关性为-0.261与-0.180,呈显著负相关,Fhb2、Fhb4、Fhb5基因位点标记与病小穗率相关性均不显著。
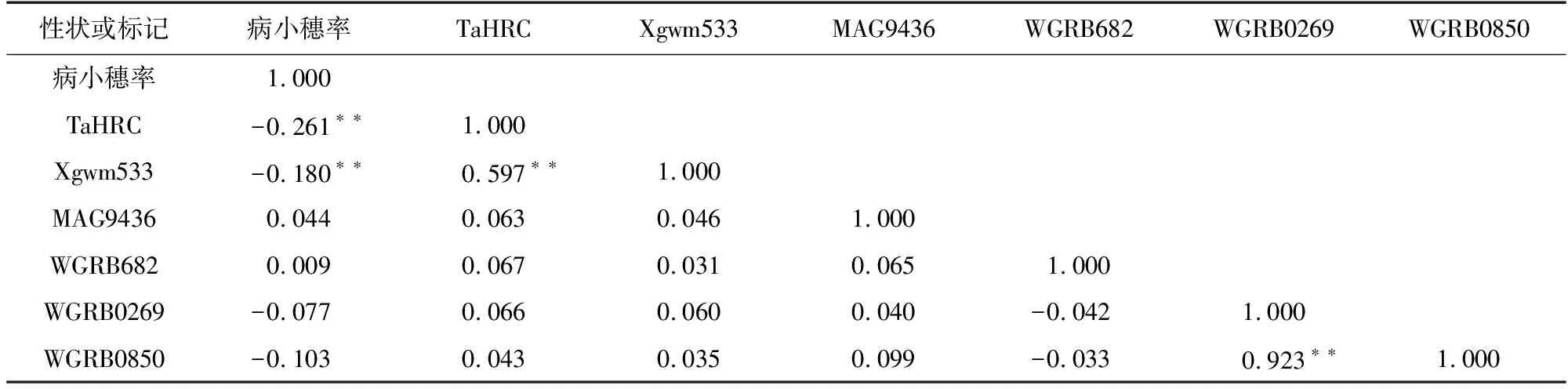
表5 相关性分析结果
2.5 四基因组合中纯合基因数量分析
由表6可见,85份四基因组合型单株中,有25份携带1个纯合的抗赤霉病基因,37份携带2个纯合的抗赤霉病基因,20份携带3个纯合的抗赤霉病基因,仅3份携带4个纯合的抗赤霉病基因。

表6 四基因组合类型中纯合基因数量
4 讨 论
小麦赤霉病和小麦条锈病的危害逐年加重,除气候和环境变化影响外,抗病品种缺乏也是重要原因之一。
小麦赤霉病抗性是由多基因控制的数量遗传性状,其抗性鉴定结果易受到环境影响,田间表型鉴定效果差,不利于育种后代的选择[19-20]。要筛选抗赤霉病的育种材料,需要建立适宜的抗性鉴定技术和创造小麦发病有利条件,如气候、温度、湿度等。分子标记辅助选择技术可以从基因型方面进行直接选择,具有不受外界环境影响的优点,便于对表型鉴定困难、遗传力低、隐性等性状进行选择,可使品种选育进程效率增加,目前已在多种作物的性状改良上得到成功应用[21-23]。
目前,很多与赤霉病抗性有关的QTL被定位,但是只有少部分QTL位点能发挥较强的效果,如Fhb1,绝大多数的QTL位点效应比较小,容易受环境和遗传背景的影响[20],阻碍了分子标记辅助选择技术在赤霉病抗病育种上广泛应用。目前,正式命名的7个抗病基因(Fhb1~Fhb7)中,Fhb1、Fhb2、Fhb4、Fhb5来自于普通小麦,分别被定位在普通小麦的3BS、6BS、4B、5A 染色体上[7-11]。江苏溧阳小麦地方品种望水白高抗赤霉病,且同时携带了Fhb1、Fhb2、Fhb4、Fhb5,南京农业大学马正强教授团队已经开发了这4个基因位点的相关标记,并转育了携带4个基因的育种材料NMAS22。
本研究利用条锈病新抗源贵协2号与NMAS22杂交,获得F2分离群体,并对群体进行条锈病自然鉴定和赤霉病接种鉴定,获得了349份具有条锈病抗性的植株、467份具有赤霉病抗性的植株。利用Fhb1、Fhb2、Fhb4、Fhb5等4个基因位点标记对349份条锈病抗病株进行检测,最终筛选出85株携带4个抗赤霉病基因(基因型纯合或杂合)的单株。
抗侵染、抗扩展均是小麦对赤霉病抗性的表现形式,本研究中的相关性分析结果显示,Fhb1基因位点上的两对标记均与病小穗率呈极显著相关,而Fhb2、Fhb4、Fhb5这3个基因位点与病小穗率的相关性较低。Fhb1是公认的效应值高、抗性比较稳定、受遗传背景影响较小的抗病基因,在本研究中得到了进一步的证明,可广泛应用于分子标记辅助育种,而Fhb2对赤霉病抗扩展效应值低于Fhb1,在本研究中可能受到遗传背景和环境的影响,表现为与赤霉病抗性相关性不大,故Fhb2不宜作为单一利用的基因应用于分子标记辅助育种。Fhb4和Fhb5在本研究中表现为与赤霉病抗性不相关。Fhb4和Fhb5是抗侵染类型的基因[24],本课题采用单花滴注接种法进行赤霉病抗性鉴定,单花滴注接种鉴定反映的是植株被侵染后的抗扩展能力,却无法反映植株的抗侵染能力[19]。Fhb4和Fhb5在降低实际生产中小麦品种赤霉病发病率上具有重要意义,今后需同样重视该类型基因的应用。本研究已筛选出在Fhb1、Fhb2、Fhb4、Fhb5等4个基因位点均携带赤霉病抗性基因的植株,为今后选育聚合4个抗病基因品种奠定了基础,但这些植株中有些基因位点基因型为杂合型,后续研究需进一步对中选单株后代进行赤霉病抗病基因的追踪与分析。

