铅暴露加重Aβ1-42处理的小胶质细胞活化和小胶质细胞中的铜离子蓄积
陈丽旋,黄定帮,郑 刚,孟晓静
1南方医科大学公共卫生学院职业卫生与职业医学系,广东 广州 510515;2空军军医大学军事预防医学系,特殊作业环境危害评估与防治教育部重点实验室,陕西 西安710032
阿尔兹海默症(AD)是一种神经系统退行性疾病,是痴呆症最常见的类型,占比高达50%~75%[1]。AD的临床特征主要表现为进行性记忆力衰退、认知功能障碍、语言障碍、行为异常等,该疾病严重影响患者的生活质量,常给其自身及家庭带来沉重的身心和经济负担[2]。一项关于中国60岁及以上人群的痴呆症研究报道显示,在我国60岁及以上人群中AD患者约983万人[3]。随着人口老龄化进程的不断加剧,AD已逐渐成为全球面临的重大公共卫生问题和社会经济问题之一。AD公认的病理学特征包括β-淀粉样蛋白(Aβ)沉积和过度磷酸化的Tau蛋白聚集等[4],其危险因素除了遗传因素和生活方式外,还包括广泛的环境因素,如重金属、杀虫剂、空气微粒和纳米颗粒等[5]。
铅(Pb)是一种耐腐蚀的重金属元素,在日常生活中极为常见,并可通过含铅的石油、汽车尾气和工业废气经多种途径进入人体,对人体的呼吸系统、神经系统、消化系统等造成损伤,其中,铅对神经系统的毒性作用不容忽视。研究表明,慢性铅暴露是AD相关神经退行性疾病的重要危险因素[6],铅可造成职业性铅接触人群的简易精神状态检查量表评分降低[7],引起神经炎症[8],加快AD和肌萎缩侧索硬化等神经系统退行性疾病的进展[9,10],但目前尚无流行病学数据明确表明铅可直接导致AD发生。在动物实验方面,铅暴露可诱导大鼠发生AD样病理早期表现,并扰乱其大脑胆固醇代谢[11];铅暴露可增加淀粉样前体蛋白(APP)转基因小鼠大脑中Aβ和淀粉样斑块的蓄积水平[12]。研究指出,小胶质细胞活化及其引发的神经炎症在AD的发病机制中起着极其重要的作用[13,14],目前关于铅引起认知功能障碍等AD样变的机制主要集中于神经元中miRNA与Aβ前体蛋白APP切割酶1(BACE1)的关联[15]、表观遗传变化[16]、氧化应激和细胞凋亡[17]等,而铅是否通过活化小胶质细胞影响AD样变尚未见相关报道。
此外,铅暴露可引起血-脑脊液屏障(BCB)中的金属铜离子稳态失衡,通过影响脉络丛上皮中铜离子转运蛋白CTR1、ATP7A的表达,降低铜离子清除率,引发脑损伤[18,19]。细胞铜摄取主要由高亲和力铜摄取蛋白CTR1完成,ATP7A是铜转运P型ATP酶,可通过依赖ATP的磷酸化和去磷酸化循环催化铜在细胞膜上的转移,以调节哺乳动物中的细胞铜外排[20-22]。研究表明,脑中蓄积的铜离子可与Aβ 相互作用,增强Aβ介导的细胞毒性,并通过APP的铜结合位点和Aβ不同氨基酸残基的直接作用促进AD的发展[23]。铜通过ROS/NF-κB 通路和线粒体自噬障碍诱导小胶质细胞介导的神经炎症[24];铜超载可通过活化原代小胶质细胞中的NLRP3炎症小体诱导慢性神经炎症,引发威尔逊氏症[25]。但目前在铅加重AD样变的病理机制研究中,小胶质细胞铜离子变化及其引发的神经炎症起着怎样的作用尚不明确。因此,本文通过细胞实验探究铅暴露是否诱导细胞铜离子变化以及神经炎症在AD样变发生过程中的作用。
目前常用的AD体外细胞模型包括人神经母细胞瘤细胞系SH-SY5Y、小鼠神经母细胞瘤细胞系N2a、大鼠肾上腺嗜铬细胞瘤细胞系PC12、小鼠小胶质细胞系BV2等,常使用Aβ、过氧化氢、冈田酸、谷氨酸等试剂造模[26-29]。小胶质细胞是中枢神经系统的固有免疫细胞,是神经发育和多种神经退行性疾病发生过程中的快速反应者和关键参与者,可通过改变其形态、运动性和功能调节如诱导ROS产生、释放细胞因子[30,31]等参与各种病理过程,尤其在神经炎症中有重要作用[32,33]。本研究使用了具淀粉样蛋白生成性的Aβ1-42蛋白肽[34]处理BV2细胞建立AD的小胶质细胞模型,以更好地探究铜离子变化诱发的小胶质细胞活化在铅加重AD的进展过程中的具体作用。
1 材料和方法
1.1 仪器和材料
相差显微镜(Olympus,IX700),Odyssey双色红外荧光扫描成像系统(LiCor),激光共聚焦显微镜(Olympus,IX700),酶标仪(Molecylar Devices),Aβ1-42(中肽),六氟异丙醇(Macklin),二甲基亚矾(Biofroxx),DMEM高糖培养液(Gibco),FBS(Gibco),CCK8试剂盒(日本同仁),ELISA试剂盒(酶免),N-乙酰-L-半胱氨酸(NAC)(Yesen),四硫代钼酸铵(TM)(Aladdin),活性氧检测试剂盒(Solarbio),Iba1、iNOS 抗体(CST),CTR1、ATP7A抗体(Abcam)。本课题所使用的细胞为小鼠小胶质瘤细胞系BV2细胞,由山东大学公共卫生学院赵秀兰教授赠予。
1.2 药物制备
1.2.1 Aβ1-42寡聚体 将1 mg Aβ1-42粉末溶于220 μL六氟异丙醇中,静置1 h,待Aβ1-42充分溶解后,将其置于冰上5~10 min后,放于通风橱内,并打开盖子,过夜后加入44 μL 二甲基亚矾,将风干后的Aβ1-42肽膜溶解,制成5 mmol/LAβ1-42合成肽,并使用PBS稀释成100 μmol/L溶液,置于4 ℃,24 h后,4 ℃,14000 r/min离心10 min,取上清,即为Aβ1-42寡聚体,分装后保存于-80 ℃。
1.2.2 抗氧化剂N-乙酰-L-半胱氨酸(NAC)将1 g NAC粉末离心,加入12.256 mL去离子水,制成500 mmol/L储存液,使用0.22 μm滤膜过滤,分装保存于-20 ℃。
1.3 细胞培养及传代
细胞培养使用含有10%FBS的DMEM高糖培养基,细胞培养箱设置培养条件为5%CO2,37℃,每天定时换液,细胞生长密度为80%~90%时,使用胰蛋白酶进行传代。
1.4 细胞铅染毒处理及AD细胞模型的建立
在BV2细胞接种24 h贴壁后,使用DMEM完全培养基,将醋酸铅母液(10 mmol/L)、Aβ1-42母液(100 μmol/L)稀释至相应工作浓度,分别按照Control 组、Aβ1-42组(5、10、15、20 μmol/L Aβ1-42)、Pb 组(5、10、15、20 μmol/L Pb)、Aβ1-42+Pb组(10 μmol/L Aβ1-42+10 μmol/L Pb)加入细胞中,于细胞培养箱(37℃,5%CO2)培养12 h。
1.5 CCK8测定细胞活力
在96孔板中将BV2细胞密度调整为4000~6000/孔,每组设置3个复孔。将药物处理12 h的细胞培养基吸出,加入10%CCK8工作液,每孔100 μL于细胞培养箱中避光孵育1.5 h,于多功能酶标仪450 nm波长处检测吸光度。独立实验重复3次。
1.6 免疫荧光检测细胞内蛋白表达情况
将BV2细胞接种于4个玻底培养皿中,分别加入药物处理12 h后,弃上清。使用预冷的PBS洗1遍,加入1 mL 4%多聚甲醛,室温静置15 min以固定细胞,PBS洗3遍。加入-20 ℃预冷的甲醇1 mL,-20 ℃静置20 min以通透细胞,PBS洗3遍。加入PBS配制的5%BSA封闭,室温静置45 min,PBS洗3遍。加入80 μL一抗Iba1(1∶100)、iNOS(1∶100),置于湿盒中,4 ℃静置过夜,PBS洗3遍。加入100 μLAlexa Fluor 标记的鼠二抗(1∶500),室温避光静置2 h,PBS洗3遍。加入100 μL用甲醇现配的DAPI溶液(1∶20),室温避光静置5 min,甲醇洗3遍。加入200 μL封闭液(PBS:丙三醇=1∶1),于激光共聚焦显微镜(confocal)镜下观察。
1.7 炎性因子的检测
收集BV2细胞培养基上清,500 r/min离心5 min,按照酶免试剂盒说明书进行标准曲线的绘制及样品检测的操作,在多功能酶标仪450 nm处测定吸光度。独立实验重复3次。
1.8 细胞形态学观察
BV2 细胞处于对数生长期时,消化重悬后计数,35 mm 小皿的细胞密度约为2.2×105个,在药物处理12 h后于相差显微镜下观察BV2细胞形态变化。
1.9 检测细胞ROS含量
将处理好的BV2细胞玻底培养皿取出,弃上清,PBS洗1遍。用无血清培养基以1∶1000稀释活性氧荧光探针至终浓度为10 μmol/L,各加入1 mL,于细胞培养箱中避光孵育20 min。无血清细胞培养液洗3遍,confocal镜下观察。
1.10 Western blot检测蛋白表达量
将处理好的BV2细胞取出,弃上清,使用预冷的PBS洗1遍后加入蛋白裂解液,收集蛋白,加入考马斯亮蓝G250于多功能酶标仪560 nm波长处检测吸光度,并根据蛋白质标准曲线换算成相应的蛋白浓度,计算各组上样量。经SDS-PAGE电泳、转膜后用5%BSA室温封闭1.5 h,加入分别用抗体CTR1(1∶1000)、ATP7A(1∶1000)、GAPDH(1∶5000)4 ℃孵育过夜。使用TBST洗膜3次,每次5 min。加入对应的荧光标记二抗(1∶10000)室温敷育1.5 h。洗膜3次,每次5 min。使用Odyssey显影仪扫描荧光蛋白条带,用Image J软件对条带进行分析。
1.11 统计学方法
所有数据均采用Graphpad Prism 6.0软件进行统计学分析,数据以均数±标准差表示。组间比较采用单因素方差分析,并根据方差齐性检验结果选择事后多重比较的方法进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 Aβ1-42导致BV2小胶质细胞激活
Aβ1-42处理细胞12 h 后,随着Aβ1-42浓度的升高,BV2细胞生长活力逐渐下降,15 μmol/L和20 μmol/L Aβ1-42对BV2细胞的损伤有统计学意义(P<0.05,图1A)。检测BV2细胞活化情况,发现10 μmol/L、15 μmol/L 和20 μmol/LAβ1-42可引起小胶质细胞激活的标志物iNOS释放增多(P<0.05,图1B),炎性因子TNF-α和IL-6释放增加(P<0.05,图1C)。后续采用10 μmol/LAβ1-42作为构建AD细胞模型的用药浓度。在此条件下,荧光标记Iba1后于激光共聚焦显微镜下可观察到Aβ1-42处理的细胞呈现胞体增大,突起增多的活化状态,且胞内Aβ蓄积增加,说明AD细胞模型构建成功(图1D)。
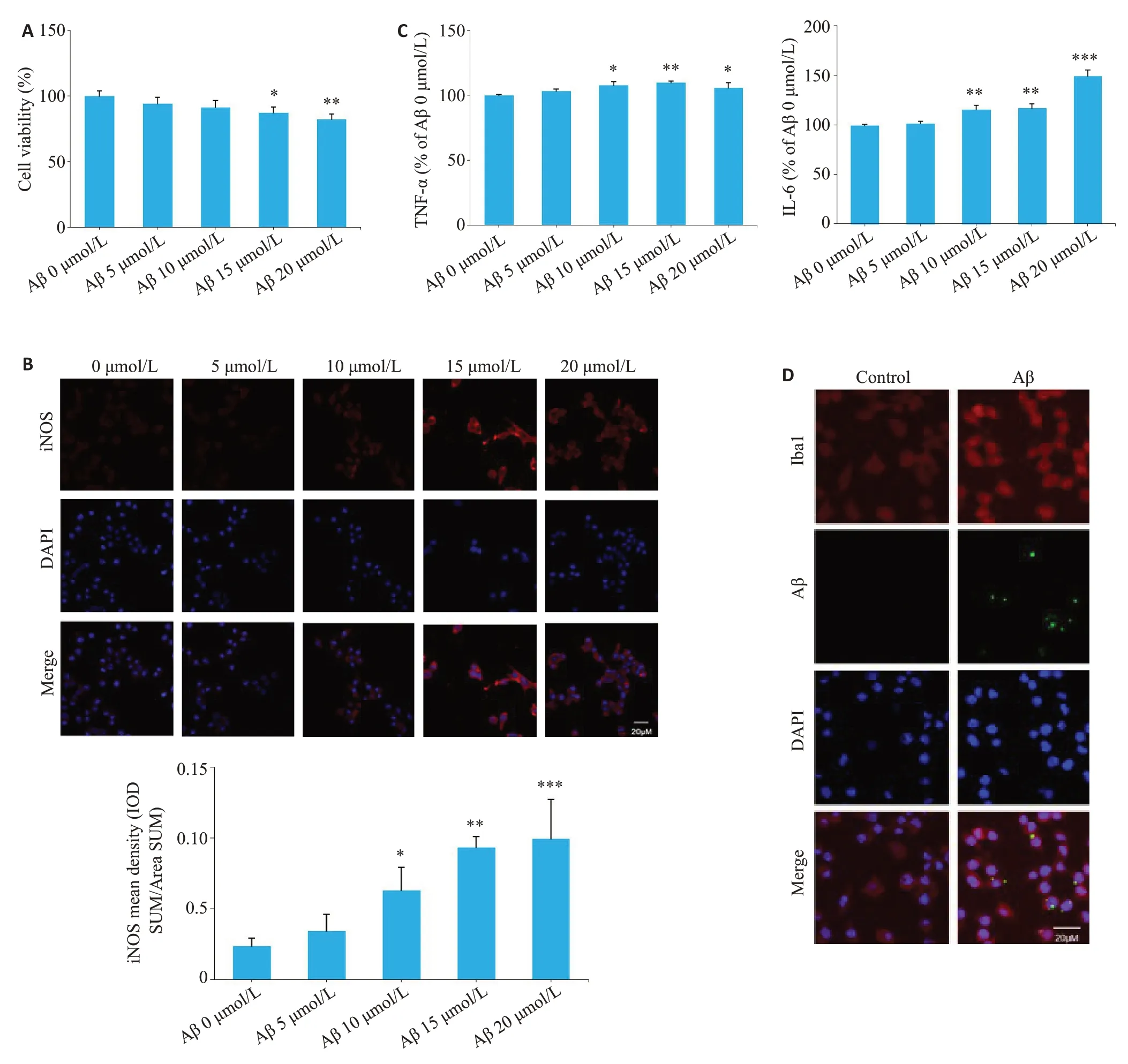
图1 Aβ1-42对BV2小胶质细胞活力和激活的影响Fig.1 Effects of Aβ1-42 on BV2 microglial viability and activation.A: Effect of Aβ1-42 (0,5,10,15 and 20 μmol/L) on BV2 cell viability assessed using CCK8 assay.B:Effect of Aβ1-42 on iNOS expression detected using laser confocal microscopy.C:Effect of Aβ1-42 on release of TNF-α and IL-6 detected using ELISA.D:Effect of 10 μmol/LAβ1-42 on intracellular Iba1 and Aβ expression detected using laser confocal microscopy.*P<0.05,**P<0.01,***P<0.001 vs 0 μmol/LAβ.
2.2 铅加重Aβ1-42处理的小胶质细胞的激活
使用10 μmol/LAβ1-42联合不同浓度铅(0、5、10、15、20 μmol/L)处理BV2 细胞,结果显示,15 μmol/L 及20 μmol/L铅联合Aβ1-42处理引起BV2细胞生长活力降低(P<0.05)(图2A),后续采用不影响细胞生长活力的10 μmol/L铅作为用药浓度进行观察。首先,使用相差显微镜观察各组细胞的形态学改变,结果显示Control组的BV2 细胞胞体大多呈圆形,无突起或突起较短;Aβ1-42组部分细胞突起增多,而Aβ1-42+Pb组胞体增大、突起增多且细长的情况更为明显(图2B);同时,使用激光共聚焦显微镜观察小胶质细胞特异性表达蛋白Iba1,也出现相同的形态学变化(图2C)。另外,与Aβ1-42组相比,Aβ1-42+Pb组的iNOS、TNF-α、IL-1β和IL-6增加,且差异具有统计学意义(P<0.05,图2D、E)。
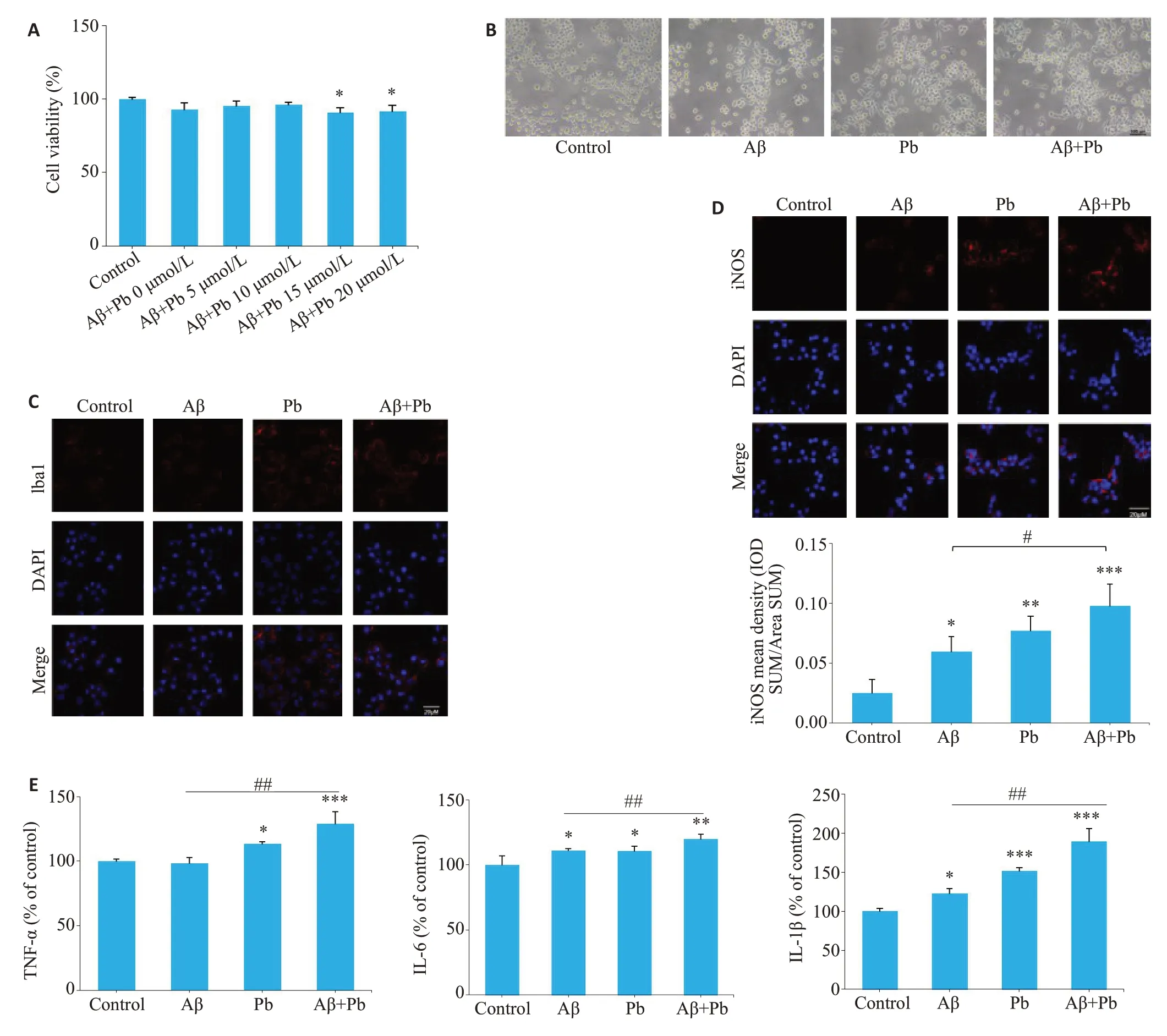
图2 铅联合Aβ1-42对BV2细胞活力和激活的影响Fig.2 Effects of lead acetate combined with Aβ1-42 on BV2 cell viability and activation.A:Effect of lead acetate(0,5,10,15 and 20 μmol/L)combined with Aβ1-42 on BV2 cell viability.B:Morphological changes of BV2 cells under phase contrast microscopy.C,D:Laser confocal microscopy for observing expressions of Iba1 and iNOS in BV2 cells.E:Release of TNF-α,IL-1β,and IL-6 in BV2 cells detected by ELISA.*P<0.05,**P<0.01,***P<0.001 vs Control group.#P<0.05,##P<0.01 vsAβ1-42 group.
2.3 铅加重Aβ1-42通过激活BV2细胞造成的HT22神经元细胞的损伤
单独使用浓度梯度Aβ1-42及铅处理海马神经元细胞HT22,CCK8检测其生长活力的变化,结果显示5,10,15,20 μmol/LAβ1-42以及5,10 μmol/L铅均对HT22细胞生长活力没有影响,15 μmol/L和20 μmol/L铅则可以引起HT22细胞生长活力下降(图3A)。而将Control组、Aβ1-42组、Pb组、Aβ1-42+Pb组的BV2细胞培养上清提取离心后,作为条件培养基,加入HT22细胞中孵育12 h,结果显示,经过处理的3组BV2细胞上清均能引起HT22的细胞生长活力降低,而与Aβ1-42组相比,Aβ1-42+Pb组的HT22细胞活力出现了下降(P<0.05,图3B)。
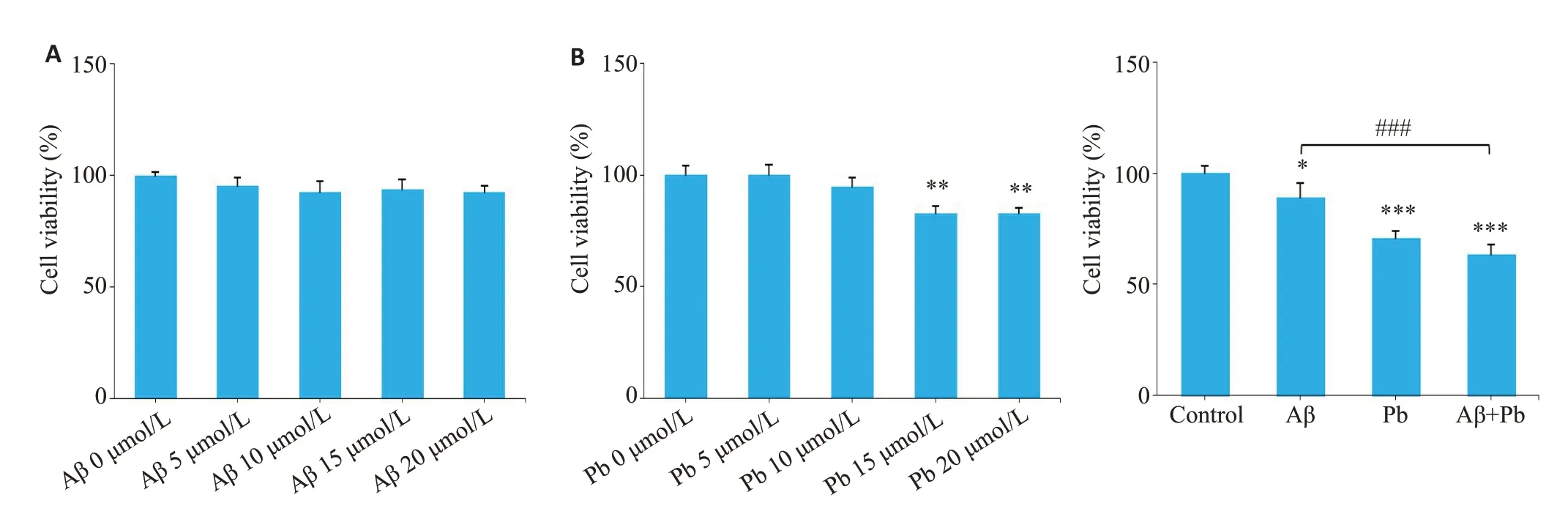
图3 铅联合Aβ1-42对海马神经元HT22细胞的影响Fig.3 Effects of conditioned medium from BV2 cells treated with lead acetate and Aβ1-42 on viability of hippocampal neuron HT22 cells.A:Assessment of HT22 cell viability treated with Aβ1-42 or lead acetate detected using CCK8 assay.B:Viability of HT22 cells treated with conditioned medium fromAβ1-42-and lead acetate-treated BV2 cells.*P<0.05,**P<0.01,***P<0.001.###P<0.001 vsAβ1-42 group.
2.4 铅加重Aβ1-42处理的小胶质细胞ROS升高
检测细胞氧化应激情况后显示,相比Aβ1-42组,Aβ1-42+Pb组ROS升高(P<0.001,图4A)。使用浓度梯度ROS抑制剂NAC预处理BV2细胞1 h,用完全培养基培养12 h后检测细胞生长活力,发现30 μmol/L NAC处理的细胞生长活力降低(图4B),选择不影响细胞生长活力的25 μmol/L,预处理1 h作为NAC的处理条件。加入药物处理12 h后检测小胶质细胞形态及Iba1表达量,相比Aβ1-42+Pb组,Aβ1-42+Pb+NAC组小胶质细胞胞体增大、突起增多等激活形态有所恢复(图4C、D)。另外,提取不同处理的小胶质细胞培养上清加入HT22细胞中,CCK8检测细胞生长活力,结果显示,相比Aβ1-42+Pb组,Aβ1-42+Pb+NAC组的HT22细胞生长活力有所恢复(P<0.05,图4E)。
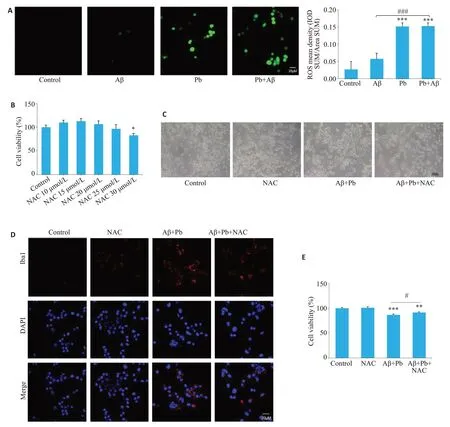
图4 铅联合Aβ1-42对BV2细胞氧化应激的影响Fig.4 Effect of lead acetate combined with Aβ1-42 on oxidative stress in BV2 cells.A:Detection of oxidative stress in BV2 cells using laser confocal microscopy.B:Effect of antioxidant NAC on BV2 cell viability detected using CCK8.C:Morphological changes of BV2 cells observed under phase contrast microscopy.D: Laser confocal microscopy for observing NAC-induced recovery of Iba1 expression in BV2 cells.E:Effect of conditioned medium from BV2 cells treated with Aβ1-42 combined with lead with or without NAC treatment on the viability of HT22 cells.*P<0.05,**P<0.01,***P<0.001 vs Control group.#P<0.05 vsAβ1-42+Pb group.
2.5 铅诱导Aβ1-42处理的小胶质细胞铜蓄积
与Aβ1-42组相比,Aβ1-42+Pb组的小胶质细胞内铜浓度升高,差异有统计学意义(P<0.001,图5A)。另外,相比Aβ1-42组,Aβ1-42+Pb组CTR1表达上升(P<0.05),ATP7A表达水平下降,但差异无统计学意义(P>0.05,图5B)。为了确认铅暴露是否通过诱导小胶质细胞内铜蓄积活化小胶质细胞,我们使用铜螯合剂四硫代钼酸铵(TM)处理小胶质细胞,结果显示,相比Aβ1-42+Pb组,Aβ1-42+Pb+TM组小胶质细胞激活形态有所恢复(图5C、D),iNOS表达量下降(P<0.01,图5E),且恢复了HT22细胞的生长活力(P<0.05,图5F)。

图5 铅联合Aβ1-42处理对BV2细胞铜离子稳态的影响Fig.5 Effect of lead acetate combined with Aβ1-42 on copper homeostasis in BV2 cells.A:Copper accumulation in BV2 cells detected using ICP-MS.B: Western blotting for detecting expression levels of CTR1 and ATP7A.C: Morphological changes of BV2 cells in different groups.D,E: Laser confocal microscopy for observing the recovery of Iba1 expression by the copper chelator TM in BV2 cells.F:Effect of conditioned medium from BV2 cells treated with Aβ1-42 combined with lead with or without TM treatment on HT22 cell viability detected using CCK8 assay.*P<0.05,**P<0.01,***P<0.001 vs Control group.#P<0.05,##P<0.01.
3 讨论
近年来关于AD的研究重点逐渐放在神经胶质细胞的促炎活性上,而反应性小胶质细胞上有大量受体可以感知Aβ并对其做出反应[35]。根据以往文献在小胶质细胞上的AD造模方法,我们首先使用浓度梯度Aβ1-42处理BV2小胶质细胞,以寻求构建AD细胞模型的药物浓度,12 h后发现15 μmol/L及以上浓度Aβ1-42可明显损伤BV2细胞,同时,我们发现10 μmol/L及以上浓度可引起小胶质细胞激活,且结果与Baik[29]相似,促炎细胞因子的释放有所增加,使用不影响细胞活力的10 μmol/L Aβ1-42处理小胶质细胞12 h,可观察到胞内Aβ蓄积增加,因此,不同于Heshmati-Fakhr[28](1 μmol/LAβ1-42,24 h)、Baik[29](2 μmol/LAβ1-42,24 h)的处理条件,我们确定AD细胞模型的建立条件为10 μmol/L Aβ1-42处理BV2 细胞12 h。
小胶质细胞可对外界刺激进行持续性的免疫监测,通过形态变化及细胞因子释放来调节中枢神经系统对感染性抗原的反应,促进神经变性[36,37]。我们接着探究铅对AD细胞模型的影响,为避免细胞自身损伤影响实验结果的判断,我们选用10 μmol/L Pb作为AD细胞模型的铅处理条件。相较于Control组及Aβ1-42组,铅的加入使得BV2细胞活化更为明显,这与Liu[38]的铅暴露诱导海马中小胶质细胞活化,IL-1β、TNF-α 增多,Chibowska[39]的研究中脑铅影响细胞因子的表达,对中枢神经系统产生促炎作用且小胶质细胞在其中起着重要作用等结论一致,说明铅的加入使AD细胞模型的激活情况更为明显,加重了炎症反应。
为了讨论铅对AD模型的激活是否对神经元造成损伤,我们使用浓度梯度的Aβ1-42及Pb单独处理海马神经元细胞HT22,发现10 μmol/LAβ1-42或10 μmol/L Pb均不引起海马神经元细胞生长活力下降,而相比于单独Aβ1-42处理组,Pb与Aβ1-42联合处理的BV2上清可显著损伤海马神经元细胞,Zhu等[40]研究发现重金属处理的小胶质细胞条件培养基会加重神经元损伤,这也在一定程度上验证了我们的猜想,即铅可以通过诱发AD细胞模型的活化,释放促炎细胞因子从而加重对神经元的损伤。
有研究表明,药物菊苣酸可通过降低铅诱导的活性氧和TNF-α水平来恢复BV2细胞的细胞周期,从而减少斑马鱼幼虫的严重死亡和畸形发生率[41];小胶质细胞ROS可能导致与神经变性相关的氧化应激,而大脑特别容易受到氧化应激的影响[42],累积的氧化应激可能是导致认知衰老和神经退行性疾病(如AD)的关键机制之一[43],我们发现Pb暴露加重了Aβ1-42处理的BV2细胞氧化应激,而在使用抗氧化剂后小胶质细胞的激活情况以及铅对神经元细胞造成的损伤得到了缓解。此外,已有研究表明,铅暴露可引起BCB中金属离子稳态失衡,诱导大鼠脑中铜蓄积[18]。Pb暴露可引起Aβ1-42处理的BV2细胞铜蓄积增加,铜转运相关蛋白CTR1表达量上升,而在使用铜螯合剂预处理后,处于活化形态的细胞明显减少,神经元细胞损伤减轻。
综上所述,铅暴露可通过引发小胶质细胞活化,炎性因子IL-1β和IL-6释放增加,造成神经元损伤,促进阿尔兹海默症样变。这个过程可能与改变铜转运蛋白CTR1表达量引起小胶质细胞铜蓄积以及加重细胞氧化应激有关,需在后续实验中通过转染或慢病毒从基因层面上对CTR1进行控制或敲低加以验证;且本研究仅在细胞层面上探讨了铅通过小胶质细胞活化影响阿尔兹海默症样变的可能机制,虽为重金属影响阿尔兹海默症样变的临床治疗提供了思路,但仍需通过动物实验和原代小胶质细胞实验作进一步验证。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病