槲皮素诱导肝星状细胞凋亡:基于调控miR-146 影响PI3K/Akt信号通路
高晓阳,赵晓璐,张春艳,颜羽昕,金 蓉,马月宏
内蒙古医科大学基础医学院,内蒙古自治区 呼和浩特010000
肝纤维化(HF)导致纤维细胞外基质(ECM)成分在肝脏中过度地和/或可逆地积累,是造成肝组织反复损伤的主要决定因素[1]。其中,肝星状细胞(HSCs)的活化是分泌ECM的主要细胞来源,是HF发生发展的“核心事件”[2,3]。当肝脏受伤时,静止的HSCs被激活,转分化为肌成纤维细胞,分泌大量ECM成分,导致异常的伤口愈合反应[4]。在此过程中,还发现了一系列可能在纤维疤痕形成/调节中发挥关键作用的机制。譬如:微小RNA(miRNA)通过转录后改变基因表达来调控多种疾病的发展[5];细胞间的相互作用常常是在细胞信号传导的过程中进行,它们或者识别与之相接触的细胞,或者识别周围环境中的相关信号,改变靶基因的转录活性,诱发细胞作出特定的应答反应[6]等。研究发现,miR-146/Smad4是抑制肝细胞上皮-间质转化(EMT)的关键信号级联,miR-146的引入可能为HF提供一种有前途的治疗选择[7]。在HSCs激活的早期阶段,磷脂酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶B(Akt)信号通路受到某些生长因子(TGF-β、CTGF、PDGF等)的刺激,参与多种生理过程,如细胞增殖、分化、自噬和凋亡,但据报道其激活与纤维发生也有关[8,9]。
槲皮素(Que)是一种广泛存在于自然界植物中的黄酮醇类化合物,具有抗菌抗炎、抗氧化、抗癌、抗纤维化及抑制血管活性生成等多种生物活性[10]。研究发现,Que可以降低胆管结扎(BDL)或四氯化碳(CCl4)造成的HF,减少ECM形成,抑制转化生长因子-β(TGF-β)/Smads和磷脂酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶B(Akt)信号通路,从而减轻肝脏损伤[11]。然而,Que是否能通过调控miR-146参与HF以及其可能的分子机制尚未见报道。因此,本研究选择了miR-146和PI3K/Akt信号通路,从细胞研究的层面探讨了Que在HF防治中的作用和机制。
1 材料和方法
1.1 材料
1.1.1 实验细胞系 大鼠肝星状细胞系(HSC-T6)购自北京北纳科技有限公司。
1.1.2 药品和主要试剂 槲皮素(产品规格:分析标准品,HPLC≥98%)购自上海源叶生物科技有限公司;miRNA模拟剂(mimic)/抑制剂(inhibitor)、riboFECTTMCP Transfection Kit(广州锐博生物技术有限公司);CCK-8细胞增殖-毒性检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术有限公司);FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂(北京天根生化科技有限公司);RabbitAntiα-SMA、Rabbit Anti-Collagen I、Rabbit Anti-PI3K、RabbitAnti-Akt、RabbitAnti-p-Akt、RabbitAnti-TRAF6(北京博奥森生物技术有限公司);Triton X-100、牛血清白蛋白(BSA-Ⅴ)购自中科瑞泰生物科技有限公司;DAPI染色液(南京森贝伽生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 HSC-T6细胞采用含有10%胎牛血清的DMEM高糖培养液常规培养。待细胞贴壁并长至培养皿的30%~50%时,除对照组以外,各组均加入0.2 mg/mL TGF-β孵育24 h[12],弃上清,用40、60、80 μmol/L Que预处理24 h,用于后续分子实验。
1.2.2 细胞转染 细胞转染采用riboFECTTMCP 试剂。取对数生长期的5×105~1×106/孔细胞接种至24孔板中,培养液体积0.5 mL,其中miRNA mimic终浓度每孔为50 nmol/L,miRNA inhibitor终浓度每孔为100 nmol/L,共孵育48 h后进行后续试验。为保证实验可靠性和重复性,每组转染样品设6个重复。
1.2.3 CCK-8法检测Que对HSCs的影响 Que浓度设置为调零组(不含细胞的完全培养液)、对照组(不加Que干预)、10、20、40、60、80、100 μmol/L共8组,每组设5个复孔。取稀释为5×103/mL的HSC-T6细胞悬液,以200 μL/孔接种于96孔板,待贴壁后分别按上述浓度加入Que,37 ℃、5%CO2培养箱中培养24、48、72 h,适时加入10 μL CCK-8溶液,2 h后于酶标仪处检测各孔A450nm。细胞抑制率(%)=[(对照组A450nm-处理组A450nm)/(对照组A450nm-调零组A450nm)]×100%。
1.2.4 流式细胞术检测细胞凋亡 调整细胞密度为5×104~1×105/孔(6孔板),收集细胞悬液至离心管内,1000 r/min离心5 min,弃上清,加入195 μLAnnexin V-FITC结合液完成细胞重悬,再加入5 μL Annexin V-FITC和10 μL碘化丙啶(PI)染色液混匀,移至流式管内,室温避光孵育20 min,上流式细胞仪检测。
1.2.5 RT-qPCR检测细胞中mRNA、miRNA表达水平总RNA用Trizol法提取,miRNA用索莱宝公司柱提法按提取试剂盒说明书提取。得到样品后选取相应的反转录试剂获得cDNA,并加入相应的引物和荧光染料进行RT-qPCR技术检测。miR-146、U6、α-SMA、CollagenI、TRAF6、PI3K、Akt、GAPDH 引物均由上海生工设计。以上所有体系分析均设3个重复,结果采用2-ΔΔCt方法进行数据处理。
1.2.6 Western blot检测细胞中相关蛋白表达水平 提取各组细胞的蛋白,以10~20 μL 上样量进行SDSPAGE凝胶电泳,待目的蛋白分离后转膜,封闭1 h,用含5%脱脂奶粉的TBS溶液稀释一抗:GAPDH(1∶20 000)、α-SMA(1∶2000)、CollagenⅠ(1∶1000)、TRAF6(1∶1000)、PI3K(1∶1000)、Akt(1∶1000)、p-Akt(1∶500),4 ℃过夜。次日1×TBST 溶液充分洗涤后放入对应的荧光二抗(1∶1000),室温摇床1 h。近红外激光成像系统扫膜并进行灰度值分析。以上实验步骤独立进行3次。
1.2.7 免疫荧光实验检测细胞中α-SMA、Collagen I蛋白表达水平 将无菌玻片放入12 孔板中,1×多聚赖氨酸孵育4 h 后常规处理细胞。随后用4%多聚甲醛固定30 min,0.5%Triton X-100透化20 min,1%BSA封闭1 h,一抗湿盒4 ℃过夜。次日滴加稀释好的荧光二抗,37 ℃避光培养1 h,倒置荧光显微镜下观察采集图片。
1.3 统计学分析
使用SPSS 22.0软件对数据进行统计分析。数据以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05时认为差异具有统计学意义。
2 结果
2.1 Que对HSC-T6细胞活力的影响
不同浓度的Que孵育HSC-T6细胞24、48、72 h后结果显示,相同时间不同浓度内,与对照组相比,除10 μmol/L和20 μmol/L给药浓度外,余随着药物浓度的递增,细胞A450nm值均显著降低(P<0.05)。相同浓度不同时间比较,发现药物浓度在40、60、80 μmol/L 时细胞A450nm值间的差异变化最为显著,所以选取40、60、80 μmol/L 3个浓度进行后续细胞实验(图1)。
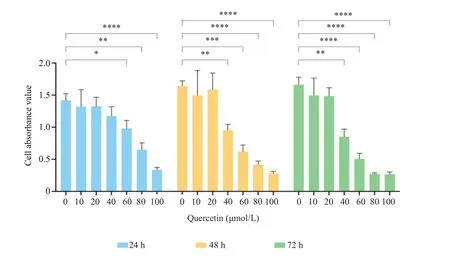
图1 不同浓度Que对HSC-T6细胞抑制率的影响Fig.1 Inhibition rates of HSC-T6 cells treated with different concentrations of quercetin(Mean±SD,n=3).*P<0.05,**P<0.01,***P<0.001,****P<0.0001.
2.2 Que对HSC-T6细胞凋亡的影响
结果显示,与Control组相比,TGF-β组的总细胞凋亡率差异无统计学意义(P>0.05),与TGF-β组相比,Que各给药组总细胞凋亡率均显著升高(P<0.001),其中Que低剂量组和Que高剂量组以早期凋亡率升高为主(图2A~E)。

图2 Que对HSC-T6细胞凋亡的影响Fig.2 Effect of quercetin on apoptosis of HSC-T6 cells(Mean±SD,n=3).A:Control group;B:TGF-β group;C:TGF-β+Que-L group;D:TGF-β+Que-M group;E:TGF-β+Que-H group;F:Apoatosis rate.***P<0.001 vs TGF-β group.
2.3 Que通过PI3K/Akt信号通路抑制HSCs增殖的作用机制
2.3.1 RT-qPCR结果 与Control组相比,TGF-β组中α-SMA、CollagenⅠ、TRAF6、PI3K、Akt的mRNA表达水平显著升高(P<0.001);与TGF-β组相比,Que各治疗组的α-SMA、CollagenⅠ、TRAF6、PI3K、Akt的mRNA表达水平显著下调(P<0.01,图3A~E)。
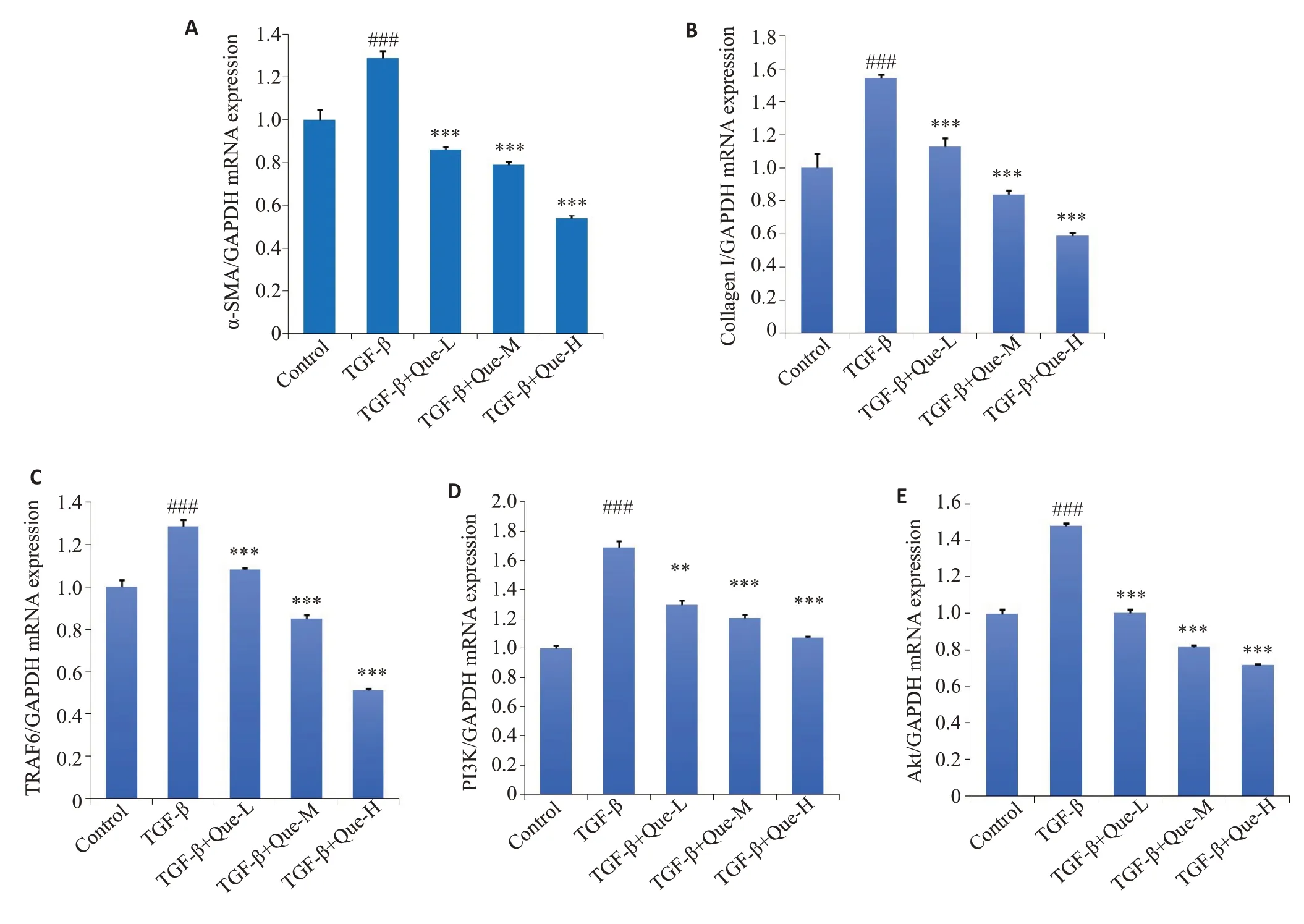
图3 不同剂量Que对细胞中α-SMA、CollagenⅠ、TRAF6、PI3K和Akt mRNA表达的影响Fig.3 Effects of different doses of quercetin on the expression of α-SMA(A),CollagenⅠ(B),TRAF6 (C),PI3K (D) and Akt (E)mRNAin the cells(Mean±SD,n=3).###P<0.001 vs Control group;**P<0.01,***P<0.001 vs TGF-β group.
2.3.2 Western blot结果 与Control组相比,TGF-β组中α-SMA、TRAF6、PI3K、Akt、p-Akt蛋白表达水平显著升高(P<0.01),而CollagenⅠ蛋白表达水平无明显升高(P>0.05);与TGF-β组相比,除CollagenⅠ和PI3K低剂量组以外,余Que各治疗组的α-SMA、CollagenⅠ、TRAF6、PI3K、Akt、p-Akt 蛋白表达水平显著下调(P<0.05,图4A~G)。
2.3.3 免疫荧光实验结果 与Control 组相比,加入TGF-β的模型组中α-SMA、CollagenⅠ蛋白的荧光强度显著增强,表明TGF-β能促进HSC-T6 细胞活化;与TGF-β组相比,加入Que的实验组中α-SMA、CollagenⅠ蛋白的荧光强度显著减弱,表明Que可以抑制TGF-β对HSC-T6 细胞的活化作用,这与RT-qPCR 和Western blot结果一致(图5A、B)。
2.4 Que对HSCs中miR-146表达水平的影响
测定HSC-T6细胞中miR-146的变化情况,结果显示,与Control组相比,TGF-β组中有miR-146 mRNA表达下降(P<0.05),与TGF-β组相比,给予不同剂量Que后各组中miR-146 mRNA表达显著上调(P<0.05,图6)。
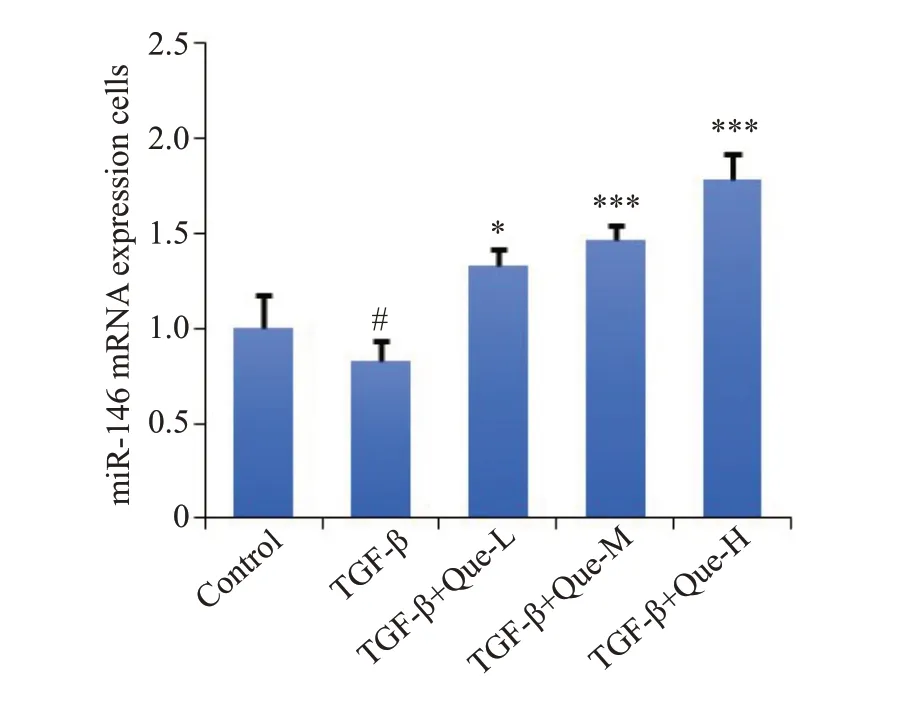
图6 各组细胞中miR-146表达水平Fig.6 Expression levels of miR-146 in quercetintreated cells(Mean±SD,n=6).#P<0.05 vs Control group;*P<0.05,***P<0.001 vs TGF-β group.
2.5 miR-146通过靶向TRAF6对HSCs的调控作用
2.5.1 HSC-T6细胞转染后α-SMA、CollagenⅠ、TRAF6、PI3K、Akt的mRNA表达水平 与各自的NC组相比,细胞转染mimic后α-SMA、CollagenⅠ、TRAF6、PI3K、Akt的mRNA表达水平显著降低(P<0.01),而转染inhibitor后α-SMA、CollagenⅠ、TRAF6、PI3K、Akt的mRNA表达水平显著升高(P<0.01,图7A~E)。

图7 HSCs转染后对α-SMA、CollagenⅠ、TRAF6、PI3K和Akt mRNA表达的影响Fig.7 Expressions of α-SMA(A),collagenⅠ(B),TRAF6(C),PI3K(D)and Akt(E)mRNAs in HSCs transfected with miR146 mimic and inhibitor(Mean±SD,n=6).**P<0.01,***P<0.001 vs Individual NC groups.
2.5.2 HSC-T6细胞转染后α-SMA、CollagenⅠ、TRAF6、PI3K、Akt和p-Akt蛋白表达水平 与miR-146 mimics NC 组相比,转染mimics 后α-SMA、Collagen Ⅰ、TRAF6、PI3K、Akt、p-Akt蛋白表达水平显著降低(P<0.05),与miR-146 inhibitor NC组相比,转染inhibitor后α-SMA、CollagenⅠ、TRAF6、PI3K、Akt、p-Akt 蛋白表达水平显著升高(P<0.05,图8A~G)。
3 讨论
肝脏纤维化和慢性炎症反应主要与慢性肝病的进展有关[13]。慢性肝损伤会导致肝纤维生成的持续性激活,这是一个关键的生物动态过程,涉及许多分子机制、传导通路以及不同细胞群的相互反应,最终使HF发生发展[14]。在健康肝脏中,ECM多由IV型和VI型胶原蛋白形成,当肝脏受损时,ECM主要分泌I型和III型纤维胶原蛋白,同时增加层粘连蛋白、透明质酸、弹性蛋白和蛋白聚糖等非胶原蛋白的沉积[4,15]。因此,抑制HSCs的活化、减少胶原蛋白沉积是改善HF的主要措施。目前研究面临的主要挑战是如何为慢性肝病患者的抗HF治疗提供新方向。Que能显著减慢肝癌异种移植的生长,抑制依赖有氧糖酵解的肝细胞癌的进展,特别是对于那些己糖激酶2表达率高的患者[16]。Wan 等[17]研究了脂质体Que对刀豆球蛋白A诱导的HF的影响,表明Que可以有效抑制刀豆球蛋白A引起的HF,且抑制作用与其调节NF-κB的能力有关。尽管以上描述了Que在肝脏疾病中的一些应用成果,但其对HF治疗的相关机制仍有待进一步完善。
TGF-β是一组新近发现的调节细胞生长和分化的TGF-β超家族,存在于正常肝组织中,但其高表达时却发生在进行性肝病的所有阶段,包括纤维化[18]。TGF-β和ECM成分之间存在很强的串扰关系。一般情况下,一部分TGF-β以TGF-β结合蛋白(LTBP)或复合物的形式存储在ECM中,当TGF-β被激活,它会调节ECM重塑,促进成纤维细胞向肌成纤维细胞过渡,并作用于纤维化中的其他细胞(上皮细胞、内皮细胞或巨噬细胞等),这在纤维化过程中至关重要[19]。鉴于此,本实验选择TGF-β为细胞激活诱导剂,并进一步证实TGF-β有助于HSCs的激活和ECM的过度积累,后通过RT-qPCR、Western blot和免疫荧光定量检测α-SMA、CollagenⅠ的mRNA和蛋白水平显示,与对照组相比,模型组呈高表达,与模型组相比,Que药物干预后α-SMA、CollagenⅠ表达降低,从而证明Que对TGF-β激活的HSCs途径有效,能抑制细胞增殖并促进其凋亡,降低纤维化标志物α-SMA、Collagen I表达水平,起到抗HF的作用。
PI3K/Akt通路是一条较常见的信号通路,它在HF过程中发挥着重要作用,不仅调控HSCs的活化、增殖及凋亡等,而且与ECM的合成与降解有关[20,21]。研究发现TGF-β可促进PI3K/Akt通路活化,增强瘢痕成纤维细胞中α-SMA的表达;当阻断PI3K/Akt通路的传导时,能促进HSCs的凋亡,减少I型胶原的生成[22]。PDGF呈时间依赖性的激活HSCs 中的PI3K,且磷酸化Akt,通过PI3K/Akt通路促进HSCs增殖和I型胶原合成,用PI3K抑制剂LY294002作用于HSCs,可阻断PDGF对PI3K的诱导活化,减少HSCs增殖,达到抗纤维化的效果[23]。以上研究机制均说明抑制PI3K/Akt通路活化能延缓或逆转纤维化的进展。本研究中进一步证明PI3K/Akt信号通路的激活与HF有关,下调PI3K、Akt和p-Akt等基因可抑制胶原表达,阻断HSCs/HmFs的增殖、分化,延缓纤维化的进展。
miRNA的失调能启动PI3K/Akt信号通路的激活,miRNA介导的基因调控与PI3K/Akt通路相互连接,形成Akt-miRNA调控网络[24]。一般来说,miRNA在少数情况下可以通过直接靶向Akt来调控PI3K/Akt信号传导,但大多数miRNA靶向此途径中的负调控因子,例如肿瘤因子受体相关因子6(TRAF6)就是miR-146的下游靶标之一,它能通过Lys63介导的泛素化促进PI3K/Akt信号通路活化[25,26]。与此同时,荧光素酶报告证明miR-146 直接靶向TRAF6,下调TRAF6 后可以减少miR-146对肝细胞癌细胞系增殖和入侵的影响[27]。本研究中模型组的miR-146表达明显,给予不同剂量药物,各组中miR-146表达显著降低,TRAF6与miR-146间呈显著负向调控关系。故又设计了miR-146细胞转染实验,得出转染miR-146 inhibitor 会上调PI3K/Akt信号通路;而转染miR-146 mimic时PI3K/Akt信号通路受到抑制或失活。
综上所述,活化的HSCs减少有助于大多数患者的纤维化的消退和肝脏的修复,本实验通过细胞模型实验进一步证实了Que的抗HF 作用,其作用机制是通过上调miR-146,进而调控PI3K/Akt信号通路来实现的,这为Que在HF中的应用提供了新参考资料。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病