莪术醇逆转胶质瘤细胞对替莫唑胺的耐药:基于调节UTX/MGMT轴
孙江川,邢家恒,谭茹雪,钱 颖,田 男
浙江中医药大学生命科学学院,浙江 杭州310053
胶质瘤是成人颅内最常见的恶性肿瘤,侵袭性强、术后复发率高,患者5年总体存活率仅为30%[1]。替莫唑胺(TMZ)是胶质瘤治疗的一线化疗药物,但细胞耐药减弱了其治疗效果。因此,探究TMZ耐药机制对于胶质瘤治疗具有重要的临床意义。
TMZ是一种抗肿瘤烷化剂,诱导DNA复制错配,而促进细胞死亡[2]。六氧甲基鸟嘌呤DNA甲基转移酶(O-6-Methylguanine DNAMethyltransferase,MGMT),能通过转移烷化基因修复TMZ造成的DNA损伤,导致胶质瘤细胞对TMZ的耐药[3]。MGMT基因表达的高低,是胶质瘤独立的预后预测指标[4]。本实验室研究发现莪术醇处理能够抑制胶质瘤细胞中MGMT的表达并增加细胞对TMZ的敏感性[5],然而相关机制有待深入研究。
Daures 等[6]发现MGMT 启动子区H3K27me3 修饰水平与肿瘤进展密切相关。组蛋白H3K27去甲基化酶UTX(ubiquitously transcribed TPR gene on the X chromosome,又名KDM6A),作为一种重要的表观遗传修饰因子,能在多种肿瘤中发挥关键作用;如在人类胰腺癌中,UTX的耗尽或突变导致TP63表达升高,驱动胰腺癌的发生发展[7],UTX也被发现是介导人类乳腺癌内上皮间充质转化(EMT)的中心因素[8]。与此同时,UTX 能在许多细胞中通过降低靶基因启动子区H3K27me3水平激活靶基因的表达来参与肿瘤的发生发展[9-11]。然而UTX/MGMT轴在胶质瘤细胞耐药中的作用,目前尚无报道。
本研究拟通过探索莪术醇以及UTX对胶质瘤化疗原发性耐药的影响及二者关系,探讨相关机制,为胶质瘤治疗提供一定的实验基础。
1 材料和方法
1.1 材料
裸鼠BALB/c购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005,饲养在浙江中医药大学动物实验研究中心。动物实验由浙江中医药大学实验动物中心伦理委员会批准(批准编号20210726-08)。人胶质瘤细胞株(A172、U251)购于中国科学院上海生命科学研究所细胞资源中心。达尔伯克氏必需基本培养基(DMEM)含10%的新生牛血清、100 μg/mL 的青霉素和100 μg/mL 的链霉素。LipofectamineTM2000 转染试剂盒和TRIzol 试剂(Invitrogen),pLVX-EnCMV-UTX 质粒(淼灵生物),Epigenase™JMJD3/UTX去甲基化酶活性/抑制检测试剂盒(比色法)(Epigentek),二抗:山羊抗兔、山羊抗小鼠(Huabio),一抗:UTX、MGMT(Abcam)、H3K27me3(Active Motif),MGMT引物(生工生物合成),增强型RIPA裂解液(博士德生物),Super ECL Plus超敏化学发光检测试剂盒(普利莱),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(凯基生物),蛋白G 磁珠(Active Motif),反转录和实时荧光定量聚合酶链反应(RTqPCR)试剂盒(TaKaRa),噻唑蓝(MTT)粉末(索莱宝),二甲基亚砜(DMSO)(默克)。Forma直热式CO2培养箱(赛默飞世尔科技),RT-6000酶标分析仪(深圳雷杜生命科学股份有限公司),Guava EasyCyte 8 流式细胞仪(Millipore)。
1.2 方法
1.2.1 细胞培养与转染 细胞筛选完成后设立空白对照组、莪术醇处理组(40 μg/mL)、UTX过表达组(UTX过表达细胞)、UTX过表达和莪术醇联合处理组(40 μg/mL莪术醇处理UTX过表达细胞),检测各组细胞的生存率、凋亡率以及基因的表达。细胞培养选用含10%FBS、100 μg/mL青霉素和100 μg/mL链霉素的DMEM培养基,所有细胞均置于5%CO2、37 ℃培养箱中培养。
1.2.2 药物相互作用分析 取对数生长期的胶质瘤细胞,调整细胞密度为5×103/mL接种至96孔板中,培养6 h后,计算得到细胞系TMZ和莪术醇的IC50值,TMZ和莪术醇的浓度设置均取其IC50的0、1/8、1/4、1/2、1。固定TMZ浓度后分别与不同浓度的莪术醇组合处理细胞,每组分别进行3次实验并取平均值,确定量效曲线。采用相互作用指数(CI)来判断两药联用效果,CI=莪术醇在混合药物中的IC50/莪术醇单独IC50+TMZ在混合药物中的IC50/TMZ 单独IC50。若CI>1 则说明两药拮抗,若CI=1 说明两药相加,若CI<1 则说明两药有协同作用。
1.2.3 MTT及克隆形成MTT实验 以5×103/孔接种到96孔板后将细胞置于培养箱中培养。48 h后取出培养板,每孔加入10 μL MTT溶液(质量浓度为5 mg/mL)。37 ℃避光培养4 h后弃去上清,每孔加入150 μL二甲基亚砜(DMSO),震荡使紫色结晶溶解,用酶标仪检测吸光度A450nm。克隆形成实验:以500/孔接种于6孔板中,14 d后终止培养,经4%多聚甲醛固定30 min,并用0.1%结晶紫染色30 min,洗去多余的染液后置于显微镜下观察拍照。
1.2.4 流式细胞术检测细胞凋亡 使用不含EDTA的胰蛋白酶消化细胞,取细胞悬液于4 ℃、1000 r/min条件下离心5 min,用PBS洗涤,弃去上清液,加500 μL结合液至每管中,冰上避光,再加入5 μLAnnexin V-FITC和5 μL Propidium Iodid液于细胞悬液中混匀,过200目筛网后用Guava EasyCyte 8流式细胞仪计算细胞凋亡率。
1.2.5 UTX活性检测 将细胞接种到10 cm培养皿中,各组加药处理后培养待细胞融合度达到80%~90%收集细胞,提取核蛋白后测浓度。然后按照试剂盒说明书进行操作,最后酶标仪分别测量450 nm和655 nm波长处的A值,根据说明书公式计算UTX活性。
1.2.6 免疫印迹法检测 在各组细胞中加入裂解液提取细胞总蛋白,通过质量分数为10%的SDS-PAGE凝胶对所提取出的蛋白质进行分离,并将其转移至PVDF膜上。用1%的牛血清蛋白在室温环境下封闭2 h,吸出封闭液后再加入一抗4 ℃孵育过夜。次日,将其取出,用TBST清洗3次后加入二抗,于室温摇床上孵育2 h,然后用TBST清洗3次。最后,经ECL发光检测试剂盒处理后,用显影仪检测信号。
1.2.7 染色质免疫沉淀定量聚合酶链式反应分析(ChIPqPCR)用甲醛固定后收集胶质瘤细胞,酶切染色质。随后,使用2 μg 的IgG、UTX 或H3K27me3 抗体在蛋白G磁珠上分离染色质免疫沉淀物。洗涤后,将芯片洗脱,反向交联。然后,对样品进行qRT-PCR分析。MGMT 启动子引物序列:正向引物5'GCAGC CTGTATTGTCACCAG 3' 反向引物5'CGGTGAAG TTTCCCTGTTGG 3'。
1.2.8 裸鼠异体移植实验 BALB/c 裸鼠皮下注射接种U251细胞(3×107/只)。7 d后,将裸鼠随机分组,分别为空白对照组、莪术醇(Cur)组、TMZ组、莪术醇+TMZ组,每组4 只,其中药物剂量:莪术醇20 mg/kg,TMZ 20 mg/kg。持续给药治疗15 d,1次/3 d,共5次。15 d后处死裸鼠取瘤体称质量并用于后续实验。
1.2.9 免疫组化 免疫组织化学标本经过甲醛固定和石蜡包埋后,连续切成厚度为4 μm的切片,先进行HE染色,进行免疫组化染色。石蜡切片经过烤片、二甲苯脱蜡、浓度梯度乙醇水化后,3%双氧水去离子水孵育10 min,再用0.01 mol/L枸橼酸钠修复20 min,滴加稀释的一抗,在4 ℃冰箱放置过夜孵育。过夜后第2天用PBS冲洗3次后,依次滴加免疫组化试剂盒中的试剂1(聚合物辅助物)和试剂2(多过氧化物酶抗鼠/兔IgG),在37 ℃下分别孵育20 min和30 min。常规显色封片后镜检,重复实验以保证结果的特异性。
1.2.10 统计学分析 采用GraphPad Prism 9.0统计软件进行统计学分析,计量资料采用均数±标准差表示。多组均数比较使用单因素方差分析,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 莪术醇增强胶质瘤细胞对TMZ的敏感性
等效线图解分析法结果显示莪术醇与TMZ联用对胶质瘤细胞生存率的抑制具有协同效应(图1A)。之后,我们使用不同浓度莪术醇(0,10,20,40 μg/mL)与TMZ 10 μg/mL联合处理细胞48 h后,检测各组胶质瘤细胞生存率、凋亡率以及克隆形成率。MTT结果(图1B)显示,莪术醇显著增加了TMZ抑制的胶质瘤细胞的生存率,且呈剂量依赖性,在莪术醇浓度为40 μg/mL时抑制率最高,A172 和U251 细胞的抑制率分别达到了36.96%(P<0.01)及33.76%(P<0.01);流式细胞术检测结果表明(图1C),与TMZ单处理组相比,TMZ与莪术醇联合处理组的细胞凋亡率在48 h和72 h均显著增加(P<0.01),且呈剂量、时间依赖性,40 μg/mL莪术醇作用72 h后,A172和U251细胞的凋亡率分别升高了10.32倍(P<0.01)及8.81 倍(P<0.01)。细胞克隆形成结果(图1D)显示,莪术醇增加了TMZ抑制的细胞克隆形成率。在胶质瘤细胞A172和U251中,40 μg/mL的莪术醇可以使细胞细胞克隆形成率分别减少87.38%(P<0.01)及67.31%(P<0.01)。
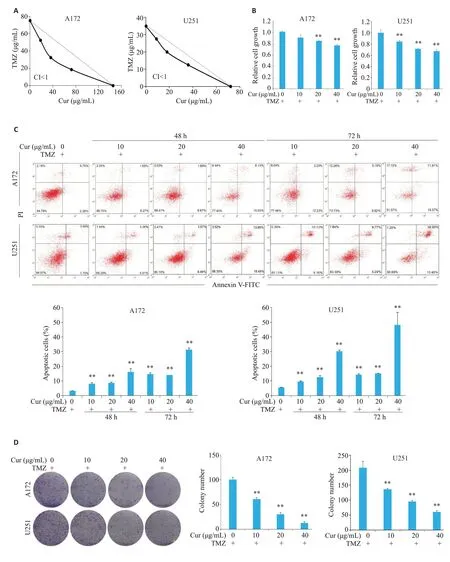
图1 莪术醇能抑制胶质瘤细胞的存活和克隆形成以及促进其凋亡Fig.1 Curcumol (Cur) suppresses survival and clonal formation and promotes apoptosis of the glioma cells.A: Isobologram analysis of the effects of curcumol combined with TMZ on cell proliferation of glioma cells.B: Effect of combined treatment with curcumol and TMZ on glioma cell viability detected by MTT assay.C:Effect of combined treatment with curcumol and TMZ on glioma cell apoptosis detected by flow cytometry.D: Effect of combined treatment with curcumol and TMZ on clonogenic ability of the glioma cells detected by cell clone formation experiment.**P<0.01 vs 0 μg/mLGur+TMZ.
2.2 莪术醇抑制胶质瘤裸鼠移植瘤的生长
空白对照组和TMZ组的移植瘤体积较大,联合药物组移植瘤则最小(图2)。取出瘤块称取质量,莪术醇组瘤体质量相较于空白对照组减轻42.24%(P<0.01),TMZ组并无显著性变化,联合处理组的移植瘤质量则最小,较空白对照组减轻了52.67%(P<0.01)。

图2 莪术醇在体内对肿瘤瘤体生长的抑制的作用Fig.2 Inhibitory effect of curcumol on tumor growth in nude mice.*P<0.05,**P<0.01.
2.3 莪术醇抑制胶质瘤细胞中UTX的活性
UTX活性检测结果(图3A)显示,随莪术醇浓度增加,A172和U251细胞中的UTX酶活性显著下降,当莪术醇浓度为40 μg/mL时下降最多,A172和U251细胞的UTX 活性分别下降了47.28%(P<0.01)及48.17%(P<0.01)。Western blot结果(图3B)显示,经莪术醇处理后,细胞内的UTX蛋白表达水平无显著差异(P>0.05),但H3K27me3蛋白水平显著增加(P<0.05)。

图3 莪术醇处理下胶质瘤细胞中UTX活性和蛋白表达水平Fig.3 UTX activity and protein expression level in glioma cells treated with curcumol.A:UTX gene activity in the glioma cells treated with different concentrations of curcumol.B:Expression levels of UTX and H3K27me3 in glioma cells treated with curcumol.*P<0.05,**P<0.01 vs 0 μg/mLCur.
2.4 UTX逆转莪术醇对胶质瘤细胞的化疗增敏作用
UTX活性试剂盒检测过表达细胞系中UTX酶活,结果(图4A)显示,在胶质瘤A172和U251细胞中,过表达细胞组UTX的活性较正常组细胞分别升高了1.47倍(P<0.05)及1.49倍(P<0.05)。Western blot结果(图4B)显示,相较空白对照组,过表达细胞的UTX蛋白表达上升(P<0.01),H3K27me3蛋白表达下降(P<0.01)。
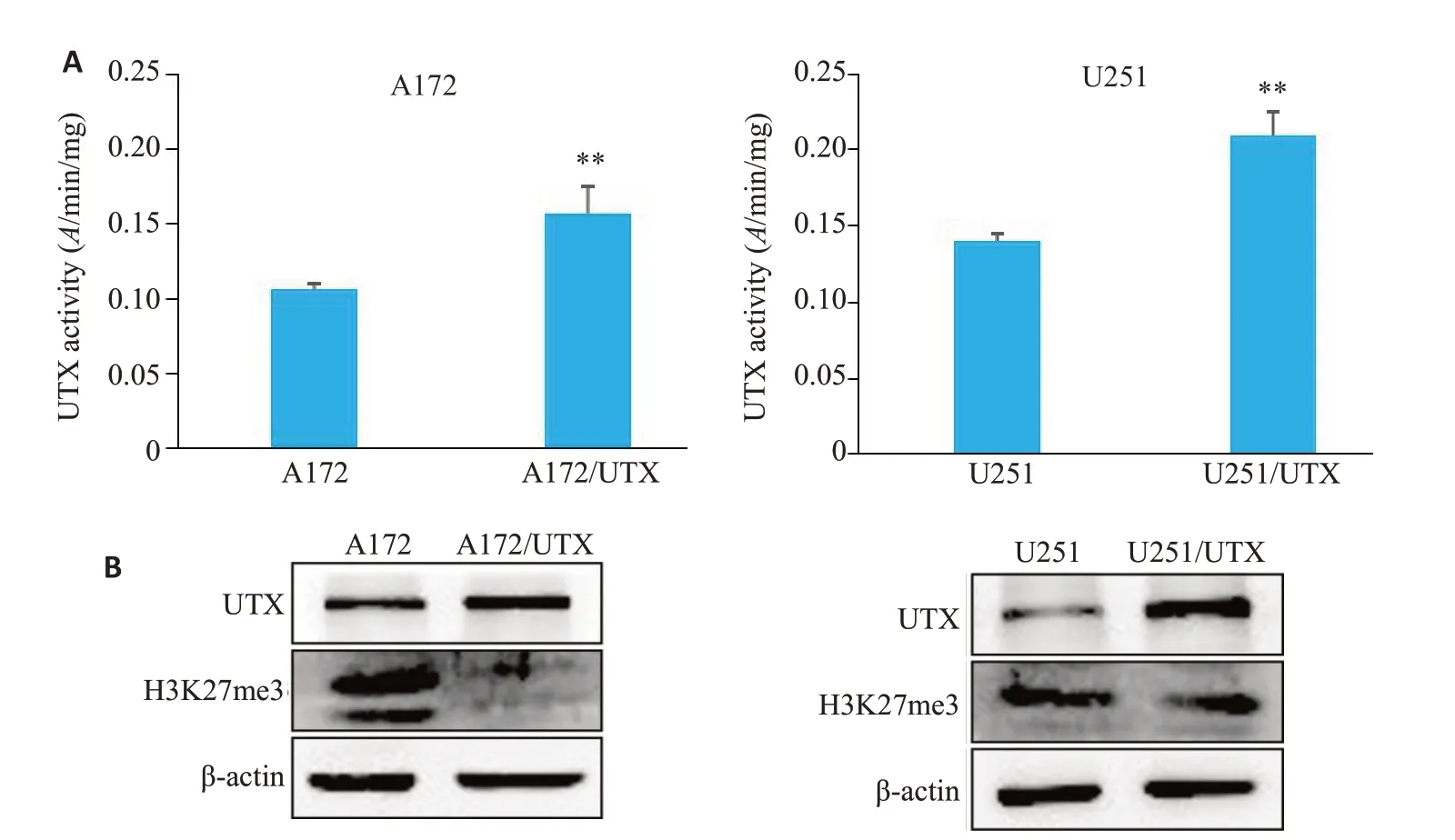
图4 胶质瘤细胞的UTX活性和蛋白表达水平Fig.4 UTX activity and protein expression level in the glioma cells.A: UTX activity in parental cells and UTX-overexpressing cells.B:Expression level of the proteins in parental cells and UTX-overexpressing cells.**P<0.01.
MTT实验结果(图5A)表明,不同浓度莪术醇处理后,UTX过表达细胞系的细胞活力均高于其亲本细胞,且存在显著性差异(P<0.01)。设立空白对照组、莪术醇组(40 μg/mL)、UTX过表达组、UTX过表达和莪术醇联合处理组,检测各组细胞的生存率及凋亡率。结果显示,UTX过表达能减弱莪术醇对胶质瘤细胞活力的抑制作用(图5B,P<0.01),在胶质瘤细胞A172 和U251中,分别使莪术醇处理的细胞活力升高了1.22倍(P<0.05)及1.24倍(P<0.05)。另外,UTX过表达显著降低了TMZ单处理和莪术醇、TMZ共处理诱导的细胞凋亡(图6),在A172细胞系中分别抑制了63.79%(P<0.01)及49.78%(P<0.01);在U251 细胞系中分别抑制了57.66%(P<0.01)及55.45%(P<0.01)。
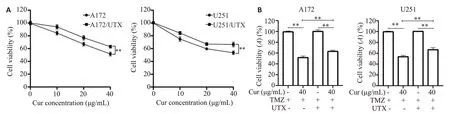
图5 MTT法检测胶质瘤细胞的存活率Fig.5 Survival rate of glioma cells detected by MTT assay.A:Cell survival rate in parental cells and UTX-overexpressing cells treated with curcumol(Cur).B:Viability of UTX-overexpressing glioma cells with curcumol treatment,TMZ pretreatment,or both.**P<0.01.
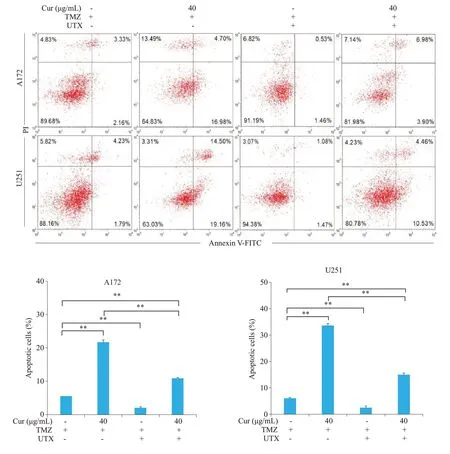
图6 流式细胞术检测胶质瘤细胞的凋亡率Fig.6 Glioma apoptosis detected by flow cytometry.**P<0.01.
2.5 莪术醇通过抑制UTX活性下调MGMT的表达
空白对照组、莪术醇组(40 μg/mL)、UTX 过表达组、UTX过表达和莪术醇联合处理组的Western blot结果(图7A)显示,莪术醇处理亲本细胞后,UTX蛋白水平无明显变化(P>0.05),H3K27me3 蛋白水平上调(P<0.01),MGMT蛋白水平下调(P<0.01);UTX过表达导致胶质瘤细胞的H3K27me3蛋白水平下降(P<0.01),MGMT蛋白水平上升(P<0.01);莪术醇处理UTX过表达细胞系后,UTX 的蛋白表达无显著变化(P>0.05),H3K27me3蛋白水平上升(P<0.01),MGMT蛋白水平下降(P<0.01)。
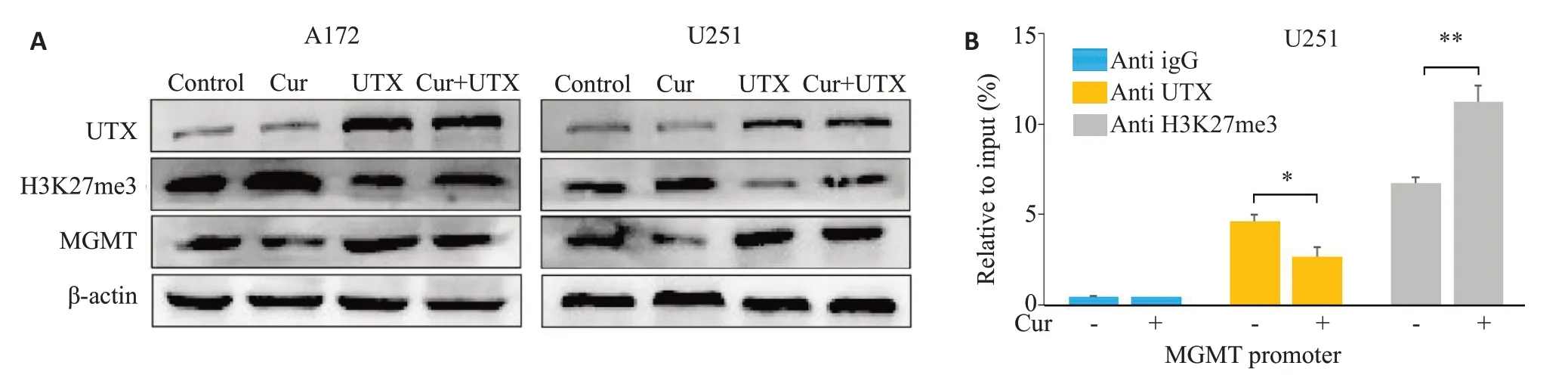
图7 莪术醇能抑制UTX活性来下调MGMT表达Fig.7 Curcumol(Cur)inhibits UTX activity to downregulate MGMT expression.A:Protein expression in UTX-overexpressing glioma cells with curcumol treatment.B:Relationship between each gene and the MGMT promoter in U251 cell line.*P<0.05,**P<0.01.
经莪术醇(40 μg/mL)单独处理后U251 细胞的ChiP-qPCR 实验结果(图7B)表明,莪术醇处理使MGMT启动子区UTX的富集降低了42.82%(P<0.05),H3K27me3修饰水平增加了66.19%(P<0.01)。
2.6 莪术醇通过UTX/MGMT调控胶质瘤细胞对TMZ的敏感性
与空白对照组相比,莪术醇组、联合加药组的UTX活性均下降(P<0.05),联合处理组下降程度更高,在胶质瘤细胞A172和U251中分别降低了22.83%(P<0.01)及34.33%(P<0.01),TMZ组则无明显变化(图8A,P>0.05)。Western blot结果显示(图8B),相较于空白对照组,莪术醇组、联合处理组的H3K27me3蛋白水平上升(P<0.05),MGMT蛋白水平下降(P<0.05),TMZ组无明显变化(P>0.05)。同样在体外细胞实验中也得到了相似的结果(图8B,P<0.05),此外,免疫组化检测结果显示(图8B)与莪术醇组相比较,联合加药组的MGMT阳性表达水平下降(P<0.05),Ki-67 阳性表达水平上升(P<0.05)。
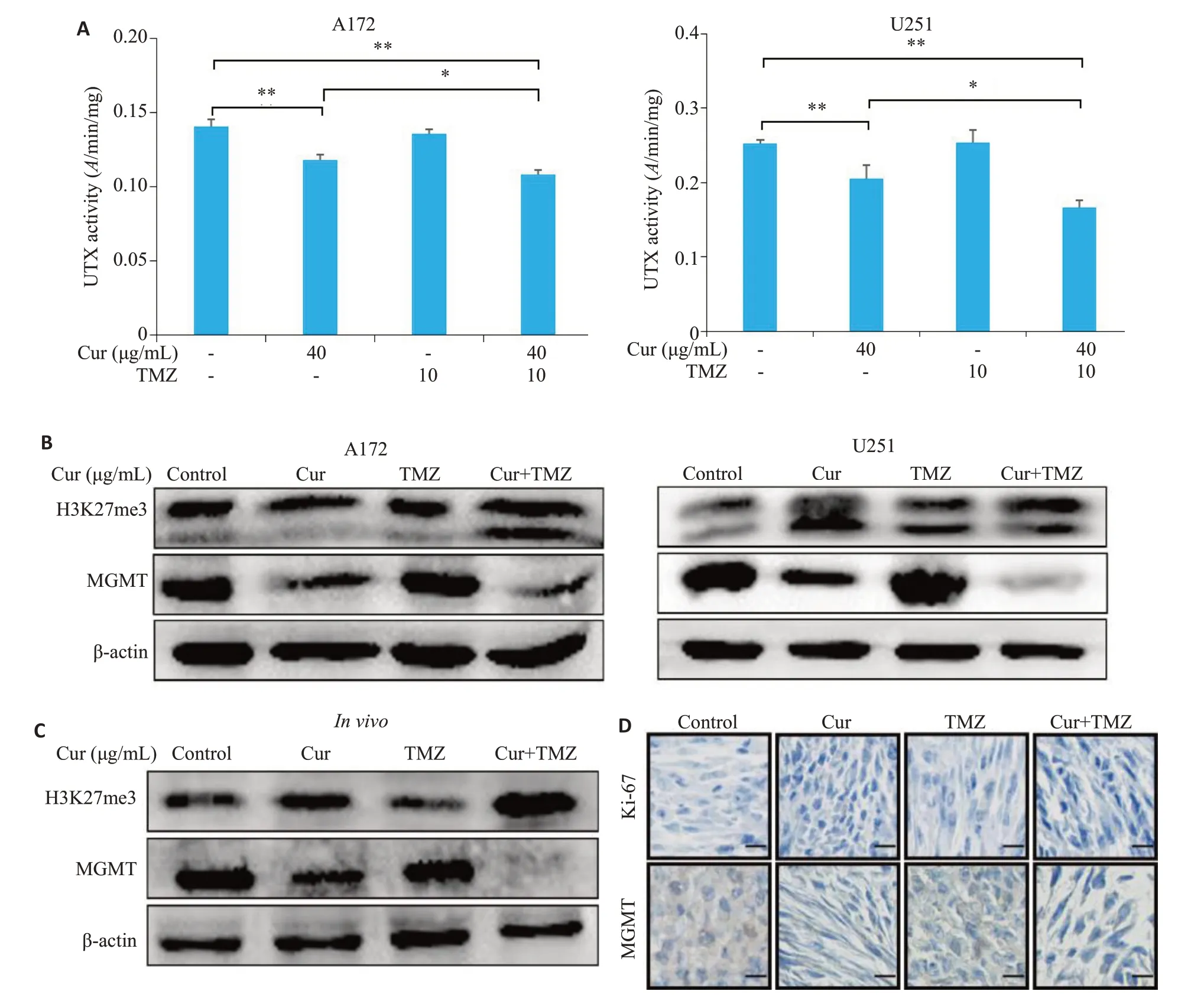
图8 莪术醇和TMZ联合用药处理后胶质瘤细胞的UTX活性,蛋白表达及免疫组化结果Fig.8 UTX activity,protein expressions and immunohistochemical results of glioma cells treated with curcumol(Cur)or TMZ.A: UTX activity in glioma cells under the treatment of curcumol or TMZ.B: Expression level of proteins in cultured glioma cells treated with curcumol or TMZ.C:Expression level of proteins in glioma xenografts in nude mice treated with curcumol or TMZ.D:Immunohistochemical results of Ki67 and MGMT expression in xenograft tumors(Scale bar=50 μm).*P<0.05,**P<0.01.
3 讨论
莪术醇,莪术挥发油中的重要有效单体成分,具有抗氧化、抗菌、抗纤维化和抗癌活性等多种治疗作用,可直接杀伤肿瘤细胞并抑制其增殖和诱导凋亡[12,13]。莪术醇能靶向不同的microRNAs调节PTEN/PI3K/Akt、Hippo、PDK1/AKT/mTOR 等信号通路来抑制结直肠癌、前列腺癌等不同肿瘤细胞的恶性生物学行为[14-16],但莪术醇对胶质瘤作用的研究甚少。本研究结果表明,莪术醇能抑制胶质瘤细胞的增殖并促进其凋亡,抑制瘤体生长。
表观遗传修饰能在调节组织特异性表达、X染色体失活、细胞分化与发育等方面起到关键作用,其中的DNA甲基化、组蛋白修饰能通过调控基因表达来影响恶性肿瘤的发生发展[17-19]。许多中药提取物能通过调控表观遗传修饰参与肿瘤的进程,其中也包括中药莪术的提取物Cur,比如Peng等[20]发现在绒毛膜癌中,莪术醇能显著抑制表观遗传因子DNMT和HDAC的表达,从而调控干细胞的自我更新;同时莪术醇能在肝癌细胞和胶质瘤细胞中通过抑制表观遗传靶点EZH2水平来抑制肿瘤的生长[5,21]。为此我们进一步探究了Cur在胶质瘤细胞中与表观遗传修饰因子UTX的关系。实验结果表明,Cur能显著抑制胶质瘤细胞内的UTX活性,但不能改变其基因水平。这提示我们莪术醇可能通过调控UTX的活性参与表观遗传修饰调控而进一步影响胶质瘤耐药。
有研究表明,UTX作为抑癌因子广泛存在于人和鼠体内[22],例如Li 等[23]报道UTX 的缺失会促进淋巴癌的形成并上调EfNB1的表达,增强其侵袭性;Lev和kobatake等[24,25]实验表明UTX通过拮抗EZH2介导的转录抑制来抑制膀胱癌细胞的增殖。但也有研究表明UTX 具有促肿瘤作用,比如UTX 在人乳腺癌细胞系MCF-7中的缺失会导致雌激素诱导的细胞增殖显著下降,同时抑制细胞的迁移[26];在表达致癌因子TAL1的TALL亚群中,UTX发挥着促肿瘤共激活因子的作用来促进细胞增殖[27]。由此可见,UTX在不同肿瘤中的作用具有异质性。本研究结果显示,UTX活性增加提高了胶质瘤细胞的存活率,提示其对胶质瘤发生发展可能起促癌作用。另外,UTX活性增加抑制了TMZ单处理以及莪术醇、TMZ共处理诱导的细胞凋亡,增加胶质瘤细胞对TMZ的耐药。
MGMT启动子甲基化水平,作为胶质瘤的表观遗传改变,可作为临床TMZ化疗敏感性预测指标[4]。已有研究通过改变MGMT表达水平增加胶质瘤对TMZ的敏感性,比如抑制PARP表达能抑制MGMT的PAR化以及修复O6-MetG的功能,从而增强胶质瘤对TMZ的敏感性[28];BMX 作为一种特异性HDAC8 抑制剂与TMZ联用可以调控MGMT表达,以此促进细胞凋亡[29]。利鲁唑抑制MGMT的表达从而增强TMZ在胶质瘤母细胞瘤中的抗肿瘤作用[30]。表观遗传修饰作为肿瘤发生发展的关键因素,已逐渐成为肿瘤研究的热点。而UTX作为位于X染色体上并逃逸其失活的表观遗传调节子基因,能通过下调基因启动子区H3K27me3水平来影响肿瘤的发展[6,11]。为此我们进一步探索了莪术醇、UTX与MGMT三者在胶质瘤细胞TMZ耐药中的关联性与作用。结果发现UTX具有对MGMT基因启动子特异性募集的作用。莪术醇减少MGMT基因启动子区的UTX富集,并增加H3K27me3水平。因此我们推测,大量组蛋白去甲基化酶UTX丢失引起启动子区H3组蛋白的N-末端赖氨酸残基K27发生大量三甲基化修饰,导致下游MGMT持续低表达从而增强胶质瘤细胞对于TMZ的敏感性。与此同时,体内、体外的联合加药实验补充表明,莪术醇可通过UTX/MGMT轴来抑制胶质瘤细胞的增殖,降低胶质瘤对TMZ的耐药性。结合前期的分子对接实验,我们推测莪术醇极有可能作为一种潜在的特异性小分子抑制剂,通过抑制UTX/JMJD3蛋白jumonji 结构域的活性,显著增加胶质瘤细胞中H3K27me3 修饰水平以此来进一步下调下游靶基因MGMT的表达,从而影响胶质瘤细胞的耐药性。
本研究发现高活性的UTX可抑制胶质瘤细胞凋亡,增强细胞耐药性,这可能是胶质瘤原发性耐药的作用机制之一。莪术醇能通过调控UTX/MGMT轴,促进细胞凋亡,逆转胶质瘤对于TMZ的耐药性。我们的研究结合表观遗传修饰,为寻找胶质瘤临床辅助抗癌药物以及其相应作用靶点提供了一定的实验基础与新的思路。
- 南方医科大学学报的其它文章
- 高表达分泌颗粒蛋白II增加结直肠癌细胞对奥沙利铂的耐药性
- Neutrophil-lymphocyte and platelet-lymphocyte ratios for assessing disease activity in patients with rheumatoid arthritis receiving tofacitinib treatment
- 淫羊藿素通过调控铁死亡增加鼻咽癌细胞的放射敏感性
- 靶向结直肠癌的小白菊内酯脂质体纳米颗粒诱导程序性坏死并改善T细胞耗竭
- 二甲双胍减轻阿霉素诱导的心脏毒性:基于AMPK通路
- 甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病