低温胁迫下不同类型蓝莓品种的抗寒性研究
魏 鑫, 王 升, 王宏光, 王兴东, 杨玉春, 刘有春, 刘 成
(辽宁省果树科学研究所,辽宁营口 115009)
蓝莓学名越橘,杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,因果实中富含花青素等营养物质而深受消费者欢迎[1-2]。蓝莓为浅根性灌木类植物,抗寒性较弱[3]。而我国北方地区冬季严寒、气候干燥,种植蓝莓时冬季需采取防寒保护措施才能安全越冬,这既增加了生产成本、工作量,同时在防寒过程中易对树体造成损伤,导致减产。低温胁迫导致的冻害是影响蓝莓栽培的重要非生物胁迫之一,严重影响辽宁地区蓝莓产业化的发展[4]。因此,开展蓝莓抗寒生理机理研究对挖掘利用抗寒资源、完善抗寒基础理论、制定适宜的防寒技术措施等均具有重要意义。
抗寒机理研究是鉴定植物抗寒性强弱的生理基础[5]。蓝莓不同组织器官的生物学性状和基因的差异是影响其抗寒性差异的主要原因[6-7]。蓝莓的抗寒性强弱与休眠和水分状态变化密切相关,通常休眠越深,束缚水含量越高,其抗寒性越强。抗寒性强的品种具有较高的果糖和葡萄糖含量,受低温胁迫后,相对电导率的变化相对平缓,丙二醛含量积累较低[1,8-10]。王明洁等通过对越冬期露地栽培条件下枝条受伤情况以及质膜相对透性、脯氨酸含量、超氧化物歧化酶活性的综合分析,参试蓝莓抗寒性由强到弱依次为美登>齐伯瓦>北蓝>蓝丰>康维尔[11]。蓝莓抗寒性的强弱除与品种自身特性有关外,还与环境条件、栽培技术、管理水平、植株营养状况等诸多因素有关[12]。影响蓝莓抗寒性的因素有很多,需要通过系统分析并结合田间冻害情况调查和受冻后的生长恢复情况等加以综合判断。因此,本试验通过人工模拟低温环境的方法,测定5个蓝莓品种1年生枝条的质膜透性、保护酶活性及丙二醛、渗透调节物质、纤维素、总含水量、自由水和束缚水含量等抗寒生理指标,以期阐释蓝莓抗寒生理机理,为研究蓝莓抗寒生理学鉴定方法、挖掘利用蓝莓抗寒特异资源和选育抗寒新品种提供数据基础。
1 材料与方法
1.1 试验材料
参试品种为:6年生矮丛品种美登、半高丛品种北陆、北高丛品种蓝丰、南高丛品种密斯梯和兔眼品种精华。供试材料定植于辽宁省果树科学研究所蓝莓资源圃塑料大棚内,采取常规管理措施。
1.2 试验方法
1.2.1 取样与材料处理 于2015年1月7日选取经抗寒锻炼后的5个品种植株不同方向、完全木质化直径为0.3~0.5 cm的1年生枝。先后采用自来水和蒸馏水清洗干净,滤纸吸干,自封袋分装好后备用。一部分用于不同低温处理,处理温度为-15、-20、-25、-30、-35、-40 ℃、对照(至于冰箱中 4 ℃ 冷藏保存),冷冻时温度下降幅度和解冻时的温度回升幅度均为5 ℃/h,到达处理所需温度后,维持24 h,然后解冻。测定相对电导率、保护酶活性、丙二醛和游离脯氨酸含量。一部分烘箱 120 ℃ 杀青20 min后,80 ℃烘干至恒质量,粉碎成粉末后用于测定可溶性总糖、还原糖、淀粉、可溶性蛋白、糖组分和纤维素含量,一部分用于测定枝条总含水量、自由水含量并计算束缚水含量、自由水含量/束缚水含量,每处理3次重复,每次重复10个枝条。
1.2.2 测定指标与方法 电解质渗透率采用电导率仪法[13]测定;丙二醛(MDA)含量采用TBA显色法[14]测定;过氧化物酶(POD)活性采用愈创木酚法[14]测定;过氧化氢酶(CAT)活性采用紫外吸收法[14]测定;超氧化物酶(SOD)活性采用氮蓝四唑光还原法[14]测定;游离脯氨酸含量采用硝基水杨酸[14]测定;可溶性糖、还原糖、淀粉、纤维素含量采用蒽酮比色法[14-15]测定;可溶性蛋白含量采用考马斯亮蓝比色法[14]测定;糖组分采用高效液相色谱法[16-17]测定;总含水量、自由水和束缚水含量采用烘干称质量法和阿贝折射仪[14]测定。
1.3 统计分析
用Excel 2007软件处理试验数据,用Origin 2018软件制图,用SPSS 20.0软件进行单因素方差分析,用Duncan’s检验差异显著性和主成分分析。
2 结果与分析
2.1 低温胁迫对5个蓝莓品种枝条相对电导率的影响
由图1可知,5个品种在试验低温范围内,相对电导率随处理温度的降低逐渐升高。5个品种相对电导率随温度降低变化的速率有所不同。美登、北陆和蓝丰品种相对电导率随温度的降低变化较为平缓。密斯梯和精华2个品种在-25 ℃后相对电导率明显提高。-40 ℃时,美登、北陆、蓝丰、密斯梯、精华5个品种相对电导率较4 ℃时分别增加了1.18、1.52、1.48、3.45、1.55倍。
4 ℃条件下,5个品种枝条相对电导率最低,密斯梯相对电导率显著高于美登、北陆、精华,与蓝丰差异不显著。密斯梯、蓝丰、美登和北陆间差异不显著;-40 ℃处理下,5个品种枝条相对电导率均最高,且5个品种由高至低依次为密斯梯、精华、蓝丰、北陆、美登,品种间差异均显著(P<0.05)。
2.2 低温胁迫对5个蓝莓品种枝条丙二醛(MDA)含量的影响
5个品种在试验低温范围内,由图2可知,MDA含量随处理温度的降低逐渐升高。4 ℃时,美登与-15 ℃差异未达显著水平,但显著低于其他温度(P<0.05)。-40 ℃时显著高于其他温度(P<0.05);4 ℃时,北陆枝条MDA含量与15、-20 ℃差异不显著,但显著低于其他温度(P<0.05)。-40 ℃ 时,极显著高于4、15、-20 ℃(P<0.01);4 ℃ 时,蓝丰枝条MDA含量与15、-20 ℃差异不显著,但显著低于其他温度(P<0.05)。-40 ℃时,与-35 ℃差异未达显著水平,但显著高于其他温度(P<0.05);4 ℃时,密斯梯枝条MDA含量与15 ℃差异不显著,但极显著低于其他温度(P<0.01)。-40 ℃时,与-30、-35 ℃差异不显著,但极显著高于其他温度(P<0.01);4 ℃时,精华枝条MDA含量与15、20 ℃差异不显著,但极显著低于其他温度(P<0.01)。-40 ℃时,与-30、-35 ℃差异不显著,但极显著高于其他温度(数据未显示)。
密斯梯品种在-35 ℃时,枝条MDA含量显著高于精华(P<0.05),极显著高于其他3个品种(P<0.01)。其他各温度处理条件下时,均极显著高于其他4个品种(P<0.01);美登品种在4、-20、-35 ℃时,与北陆、蓝丰间差异不显著,但显著低于密斯梯、精华(P<0.05)。-40 ℃时,与北陆间差异不显著,但显著低于蓝丰、密斯梯、精华(P<0.05)。
2.3 低温胁迫对5个蓝莓品种枝条过氧化物酶(POD)活性的影响
由图3可知,5个品种在试验温度范围内均成单峰变化趋势,但出峰温度有所不同。密斯梯和精华2个品种在-25 ℃时,POD活性达最高,极显著高于其他温度(P<0.01)。美登、北陆和蓝丰3个品种在-30 ℃时,POD活性达到最高,美登和蓝丰显著高于其他温度(P<0.05),北陆与-35 ℃差异未达显著水平,但显著高于其他温度(P<0.05)。4 ℃ 时,美登、密斯梯枝条POD活性极显著低于其他温度(P<0.01),北陆、蓝丰、精华3个品种枝条POD活性与-40 ℃差异不显著,但显著低于其他温度(数据未显示)。
在4 ℃和-40 ℃温度下,美登枝条POD活性显著高于其他4个品种(P<0.05),在其他温度条件下,极显著高于其他4个品种(P<0.01);4 ℃和-30 ℃条件下,北陆、蓝丰均显著高于密斯梯、精华(P<0.05),北陆和蓝丰差异达显著水平(P<0.05),密斯梯、精华差异不显著;-40 ℃条件下,北陆、蓝丰显著高于精华(P<0.05),北陆、蓝丰和密斯梯及密斯梯和精华间差异不显著。

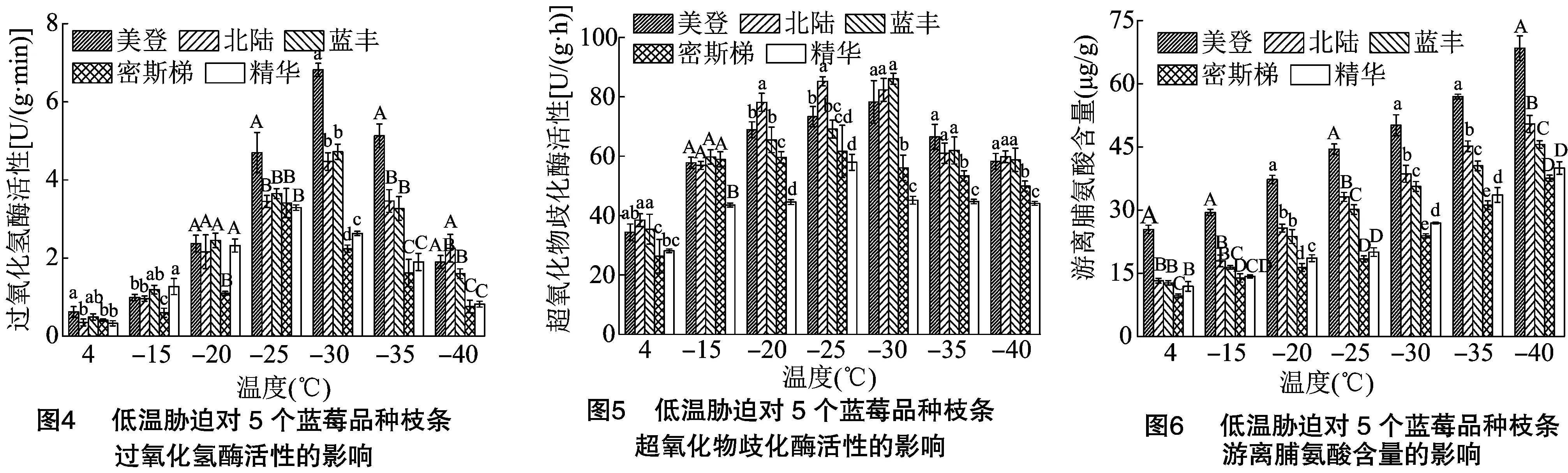
2.4 低温胁迫对5个蓝莓品种枝条过氧化氢酶(CAT)活性的影响
由图4可知,5个品种在试验温度范围内均成单峰变化趋势,但出峰温度有所不同。密斯梯、精华2个品种在-25 ℃时,CAT活性达最高,均极显著高于其他温度(P<0.01);美登、北陆和蓝丰3个品种在-30 ℃时,CAT活性达最高,均极显著高于其他温度(P<0.01);4 ℃时,蓝丰、精华2个品种极显著低于其他温度(P<0.01)。美登品种与 -15 ℃ 差异未达显著水平,但极显著低于其他温度(P<0.01)。北陆显著低于-15 ℃(P<0.05),极显著低于其他温度(P<0.01)。密斯梯品种与 -15、-40 ℃ 差异未达显著水平,极显著低于其他温度(数据未显示)。
在-25 ℃条件下,美登CAT活性极显著高于其他4个品种(P<0.01),其他品种间差异未达显著水平;在-30 ℃条件下,美登CAT活性极显著高于其他4个品种(P<0.01)。北陆、蓝丰极显著高于密斯梯、精华(P<0.01),精华显著高于密斯梯(P<0.05);-40 ℃时,北陆与美登未达显著水平,极显著高于其他3个品种(P<0.01)。美登与蓝丰差异未达显著水平,均极显著高于密斯梯、精华(P<0.01)。
2.5 低温胁迫对5个蓝莓品种枝条超氧化物酶(SOD)活性的影响
由图5可知,5个品种在试验温度范围内均成单峰变化趋势,但出峰温度有所不同。北陆、密斯梯和精华3品种在-25 ℃时,SOD活性达最高,北陆品种与-30 ℃差异不显著,但极显著高于其他温度(P<0.01)。密斯梯品种显著高于4、-40 ℃(P<0.05),与其他温度差异不显著;精华品种极显著高于其他温度(P<0.05)。美登、蓝丰2个品种在-30 ℃时,SOD活性达最高。美登品种与 -25 ℃ 差异未达显著水平,显著高于其他温度(P<0.05);蓝丰品种极显著高于其他温度。4 ℃时,各品种均表现为极显著低于其他温度(数据未显示)。
4 ℃条件下,美登、北陆和蓝丰SOD活性显著高于密斯梯,北陆和蓝丰显著高于精华(P<0.05),美登、北陆、蓝丰,美登、精华间及密斯梯、精华间差异不显著;-25 ℃条件下,北陆显著高于其他4个品种(P<0.05),精华与密斯梯差异未达显著水平,但显著低于另外3个品种(P<0.05)。美登显著高于密斯梯(P<0.05),但与蓝丰差异不显著;-30、-35、-40 ℃ 条件下,美登、北陆和蓝丰显著高于密斯梯、精华(P<0.05),美登、北陆、蓝丰间差异不显著,精华显著高于密斯梯(P<0.05)。
2.6 低温胁迫对5个蓝莓品种枝条渗透调节物质的影响
由图6可知,5个品种在试验低温范围内,游离脯氨酸含量随处理温度的降低呈逐渐上升的变化趋势。美、北陆、蓝丰、密斯梯4个品种游离脯氨酸含量随温度升高含量极显著升高,精华品种除 -20 ℃ 和-25 ℃差异未达显著水平外,其他温度间差异均达显著水平(数据未显示)。
4 ℃条件下,美登游离脯氨酸含量极显著高于其他4个品种(P<0.01),密斯梯极显著低于其他4个品种(P<0.05);-25 ℃和-40 ℃时,美登、北陆、蓝丰3个品种差异达极显著水平(P<0.01),且均极显著高于密斯梯、精华(P<0.01);-30 ℃时,5个品种由高到低依次为美登、北陆、蓝丰、精华、密斯梯,品种间差异均达显著水平(P<0.05)。
由表1可知,北陆可溶性总糖含量极显著高于其他4个品种(P<0.01)。美登与蓝丰差异不显著,极显著高于密斯梯和精华(P<0.01);蓝丰显著高于密斯梯(P<0.05),与精华差异不显著。北陆还原糖含量极显著高于其他4个品种,美登极显著高于其他3个品种(P<0.01),蓝丰显著高于密斯梯(P<0.05),精华分别与蓝丰和密斯梯差异均不显著。北陆、美登、蓝丰3品种的淀粉含量极显著高于密斯梯和精华,北陆、美登、蓝丰间差异达极显著水平(P<0.01);精华显著高于密斯梯(P<0.05)。北陆、美登、蓝丰3品种的蛋白质含量显著高于密斯梯和精华,北陆、美登、蓝丰间差异达到显著水平(P<0.05);密斯梯与精华间差异未显著水平。北陆果糖含量极显著高于其他4个品种,美登极显著高于其他3个品种(P<0.01);蓝丰与精华差异不显著,但极显著高于密斯梯,精华(P<0.01),显著高于密斯梯(P<0.05)。美登、北陆2个品种的葡萄糖含量差异未达显著水平,但均极显著高于蓝丰、密斯梯和精华(P<0.01),蓝丰、精华间差异未达显著水平,均显著高于密斯梯(P<0.05)。北陆蔗糖含量极显著高于其他4个品种,美登极显著高于其他3个品种(P<0.01);蓝丰与精华差异不显著,但均极显著高于密斯梯(部分数据未显示)。
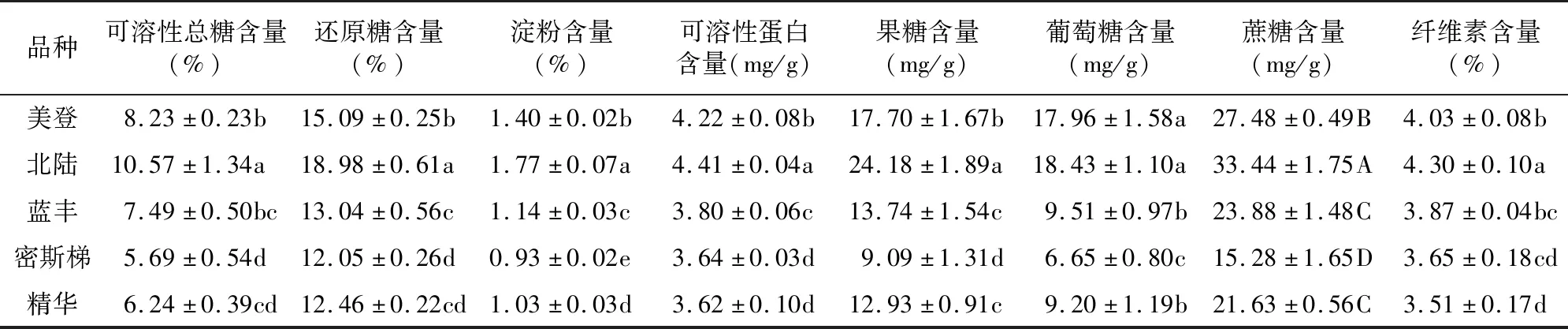
表1 5个蓝莓品种枝条渗透调节物质及纤维素含量差异
2.7 5个蓝莓品种枝条纤维素含量的差异
北陆纤维素含量显著高于美登,极显著高于其他3个品种(P<0.01);美登与蓝丰差异不显著,极显著高于密斯梯和精华(P<0.01);蓝丰显著高于精华,与密斯梯差异不显著;密斯梯与精华间差异不显著(部分数据未显示)。
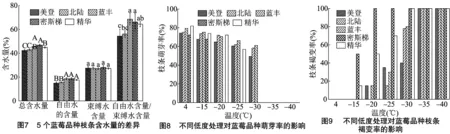
2.8 5个蓝莓品种枝条含水量的差异
由图7可知,密斯梯品种枝条总含水量显著高于蓝丰,极显著高于另3个品种(P<0.01)。蓝丰、精华极显著高于北陆和美登(P<0.01);蓝丰、密斯梯、精华3个品种枝条自由水含量极显著高于美登、北陆(P<0.01),蓝丰、密斯梯和精华及美登和北陆之间差异不显著;5个品种束缚水含量差异未达显著水平;蓝丰、密斯梯自由水含量/束缚水含量极显著高于美登(P<0.01),显著高于北陆(P<0.05),与精华差异不显著。精华显著高于美登(P<0.05),与北陆间差异未达显著水平。
2.9 5个蓝莓品种枝条低温处理后的恢复情况
由图8可知,5个品种在试验低温范围内,萌芽率随处理温度的降低呈逐渐下降的变化趋势。4 ℃条件下,美登、北陆、蓝丰、密斯梯和精华枝条萌芽率分别为74.33%、75.29%、79.37%、72.30%和81.90%;-15 ℃条件下,5个品种枝条萌芽率分别下降了6.60%、1.61%、4.15%、4.54%和7.95%;密斯梯在-20 ℃条件下,枝条萌芽率为0,精华在 -30 ℃ 条件下枝条萌芽率为0,美登、北陆、蓝丰在-35 ℃条件下枝条萌芽率为0。
由图9可知,5个品种在试验低温范围内,枝条褐变程度随处理温度的降低呈逐渐上升的变化趋势。4 ℃条件下,美登、北陆、蓝丰、密斯梯和精华枝条褐变率均为0;-15 ℃条件下,5个品种枝条萌芽率分别为0、0、0、50%和15%;密斯梯在-20 ℃条件下,枝条褐变率为100%,精华在-30 ℃条件下枝条褐变率为100%,美登、北陆、蓝丰在-35 ℃条件下枝条褐变率为100%。
2.10 5个蓝莓品种抗寒性的主成分分析
由表2、表3可知,对5个蓝莓品种1年生枝条MDA含量、POD、SOD活性等18个抗寒生理指标进行主成分分析,依据特征值>1的原则,提取了3个主成分,累计方差贡献率94.979%,表明前3个主成分可反映5个品种抗寒生理指标的大多数信息。其中,第1主成分的代表指标为葡萄糖含量(0.989)、蛋白质含量(0.976)、淀粉含量(0.940)、蔗糖含量(0.937),特征值为13.515,方差贡献率75.085%;第2主成分的代表指标为POD活性(-0.685)、游离脯氨酸含量(-0.480),特征值为1.95,贡献率为10.836%;第3主成分的代表指标为束缚水含量(0.895)、自由水含量/束缚水含量(0.485)、MDA含量(0.485),特征值为1.630,贡献率为9.058%。
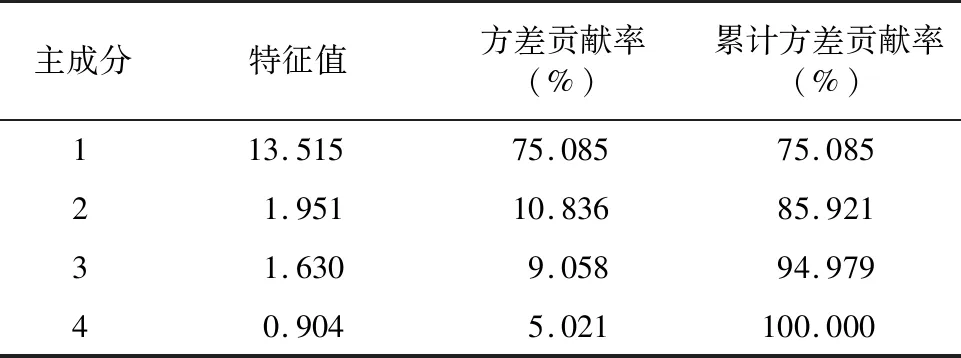
表2 5个蓝莓品种抗寒生理指标的主成分分析
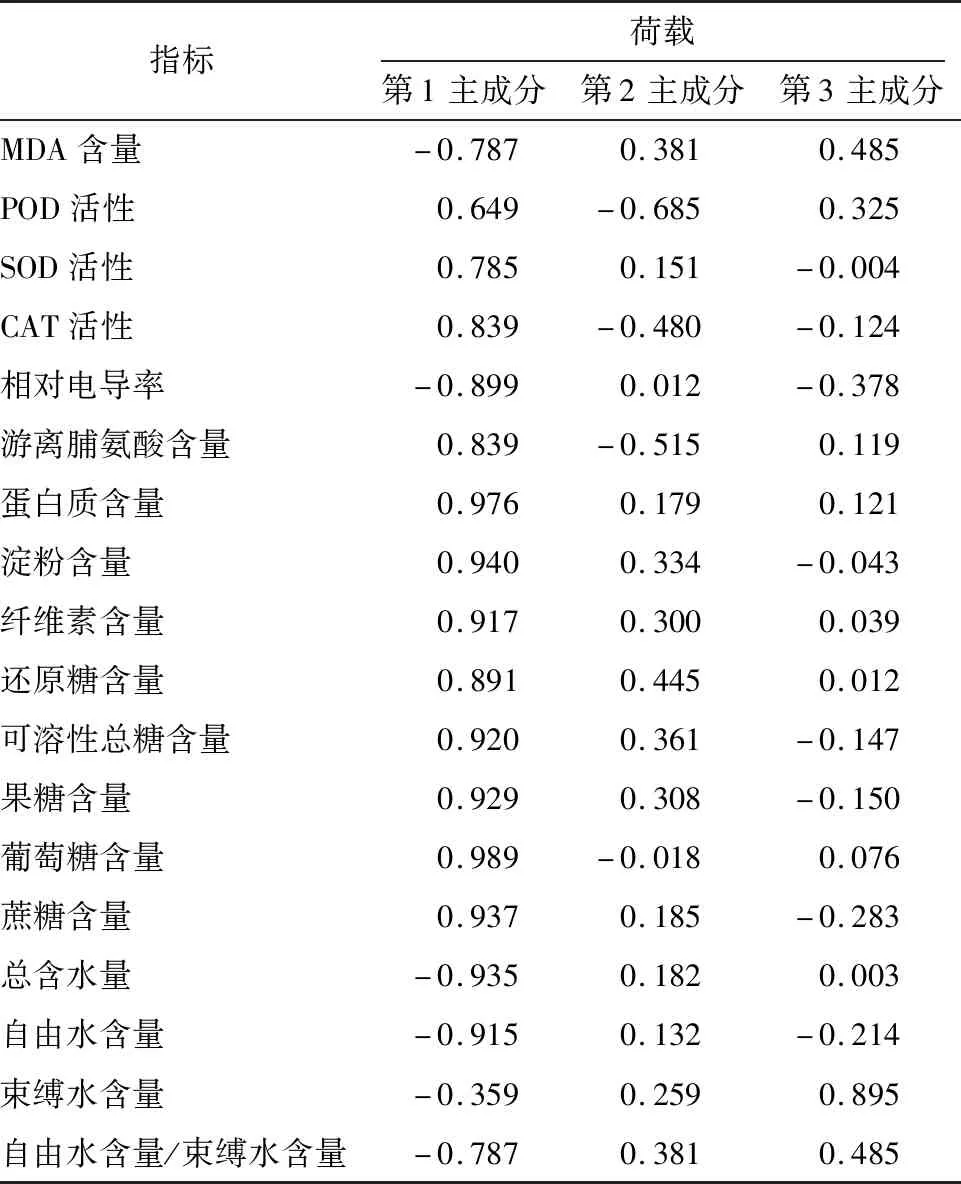
表3 5个蓝莓品种抗寒生理指标主成分载荷矩阵
由表4可知,3个主成分的特征值比所提取的主成分总特征值之和作为权重计算主成分分值,具体如下:
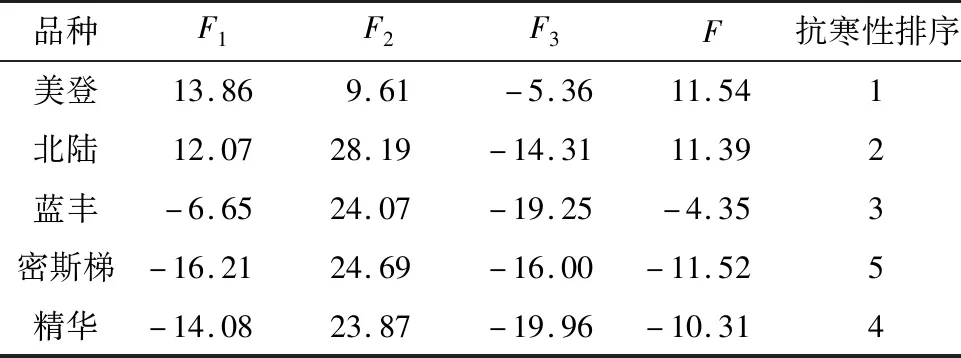
表4 5个蓝莓品种主成分得分及综合评价
主成分值1:F1=-0.214x1+0.177x2+0.214x3+0.228x4-0.245x5+0.228x6+0.265x7+0.256x8+0.249x9+0.242x10+0.250x11+0.253x12+0.269x13+0.255x14-0.254x15-0.249x16-0.098x17-0.238x18;
主成分值2:F2=0.273x1-0.490x2+0.108x3-0.344x4+0.009x5-0.369x6+0.128x7+0.239x8+0.215x9+0.319x10+0.258x11+0.221x12-0.013x13+0.132x14+0.13x15+0.095x16+0.185x17+0.063x18;
主成分值3:F3=0.38x1+0.255x2-0.003x3-0.097x4-0.296x5+0.093x6+0.095x7-0.034x8+0.031x9+0.009x10-0.115x11-0.117x12+0.06x13-0.222x14+0.002x15-0.168x16+0.701x17-0.275x18;
以所选取的第1~3主成分的特征值和主成分值构建综合评价模型:F=(13.515F1+1.951F2+1.630F3)/(13.515+1.951+1.630),其中,F为综合得分值,利用主成分分析综合得分值评价5个品种抗寒性强弱,得分值越高则抗寒性越强。因此,5个蓝莓品种的抗寒性由强到弱依次为美登>北陆>蓝丰>精华>密斯梯。
3 讨论
温度是影响植物生存、分布、生长发育的重要因素[18-19]。植物在低温胁迫过程中,发生了一系列涉及生物膜性质变化、代谢酶活性降低及活性氧、渗透调节物质和胁迫响应蛋白积累的生理生化和基因的变化以适应低温环境[20]。细胞膜系统是植物受低温伤害的原发部位,低温胁迫可引起胞内电解质外渗,相对电导率增大,MDA含量升高,因此,细胞膜破坏程度通过作为鉴定植物抗寒性强弱的重要参考指标[21-22]。本研究发现,在试验低温范围内,5个品种枝条相对电导率和MDA含量随处理温度的降低而升高,但变化的速率有所不同。美登、北陆和蓝丰相对电导率和MDA含量升高的速率相对平缓,而密斯梯和精华明显升高,受害程度较高。

植物在低温胁迫条件下,可通过提高渗透调节物质的质量分数,降低细胞液渗透势、水分含量和冰点,从而提高抗寒性[27-28]。游离脯氨酸、可溶性蛋白和可溶性糖是植物重要的渗透调节物质[29]。低温胁迫下,它们的积累不但可提高细胞的保水能力,还能防止活性氧对蛋白质和膜脂的过氧化,缓解或抵御低温伤害的发生,其含量可作为抗寒性鉴定的生理指标[30-31]。本研究发现,美登、北陆和蓝丰3个品种具有较高的游离脯氨酸、可溶性总糖、还原糖、淀粉、可溶性蛋白、果糖、葡萄糖、蔗糖和纤维素含量。美登、北陆2个品种具有较低的总含水量、自由水含量和自由水含量/总束缚水含量。当低温逆境来临时,美登、北陆2个品种能够快速调节自身的渗透调节物质含量来应对逆境低温伤害。恢复生长法是评价植物抗寒性的最直观和可靠的方法,枝条遭受低温伤害的程度,主要通过芽对低温的敏感性反映出来,通过统计低温胁迫后枝条的萌芽率和褐变程度,可以直接确定枝条抗寒性强弱[32]。-30 ℃ 条件下,美登、北陆、蓝丰3个品种枝条仍达49%以上的萌芽率,同时部分枝条未受低温伤害而褐变。
4 结论
通过人工模拟低温环境的方法,测定、计算5个蓝莓品种1年生枝条的18个与抗寒性相关的生理指标,同时结合主成分分析,结果显示,供试5个蓝莓品种的抗寒性由强到弱依次为:美登、北陆、蓝丰、精华和密斯梯。美登抗寒性较强的原因是具有较高的POD、SOD、CAT活性,可溶性总糖、淀粉、纤维素和可溶性蛋白含量及较低的枝条总含水量和自由水含量。

