基于生物信息学分析POSTN基因在胃癌中的表达及免疫意义①
孟祥宇 叶亚运 王俊斌 (蚌埠医学院第一附属医院肿瘤内科,蚌埠 233000)
胃癌(gastric cancer,GC)是最常见的恶性肿瘤之一。根据2021 年中国国家癌症中心的统计,GC已成为我国第二常见的恶性肿瘤,也是癌症相关死亡的第二大原因[1]。与多数发达国家相比,我国GC病死率(0.845)和五年发病率(27.6/100 000)都更高,并突出了一个令人担忧的特征,即年轻人群中早发性GC 发病率持续上升[2]。尽管目前采取手术切除、全身化疗及靶向治疗等综合治疗手段改善了胃癌的治疗效果,但GC 患者长期生存情况仍不令人满意,尤其是晚期GC 临床预后仍不理想[3-4]。新兴的免疫疗法已成为GC 患者的一种有前途的替代疗法。免疫检查点抑制剂包括抗细胞毒性T淋巴细胞抗原4(anti-cytotoxic T-lymphocyte antigen 4,CTLA4)单抗(Ipilimab)和抗程序性死亡受体-1(antiprogrammed cell death protein 1,anti-PD-1)单抗(nivolumab,pembrolizumab),开启了肿瘤免疫治疗的新时代,使癌症治疗模式发生转变[5]。其中,PD-1单抗nivolumab 已被FDA 批准用于晚期GC 患者一线治疗,并取得了良好效果[6]。但仅有少部分GC患者从中获益,众多GC 患者仍需更多新的和敏感的标志物预测或增强免疫治疗应答。近年越来越多的证据表明,骨膜蛋白(periostin,POSTN)在非小细胞肺癌、乳腺癌、肝细胞癌和结肠癌等多种肿瘤中的表达明显增加,在细胞增殖、迁移和血管生成中的作用也被证实[7-11]。POSTN 在GC 中的致癌作用机制尚不清楚,且POSTN 在肿瘤免疫学及预后中的意义也鲜有报道。本研究初步分析POSTN 在GC 组织中的表达及意义,发现GC 组织高表达POSTN,且与生存期呈负相关。于是,本研究系统地评价了GC 中淋巴细胞状态,阐明了POSTN 与GC 免疫浸润的关系以及POSTN 介导的免疫应答信号通路,以POSTN相关免疫调节剂确定免疫预后信号,结合此信号和临床病理特征建立诺模图,评估POSTN 在GC 中的免疫意义。
1 资料与方法
1.1 GC表达谱获取和生存分析 从TCGA (https://portal.gdc.cancer.gov/)数据库获取GC患者(非肿瘤组织32 例,肿瘤组织375 例)转录组RNA-Seq 数据(Workflow Type:HTSeq-FPKM)及所有样本临床信息。从GEO(https://www.ncbi.nlm.nih.gov/geo/)数据库获取GSE29998数据集99例GC及非GC组织基因表达谱。利用R 软件“Limma”“GGplot2”“GGpubr”等软件包对上述数据进行进一步处理及分析,采用“survminer”包和KM 数据库(http://kmplot.com/analysis/index.php?p=service&cancer=gastric)绘制Kaplan-Meier图。
1.2 免疫浸润细胞评估和POSTN 与免疫细胞相关性分析 采用Cibersort 方法对组织中22 种免疫细胞进行定性和定量分析,主要依赖于LM22 的免疫细胞亚型表达矩阵,包含547 个标志基因,可区分22 种人类造血细胞表型[12]。利用Cibersort(https://cibersort.stanford.edu/)的CiberSort R 脚本对其表达矩阵进行分析,蒙特卡罗法计算每种情况去卷积的经验P值,P<0.05为差异有统计学意义。
1.3 POSTN 与免疫调节剂的相关性 从TISIDB(http://cis.hku.hk/TISIDB/)数据库提取POSTN 相关免疫调节剂,该数据库旨在通过整合多种不同类型数据阐明肿瘤-免疫系统的相互作用[13]。采用Spearman 相关检验筛选与POSTN 表达显著相关的免疫调节剂。使用基因集分析工具(http://www.webgestalt.org/)对上述基因进行GO 注释和KEGG 途径富集分析,P和FDR均<0.05为富集显著。
1.4 风险与预测模型构建 基于POSTN 相关免疫调节剂构建一个可预测预后的模型。使用Cox 回归模型的Akaike 信息标准进行逐步变量选择[14]。筛选出免疫基因后生成预后指数(风险评分),风险评分=X1y1+X2y2+……+Xiyi,Xi 代表各基因风险系数,yi 代表各基因表达。采用Kaplan-Meier 生存曲线、对数秩和检验及单变量Cox 分析评价免疫相关基因特征和临床特征与总生存率的关系。对风险评分进行多因素Cox 分析,调整年龄、性别、分级和临床分期。使用“Survival ROC”软件包绘制ROC 曲线,评估风险评分的预后准确性。
1.5 诺模图绘制 作为一种广泛使用的预测模型,诺模图可直观地提供个性化的预后风险评估[15]。基于患者临床特征和风险评分,使用“RMS”软件包构建诺模图预测一年、三年和五年总生存期(overall survival,OS)概率。Bootstrap(1 000 个重复)法计算一致性指数(Cindex)评估诺模图的预测准确性。绘制校准曲线比较预测OS与实际OS概率。
1.6 统计学分析 采用Rv 4.1.1 软件进行统计学分析。箱线图显示POSTN 在GC 中的表达分布,Wilcoxon 检验差异表达。Kaplan-Meier 图、HR、P或CoxP用于生存曲线log-rank检验。采用Spearman相关分析确定POSTN 表达与其他基因或免疫浸润水平在肿瘤类型中的相关性。除非另有说明,否则截断点设为中位值。P<0.05为差异有统计学意义。
2 结果
2.1 POSTN 在GC 中的表达及预后价值 为探讨POSTN 在GC 中的表达及意义,本研究分析了TCGA STAD 及GSE29998 数据集,发现与非肿瘤组织相比,GC 中POSTN 表达显著上调(图1A、B)。以POSTN 在GC 中表达的中位值将其分为高、低表达两组进行生存分析,结果显示POSTN 低表达组OS高于POSTN高表达组(图1C、D)。

图1 POSTN在GC中的表达及预后价值Fig.1 POSTN expression and its prognostic significance in GC
2.2 GC和正常胃组织中免疫细胞浸润情况 为探讨正常组织与GC 组织中免疫细胞浸润水平,采用Cibersort 对组织中22 种免疫细胞进行分析,发现正常组织和GC 组织肿瘤浸润性免疫细胞(tumorinfiltrating immune cells,TIIC)成 分 有 显 著 差 异(图2A),且与正常组织相比,肿瘤组织免疫细胞浸润模式不同(图2B)。各类型TIICs 呈正相关(图2C)。POSTN 表达与记忆性B 细胞、初始B 细胞、浆细胞、CD8+T 细胞和调节性T 细胞呈负相关(图3A~E);与γδT细胞、嗜酸性粒细胞、活化肥大细胞、M0巨噬细胞、未活化的NK细胞、M2巨噬细胞水平和中性粒细胞呈正相关(图3F~L)。
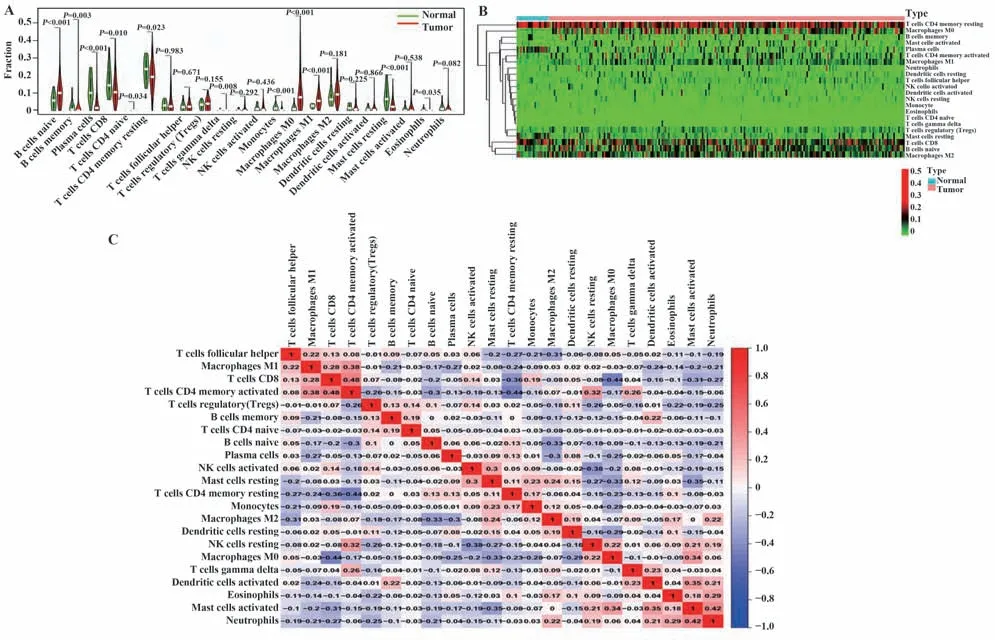
图2 375例GC和32例非GC组织22种TIICs表达及相关性分析Fig.2 22 TIICs expressions in 375 GC and 32 non-GC tissues and correlation analysis

图3 GC患者POSTN与免疫细胞浸润水平的相关性Fig.3 Correlation between POSTN and immune cell infiltration levels in GC patients
2.3 POSTN 与免疫细胞的相关性 几个免疫亚群与POSTN mRNA 水平呈正相关(图4)。深入研究POSTN 在调节GC 免疫应答中的功能涉及的信号通路,29 种免疫刺激剂(CD27、CD28、CD40、CD48、CD70、CD80、CD86、CXCL12、CXCR4、ENTPD1、ICOS、IL2RA、IL6、KLRC1、KLRK1、LTA、MICB、NT5E、TMEM173、TNFRSF14、TNFRSF25、TNFRSF4、TNFRSF8、TNFRSF9、TNFSF14、TNFSF13B、TNFSF4、TNFSF9 和ULBP1)和17 种免疫抑制剂(ADORA2A、CD96、CD160、CD274、CSF1R、CTLA4、HAVCR2、IDO1、IL10、KDR、LAG3、PDCD1LG2、PVRL2、TGFB1、TGFBR1、TIGIT和VTCN1)与GC中的POSTN显著相关(图5A)。对上述差异表达基因进行GO注释(图5B)。KEGG 分析表明,细胞因子-细胞因子受体相互作用、产生IgA 的肠道免疫网络、细胞黏附分子、类风湿关节炎、自身免疫性甲状腺疾病、疟疾、移植物抗宿主病、同种异体移植排斥、1 型糖尿病、NF-κB信号通路、病毒性心肌炎、自然杀伤细胞介导的细胞毒性、系统性红斑狼疮、非洲锥虫病与POSTN介导的免疫事件相关(图5C)。

图4 POSTN表达与免疫细胞亚群的相关性Fig.4 Correlation of POSTN expression with immune cell subpopulations

图5 POSTN相关免疫调节剂鉴定与分析Fig.5 Identification and analysis of POSTN-related immunomodulators
2.4 风险评分模型构建、独立预后分析和生存分析 为探讨POSTN 相关免疫调节剂在GC 中的临床应用价值,将上述因素纳入单因素Cox分析,共鉴定出5 个预后基因:CSF1R、TGFB1、TGFBR1、CXCR4和NT5E(表1)。进一步采用多因素Cox分析筛选出2 个独立预后相关基因,即CXCR4 和NT5E,用其构建风险评分模型,风险值=(0.194 243 205 285 578×CXCR4)+(0.286 593 744 086 602×NT5E)。以风险评分中位值为截断值将患者分为高、低风险两组并绘制生存相关图形,Kaplan-Meier 分析显示,高风险组OS 较低风险组缩短(P=0.026,图6A)。GC 风险分数和生存状态分布及特征性基因表达谱见图7A。为进一步验证该模型独立性,单因素Cox 分析显示风险评分与生存显著相关(HR=2.470,95%CI=1.690~3.608,P<0.001,图7B)。多因素Cox 分析显示调整年龄、性别、分级和分期后,风险评分(HR=2.217,95%CI=1.472~3.341,P<0.001,图7C)可独立预测GC 预后。ROC 分析得出风险评分的AUC=0.696;结合风险评分和患者临床特征时,AUC=0.734(图6B)。

表1 POSTN相关免疫基因单因素和多因素Cox分析Tab.1 Univariate and multifactor Cox analysis of POSTNassociated immune genes
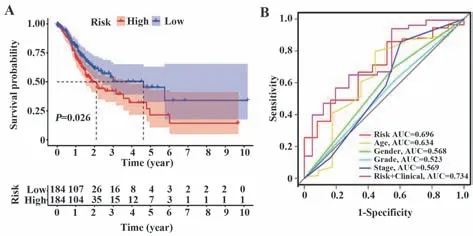
图6 GC生存分析及ROC曲线Fig.6 GC survival analysis and ROC curve

图7 构建GC患者预后相关免疫相关风险信号Fig.7 Immune-related risk signals associated with prognosis of GC patients
2.5 诺模图构建 基于TCGA-STAD 数据集通过权衡风险分数、年龄、分级、临床分期、T、N和M预测个体生存概率,采用Cox回归构建预测GC患者的预后诺模图(图8A)。计算每位患者各项特征得分,预测一年、三年和五年OS 概率,有助于个性化精确治疗。为验证该模型,计算该模型C-index并绘制校准曲线,该模型C-index 为0.70,证实该模型具有一致性。校准曲线显示,诺模图预测五年生存的概率(虚线)与实际生存的参考线(实线)很好地匹配(图8B)。

图8 GC附有校准曲线的诺模图Fig.8 Nomogram with calibration curve in GC
3 讨论
肿瘤微环境(tumor microenvironment,TME)是指与肿瘤发生、生长及转移密切相关的局部稳态环境,主要由肿瘤细胞、多种基质细胞、免疫细胞及细胞因子等组成,为细胞增殖和肿瘤转移创造了各种有利环境,同时也在诱导肿瘤细胞耐药方面发挥重要作用[16-17]。因此,研究GC 微环境及其潜在因素对临床过程的影响对不同亚型GC 转归具有重要意义。大量证据表明一些特定基因可用于癌症诊断和个性化治疗。本研究基于TCGA及GEO数据集分析发现POSTN 在GC 组织中的表达高于正常组织,与ZHONG 等[18]与LI 等[19]通过不同方法检测POSTN在GC 组织中的表达均高于正常胃组织的结果一致。本研究进一步结合临床生存预后分析发现:与POSTN 低表达患者相比,POSTN 高表达患者OS 更短,表明POSTN 高表达的GC 患者预后不良,且POSTN 影响GC 患者预后与TME 和免疫浸润有关,可能为GC免疫治疗提供新的靶点。
肿瘤免疫治疗发展改变了许多肿瘤的治疗方式,但并非所有患者都对免疫治疗有效果[20]。多种肿瘤中,肿瘤浸润细胞CD8+T 细胞数量与患者生存及对免疫治疗的反应相关[21-22]。基于TCGA数据集,本研究采用Cibersort 分析发现,与正常组织相比,GC 的22 个免疫亚群组成显著变化,提示免疫细胞侵袭方式与GC 预后有关。目前临床环境中很难捕捉到单个患者渗透免疫细胞的靶点。因此,发现新的标志物确定患者免疫状态非常重要。本研究分析POSTN 与GC 免疫细胞浸润的相关性,证实POSTN 与肿瘤免疫有关,并发现POSTN 水平与记忆B 细胞、幼稚B 细胞、浆细胞、CD8+T 细胞和调节性T细胞呈负相关;与γδT 细胞、嗜酸性粒细胞、活化肥大细胞、M0巨噬细胞、静止NK细胞、M2巨噬细胞水平和中性粒细胞呈正相关。此前,POSTN 在几种类型肿瘤中的功能已有报道。如POSTN 可通过ILK/AKT/mTOR 途径促进GC 细胞增殖和上皮-间充质转化[23]。YUE 等[24]发现TGF-β1 可诱导间质POSTN 促进卵巢癌细胞迁移和侵袭。一种新的治疗方法中,miR-599通过靶向下调POSTN 抑制胶质瘤细胞迁移和侵袭[25]。这些发现凸显了POSTN 在肿瘤进展中的致癌作用,但潜在机制仍不清楚。本研究鉴定出POSTN 相关的46 种免疫调节剂,对其进行GO 和KEGG 通路分析表明:细胞因子-细胞因子受体相互作用、产生IgA 的肠道免疫网络、细胞黏附分子、NF-κB 信号通路、自然杀伤细胞介导的细胞毒性等与POSTN 介导的免疫事件相关。已有研究证实其中2 个信号通路功能,NF-κB 可通过与其启动子结合直接诱导PD-L1 基因转录,也可通过间接途径对PD-L1 进行转录后调控[26]。细胞黏附分子在介导免疫细胞迁移到肿瘤部位并与恶性肿瘤相互作用过程中起重要作用[27]。其他信号通路功能尚待进一步证实。此外,本研究通过POSTN 相关免疫调节剂建立GC 免疫基因预后模型,发现由此产生的风险分数与GC 生存密切相关。表明风险评分可区分由一组特征基因差异表达定义的风险人群,可能加速开发出对癌症预后有良好验证作用的信号。
综上,本研究表明,POSTN 不仅是GC 预后不良的潜在生物标志物,且可能通过调节免疫细胞的肿瘤侵袭在POSTN 微环境中发挥重要作用,提示POSTN 可作为调节抗肿瘤免疫应答的治疗靶点。本研究也有一定局限性。首先,由于回溯性特征,研究可能导致选择偏差,未来可进行前瞻性研究以验证生物标志物在GC 个性化管理中的临床应用。其次,未进一步证实POSTN 在肿瘤中作用的相关通路。第三,POSTN 治疗肿瘤免疫的基础机制和免疫特征的预后价值应进一步研究。

