脑心肌炎病毒(EMCV)感染昆明小鼠模型的建立①
郑剑纲 郝至立 曹志刚 孙盼盼④ 孙 娜 李宏全
(山西农业大学动物医学学院,太谷 030801)
脑 心 肌 炎 病 毒(encephalomyocarditis virus,EMCV)属于小核糖核酸病毒科,心病毒属,病毒粒子外表呈光滑球形,无囊膜,为单股正链RNA 病毒[1-3]。EMCV 于1945 年在佛罗里达州迈阿密由HELWIG 和SCHMIDT 首次从一只突然死于肺水肿和心肌炎的雄性长臂猿中分离得到,将浮肿液注射小鼠体内后,出现后肢麻痹和心肌炎等症状,随后这种病原体被命名为EMCV[4]。1949 年后,EMCV感染发生于猕猴、狒狒、狗、老虎、猕猴、蝙蝠、猪和人等不同物种,且分布于世界各地[5-11]。EMCV 感染大多数物种后症状轻微,但可引起母猪繁殖障碍、仔猪急性心肌炎,诱发仔猪猝死等[12-16]。目前针对EMCV感染还没有特效药和商品化疫苗。
小鼠模型具有成本低、繁殖饲养快速方便、遗传背景明确等有利因素,使其成为药物临床前评价研究等最为重要的模式动物。EMCV 小鼠模型的建立既往研究鲜见报道,主要集中于EMCV 感染小鼠后临床症状和组织病理损伤的观察[17-21]。本研究拟建立EMCV 感染昆明小鼠模型,为后续EMCV 致病机制和药物开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物和病毒 6~8 周龄SPF 级昆明小鼠192 只雌雄各半(质量合格证号:110011210115 155452),购自北京维通利华实验动物科技有限公司[SCXK(京)2021-0006]。自由采食和饮水,所有动物实验符合山西农业大学动物委员会伦理要求(伦理审查号:SXAU-EAW-2021M01027)。EMCV NJ08 株由南京农业大学姜平教授惠赠,本实验室进行了扩增和保存。根据Reed-Muench法计算其毒力为108.5TCID50/ml[22]。
1.1.2 主要试剂 TRIzol(invitrogen,美国);2×SYBR Green qPCR Master Mix(Low ROX,Biotool,美国);反转录试剂盒(TaKaRa,中国);苏木素染色液、伊红染色液和中性树胶(Solarbio,中国)。
1.1.3 主要仪器 烘片机、全自动轮转切片机、荧光正置显微镜(型号:HI1220、型号:RM2255、型号:DM3000,德国Leica);生物组织包埋机(型号:KDBM,中国科迪);高速冷冻离心机、核酸蛋白浓度测定仪(型号:5418、型号:D30,德国Eppendorf);PCR仪(型号:TC-96,美国Bio-Rad);涡旋振荡仪(型号:GENIUS3,德国IKA);荧光定量PCR 仪(型号:7500,美国Applied Biosystems)。
1.2 方法
1.2.1 实验分组及给药 小鼠适应性饲养1周后,分为正常组和EMCV 高、中、低剂量感染组。EMCV高 剂 量 组 小 鼠 腹 腔 注 射0.2 ml 100 TCID50/20 g EMCV,中剂量组小鼠腹腔注射0.2 ml 10 TCID50/20 g EMCV,低剂量组小鼠腹腔注射0.2 ml 1 TCID50/20 g EMCV,空白组腹腔注射等体积的生理盐水。每天观察小鼠临床症状。于EMCV 感染5 d、7 d、9 d、11 d、13 d、15 d,每组随机选取8只,经摘取眼球采血,脱颈处死小鼠,收集不同脏器进行后续检测。
1.2.2 检测各组小鼠心脏、脑、脾脏和肝脏指数摘取心脏、脑、脾脏和肝脏后,用滤纸吸干残留血后,并依据下列公式计算脏器指数。脏器指数=脏器质量(mg)/小鼠质量(g)×10。
1.2.3 qRT-PCR 检测病毒载量和炎症因子 用TRIzol 法提取小鼠血液、心脏、脑、脾脏和肝的总RNA,用核酸蛋白浓度测定仪检测RNA 的浓度和纯度,按照TaKaRa 反转录试剂盒说明书将总RNA 反转录成cDNA。qRT-PCR 检测不同剂量EMCV 感染5 d、7 d、9 d、11 d、13 d、15 d 时血液、心脏、脑、脾脏和肝的病毒载量。使用本实验室保存的1.59×108Copies/µl EMCV 3D 重组质粒为模板,10 倍比稀释,加入3D基因正反向引物进行扩增。标准曲线由各稀释度模板的起始拷贝数及其对应的Ct值构成。依据标准曲线,检测每ml 样品中EMCV 3D 拷贝数。EMCV 3D基因引物序列为F:5'-TTAGGGCGGGTTTGTAT-3',R:5'-TTTGTTAGCGGGAGTTA-3'。相 对qRT-PCR 检测9 d 时心和脑IL-1β、IL-6 和TNF-α 的相对表达量。IL-1β F:5'-GCCACCTTTTGACAGTGATGAGA-3',R:5'-GACAGCCCAGGTCAAAGGTT-3';IL-6 F:5'-GTCCTTCCTACCCCAATTTCCA-3',R:5'-TAACGCACTAGGTTTGCCGA-3';TNF-α F:5'-GATCGGTCCCCTTTGGGATG-3',R:5'-GGTTTGCTACGCAGTGGGC-3';β-Actin F:5'-CTGAGCTGCGTTTTACACCC-3',R:5'-CGCCTTCACCGTTCCAGTTT-3'。
1.2.4 组织病理切片 取小鼠心尖和左脑,于10%甲醛溶液中固定24 h。经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片、烘片、脱蜡、苏木素-伊红染色和中性树胶封片后,镜检观察心脏和脑组织病理变化。
2 结果
2.1 临床症状观察 与空白组相比,昆明小鼠经腹腔接种0.2 ml 100 TCID50/20 g EMCV 后第3 d 开始出现精神沉郁、被毛粗乱等症状;感染5~11 d 不断有小鼠出现震颤、弓背及后肢瘫痪等症状,后肢瘫痪症状出现24~48 h 后小鼠出现死亡,至实验结束,高剂量组共出现死亡小鼠7 只。其他未出现症状的小鼠感染15 d 与空白组相比均未出现异常,但在组织中能检测到EMCV病毒的复制。中剂量和低剂量组小鼠直到第15天未出现异常症状。
2.2 不同剂量EMCV 在不同时间点对小鼠脏器指数的影响 由图1 可知,与空白组相比,高剂量EMCV 感染小鼠5 d 时,能显著提高心脏指数(P<0.05),极显著提高脾脏指数(P<0.01),对于脑和肝脏指数并无显著影响。在7 d、9 d、11 d、13 d 和15 d时,不同剂量的EMCV 感染对于小鼠的脏器指数无显著影响(P>0.05),表明在EMCV 感染小鼠前期造成心脏和脾脏肿大。
2.3 不同剂量EMCV 感染小鼠在不同时间点的病毒载量 利用qRT-PCR 检测不同剂量EMCV 感染的昆明小鼠5 d、7 d、9 d、11 d、13 d 和15 d 时,心脏、脑、肝脏、脾脏和外周血中EMCV 载量,结果见图2。高剂量EMCV 感染昆明小鼠,随着时间增加,在心脏、脑、肝脏、脾脏和外周血中EMCV载量逐渐增加,在9 d 时达到顶峰,然后随着时间增加病毒载量逐渐下降,其中脑组织的病毒载量最高。与高剂量组相比,中剂量和低剂量EMCV 感染小鼠不同时间点后,心脏、脑、肝脏、脾脏和外周血中EMCV 载量很低,且部分低剂量EMCV感染小鼠未能检测到EMCV的复制情况。
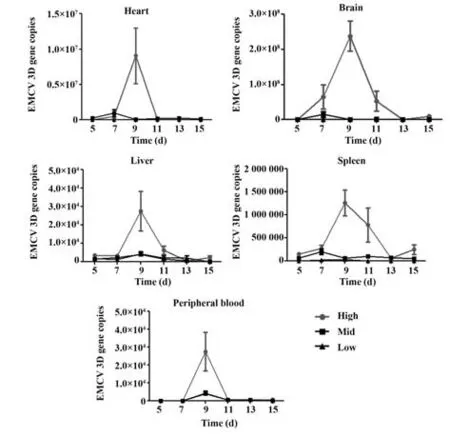
图2 qRT-PCR 检测不同剂量EMCV 感染5 d、7 d、9 d、11 d、13 d 和15 d 时心脏、脑、肝脏、脾脏和外周血中EMCV载量Fig.2 qRT-PCR was used to detect EMCV loads in different organs and peripheral blood infected with different doses of EMCV on 5 d, 7 d, 9 d, 11 d, 13 d and 15 d
2.4 不同剂量EMCV 感染小鼠9 d 时炎症因子mRNA表达 利用qRT-PCR检测不同剂量EMCV感染昆明小鼠9 d 时,心脏和脑中炎症因子IL-1β、IL-6和TNF-α mRNA 表达情况,结果见图3。与空白组相比,高剂量EMCV 感染9 d 时,能极显著提高心脏中IL-1β(P<0.01)、IL-6(P<0.001)和TNF-α(P<0.01) mRNA 表达,中剂量EMCV 感染9 d 时则显著提升心脏中IL-1β mRNA 表达(P<0.05)。与空白对照组相比,高剂量EMCV感染9 d时能极显著提高脑组织中IL-1β 和TNF-α mRNA 表达(P<0.001),显著增加IL-6 mRNA 表达(P<0.05)。中剂量EMCV 感染9 d 时能极显著提高脑组织中TNF-α mRNA 的表达 (P<0.01)。与空白组相比,低剂量EMCV 感染对心脏和脑组织中IL-1β、IL-6 和TNF-α mRNA 表达无显著影响(P>0.05)。
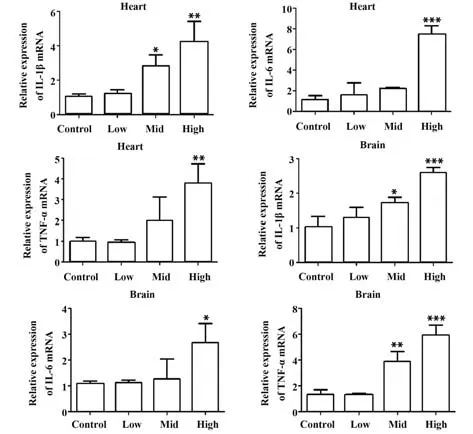
图3 qRT-PCR 检测不同剂量EMCV 感染9 d 时心脏和脑IL-1β、IL-6和TNF-α mRNA的相对表达量Fig.3 qRT-PCR detected relative expressions of IL-1β,IL-6 and TNF-α mRNA in heart and brain infected with different doses of EMCV for 9 d
2.5 小鼠心脏组织病理损伤情况 不同剂量EMCV 感染昆明小鼠5 d、7 d、9 d、11 d、13 d 和15 d时,对心脏组织进行HE 染色。由图4 可知,空白组心肌细胞纤维清晰可见,心肌纤维平行排列,且整齐均匀。胞浆染色均匀,细胞核呈椭圆形,位于细胞中部。与空白组相比,高剂量EMCV感染5 d时心脏组织炎症细胞增多;7 d时心脏组织有大面积炎症细胞浸润;9 d 时心肌细胞出现空泡状病变;11 d 时炎症细胞浸润减少,空泡状病变消失,心肌间隙增宽,后期回归正常。中剂量EMCV 仅在感染前期导致少量炎症细胞浸润和心肌间隙增宽。低剂量EMCV感染与空白组形态基本一致。

图4 不同剂量EMCV感染5 d、7 d、9 d、11 d、13 d和15 d时心脏组织病理学切片(HE染色,×200)Fig.4 Histopathological sections of heart tissue infected with different doses of EMCV on 5 d,7 d,9 d,11 d,13 d and 15 d (HE staining, ×200)
2.6 小鼠脑组织病理损伤情况 空白组大脑脑膜正常,皮质结构清晰,白质无炎症细胞浸润。与空白组相比,高剂量EMCV 感染5 d 时,脑膜下血管扩张,7 d 和9 d 时脑膜增厚,膜下出血,后期脑膜恢复正常,膜下出血逐渐吸收;中剂量EMCV感染7 d时,脑膜增厚和脑水肿,9 d 时白质有出血点,中剂量感染其他时间点和低剂量感染与空白组形态基本一致(图5)。与空白组相比,高剂量EMCV 感染5 d时,脑白质出现炎症细胞浸润,7 d 和9 d 时,白质内血管高度扩张,炎症细胞浸润,形成血管套,后期逐渐恢复正常;中剂量EMCV感染前期,出现轻微的炎症细胞浸润和血管扩张,后期逐渐恢复正常。低剂量感染与空白组形态基本一致(图6)。

图5 不同剂量EMCV感染5 d、7 d、9 d、11 d、13 d和15 d时脑皮质和脑膜组织病理学切片(HE染色,×200)Fig.5 Histopathological sections of cerebral cortex and meninges infected with different doses of EMCV on 5 d, 7 d, 9 d, 11 d, 13 d and 15 d (HE staining, ×200)
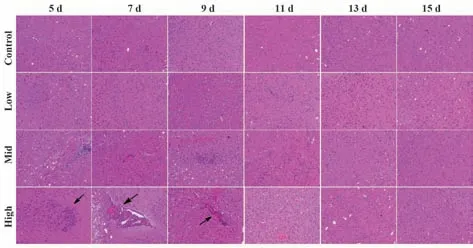
图6 不同剂量EMCV感染5 d、7 d、9 d、11 d、13 d和15 d时脑白质组织病理学切片(HE染色,×200)Fig.6 Histopathological sections of cerebral white matter infected with different doses of EMCV on 5 d, 7 d,9 d, 11 d, 13 d and 15 d (HE staining, ×200)
3 讨论
目前,大量研究集中于EMCV 感染小鼠临床症状的观察,而系统建立EMCV 感染昆明小鼠模型鲜见报道,这在一定程度上限制了抗EMCV 临床药物的开发。本实验室前期研究发现莪术醇体外能够显著抑制EMCV 的复制,为了验证其体内抗病毒活性,首先需建立EMCV感染昆明小鼠模型[23]。EMCV感染昆明小鼠模型的建立为抗EMCV药物的开发奠定了基础。
首先采用100 TCID50/20 g的EMCV感染小鼠5 d时,能够显著提高心脏和脾脏指数。施开创等[19]使用103.67TCID50的EMCV GXLC 株腹腔注射小鼠,结果发现心脏重量与体质量的比值在3~14 d 都会保持明显升高。本实验仅在感染5 d 时显著升高,这可能取决于选取相对较低的剂量和不同的毒株。EMCV 感染首先在位于扁桃体的巨噬细胞复制,然后随着游走的巨噬细胞遍布全身[24]。脾脏红髓中存在大量平滑肌细胞和纤维,外周围绕脾索巨噬细胞,EMCV 在巨噬细胞中复制后,造成该类细胞脱离消失,而平滑肌细胞直接与血液中的凝血因子接触,使血小板激活聚集,激发凝血系统,使红细胞在脾脏中聚集,充血肿大。
本实验中,采用100 TCID50/20 g EMCV 感染昆明小鼠,随着时间增加,心脏、脑和脾脏中的EMCV载量逐渐增加,在9 d 时达到顶峰,然后随着时间增加病毒载量逐渐下降。殷雪婷[21]研究发现EMCV HLJ感染小鼠后,在组织器官中广泛分布,各器官都能检测到病毒的存在,其中心和脑病毒载量最高。本实验结果表明,100 TCID50/20 g的EMCV感染可以导致病毒在小鼠体内大量复制。
心脏和脑是EMCV 感染的靶器官,可以导致心肌炎和脑炎,最终导致心力衰竭和瘫痪。炎症因子被认为在心脏衰竭的发病过程中具有非常重要的作用,IL-1β 降低心脏收缩力,IL-6 导致负性肌力,TNF-α引起心肌收缩障碍、心肌炎、心室扩张和心脏发育不全[25-27]。研究表明,致心肌炎型EMCV-M 感染小鼠后,心肌中IL-1β、TNF-α 表达与心肌病变程度 呈 正 相 关[19]。施 开 创 等[19]研 究 还 表 明EMCV GXLC 感染小鼠后,脑组织中IL-1β、IL-6 和TNF-α mRNA 表达显著上升。本研究结果显示,与空白对照组相比,100 TCID50/20 g EMCV感染9 d时,能极显著提升心脏和脑组织中IL-1β、IL-6 和TNF-α mRNA表达,表明100 TCID50/20 g EMCV 感染小鼠造成了靶器官心和脑的炎症反应。
EMCV 感染小鼠诱发的心肌炎特点为心肌坏死和炎症细胞浸润,并且导致心力衰竭和扩张型心肌病[28]。研究发现EMCV复制主要位于大脑海马体和小脑颗粒层的小区域坏死性病灶内[29]。从胸椎到腰椎脊髓,控制骨骼肌活动和张力的运动神经元也会受到影响,从而导致瘫痪[30]。病理学组织切片结果显示,100 TCID50/20 g EMCV感染能够引起小鼠心脏组织大面积炎症细胞浸润和空泡化病变。也引起脑组织脑膜下血管扩张、脑膜增厚、膜下出血、脑白质炎症细胞浸润和形成血管套的病理变化。结果表明100 TCID50/20 g EMCV 感染小鼠造成了靶器官心和脑的病理损伤。
综 上 所 述,腹 腔 注 射0.2 ml 100 TCID50/20 g EMCV 可引起小鼠发病,成功建立了EMCV 感染昆明小鼠模型。本实验通过测定不同时间点EMCV感染小鼠的不同脏器中病毒RNA,并观察了心和脑组织病理学改变,了解EMCV进入小鼠引起的变化。

