基因片段Myo5a原核表达、纯化及多克隆抗体制备①
游荷花 唐锐敏 (山西医科大学汾阳学院免疫学与免疫学检验教研室,汾阳 032200)
Myosin 是肌球蛋白,又称肌凝蛋白,是真核细胞里的一类ATP依赖型分子马达[1]。Myosin于1864年由KUEHNE 在对肌肉的运动进行探讨时发现的,以肌动蛋白丝作为运转的轨道,经过水解ATP 造成了构型的改变而在肌动蛋白丝上移行。最初研究以为其是存在于平滑肌和横纹肌中的ATP 酶,之后陆续发现许多真核细胞也存在同源蛋白基因,证实这种蛋白的用处不局限于肌肉细胞。Myosin 可以进行的细胞活动包括:肌肉运动、趋化作用、细胞分裂、胞饮作用、靶向小泡运输和信号转导等,是生物体内重要的蛋白质成员。据发现时间的先后命名肌球蛋白,目前已发现30 多种,分为传统的和非传统的[2]。
Myo5 也称为Myosin5 或MyoⅤ,在细胞中物质运输中有重要的作用。MyosinⅤa(Myo5a)是MyosinⅤ家族中的一分子,是一种“摩托蛋白”,主要负责转运细胞内物质[3]。近十几年不断有研究发现Myo5a与某些肿瘤的发生发展关系密切。为进一步探究Myo5a 可能与某些肿瘤发展的关系,本实验拟制备Myo5a 片段的原核表达质粒PGEX-4T-3/Myo5a,使其表达并纯化该蛋白质,制备其抗血清,为后续探讨Myo5a与肿瘤的关系作铺垫。
1 材料与方法
1.1 材料 Myo5a PCR 模板、原核载体、ELISA 反应板、实验动物、佐剂以及E.coliDH5α和BL21均由实验室提供;DNA 限制性核酸内切酶BamHⅠ和XhoⅠ、T4DNA连接酶、DNA聚合酶等均购于TaKaRa公司;镍亲和层析柱购自Bio-Rad 公司;低分子量蛋白标准Marker 和DNA Marker 等购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 Myo5a 目的基因的获取 按照人Myo5a 基因序列,设计一对引物来扩增Myo5a 羧基末端的近100 bp 大小的基因小片段,命名为Myo5a-D1[BamHⅠF(5'~3'):CG/GGATCC/ATGAATAGTGGGGCTAAAG;XhoⅠR(5'~3'):CCC/CTCGAG/AGAACAAATGGCTTCTGCATC,长度111 bp]。BamHⅠ是正向引物的酶切位点,XhoⅠ是反向引物的酶切位点。扩增条件如下:95 ℃ 预变性2 min;95 ℃变性15 s、54 ℃退火30 s、72 ℃延伸45 s,共30 个循环;最后4 ℃保温。扩增完毕,进行琼脂糖电泳鉴定。采用RCR纯化试剂盒纯化基因小片段。
1.2.2 PGEX-4T-3/Myo5a 重组质粒的构建及鉴定 原核表达载体PGEX-4T-3 的基因片段经BamHⅠ/XhoⅠ双酶切反应(37 ℃、CO2孵箱过夜),用DNA回收试剂盒回收所需DNA。将原核表达载体PGEX-4T-3 与Myo5a-D1 连接, EP 管中加入1.5 µl PGEX-4T-3 质粒、0.3 µl D1、0.4 µl T4DNA 连接酶、1 µl缓冲液后补加去离子水(DI H2O)使连接体系为10 µl,4 ℃冰箱过夜。连接产物转化到大肠杆菌的DH5α 感受态细胞,37 ℃培养,筛选重组子。经双酶切鉴定和测序,获得重组质粒PGEX-4T-3/Myo5a-D1。
1.2.3 重组PGEX-4T-3/Myo5a 的诱导表达 4 µl PGEX-4T-3(对 照)、8 µl 重 组 质 粒PGEX-4T-3/Myo5a-D1转化入大肠杆菌BL21。置于冰中30 min,42 ℃热击40 s,再冰镇1~2 min。经复苏后,取适量涂布于含有Amp 的LB 盘中,37 ℃孵箱放置12~16 h后,可见菌落长出。挑取阳性克隆菌落,接于2 ml含有Amp 的LB 培养基中(两个培养皿依次挑取)。37 ℃摇床振荡3~4 h,至OD 值为0.6。各取0.5 ml菌液作为诱导前的对照。剩余菌液均加15 µl IPTG,37 ℃摇床中培养至终浓度为1 mmol/L(2~3 h)。培养结束后,1.5 ml 菌液均分成3 份。其中0.5 ml 菌液保种储存;0.5 ml 菌液为诱导后的总菌液,离心,收集沉淀加50 µl PBS重悬菌液;最终0.5 ml菌液,离心,收集沉淀后加250 µl的PBS重悬菌液,超声裂解细菌细胞,离心后分别得到细菌沉淀和裂解上清,去离子水溶解沉淀。最终得到质粒包含诱导前总菌液、诱导后总菌液、裂解上清、细菌沉淀共4 个样品。利用聚丙烯酰胺凝胶电泳检测蛋白的表达。
1.2.4 大量表达重组PGEX-4T-3/Myo5a 蛋白 LB培养基(含Amp)中接种1 个BL21 转化成功的阳性克隆,37 ℃ 过夜培养,第2天再加入300 ml LB,继续摇菌至OD 值约为0.6。按1∶100 的比例加入IPTG培养至终浓度为1 mol/L。4 ℃离心2 次,弃上清。10 ml的去离子水重悬菌液,分装10管,-20 ℃储存。
1.2.5 采用镍亲和层析柱提纯蛋白,Western blot检测纯化蛋白 取1 ml 菌体,加29 ml 去离子水,50 µl PMSF 和1% Triton。超声裂解细胞,4 ℃离心,得到裂解上清,滤纸过滤。层析柱中加0.5 ml 50%谷胱甘肽琼脂糖,样品过柱(前后均用5×柱体积的PBS 洗层析柱)。采用3×柱体积的洗脱液洗脱蛋白,得到提纯的融合蛋白。收集蛋白0.5 ml/管,-80 ℃储存。其中20 µl 样品SDS-PAGE 电泳鉴定。PGEX-4T-3/Myo5a-D1 得到了大量提纯的蛋白,采用Western blot 检测提纯的蛋白,并用SDS-PAGE 电泳纯化后的融合蛋白和阴性对照,在80 V 恒压状态下转膜2 h。4 ℃过夜后在NC 膜条中加入一抗,4 ℃过夜,TBST 洗涤5 次。加二抗孵育,洗膜。最后显色记录结果。
1.2.6 制备兔抗人抗血清,并对其进行滴度测定查阅文献[4],采用PGEX-4T-3/Myo5a-D1 融合蛋白为免疫原,免疫动物选适龄,健康的家兔。初次注射免疫原剂量为200 µg,佐剂用完全弗氏佐剂,佐剂与免疫原按1∶1 体积比混匀,于家兔皮下注射。注射3 周后,再次注射进行加强免疫, 家兔皮下均用100 µg PGEX-4T-3/Myo5a-D1 融合蛋白,与等体积的不完全弗氏佐剂混匀后注射。之后每隔2~3周进行加强免疫1 次,总共注射4 次。在最后一次注射后第6 天进行静脉采血,ELISA 法测血清抗体滴度。酶标板先用PGEX-4T-3/Myo5a-D1 融合蛋白(10 µg/ml,100 µl/孔)4 ℃过夜包被,后用10%牛血清白蛋白37 ℃进行封闭2 h,之后洗板5次。加入梯度稀释的家兔抗血清(100 µl/孔),恒温孵箱37 ℃放置1 h,阴性对照用家兔未免疫时的血清。后加入HRP-羊抗兔IgG 后,恒温孵箱37 ℃放置1 h。加入显色底物TMB 恒温孵箱37 ℃放置0.5 h 后加中止液。酶标仪检测波长450 nm 处OD 值,判定抗血清效价(Cut off 值为阴性孔OD450值×2.1,大于此值的抗血清最大稀释度为其效价)。
1.2.7 抗血清特异性鉴定 Western blot 检测:将纯化的PGEX-4T-3/Myo5a-D1 蛋白经SDS-PAGE 电泳,后转移至NC 滤膜上。制备的兔抗血清与膜4 ℃孵育过夜,加二抗,孵育,洗涤,显色并记录结果。免疫荧光法检测:脑神经细胞(因富含Myo5a 蛋白)作为基质细胞切片,加制备的兔抗血清于4 ℃,过夜,阴性对照还是用兔未免疫时的血清,加二抗,37 ℃孵育0.5 h后洗涤5次,最后荧光显微镜下观察发射荧光情况。
2 结果
2.1 扩增了基因小片段My05a-D1 以人类Myo5a基因为模板,利用引物,成功扩增了基因小片段Myo5a-D1,PCR结果见图1。

图1 Myo5a-D1小片段的琼脂糖凝胶电泳图Fig.1 Agarosegel electrophoresis of small fragment of Myo5a-D1
2.2 PGEX-4T-3/Myo5a 重组质粒构建及鉴定 将在抗性平板上生长的菌落随机挑取进行摇菌培养,提取重组质粒进行PCR 鉴定,均含目的条带。质粒DNA 双酶切鉴定结果见图2。将鉴定正确的重组质粒进行测序,测序结果符合预期。

图2 PGEX-4T-3/Myo5a-D1重组质粒的酶切鉴定Fig.2 Enzymatic digestion of PGEX-4T-3/Myo5a-D1 recombinant plasmid
2.3 融合蛋白诱导表达 选重组质粒PGEX-4T-3/Myo5a-D1 与 空 载 体PGEX-4T-3 进 行IPTG 诱 导 表达,聚丙烯酰胺凝胶电泳检测蛋白表达(图3)。PGEX-4T-3/Myo5a-D1 经诱导后在裂解上清、沉淀、诱导后的总菌液中均产生分子质量约30 kD 的大量蛋白。与对照质粒PGEX-4T-3 表达的GST 蛋白(分子质量为29 kD)略高。表明融合蛋白诱导表达成功。
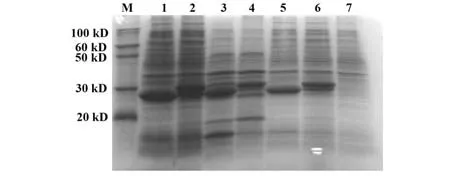
图3 PGEX-4T-3/Myo5a-D1的原核表达产物的电泳鉴定Fig.3 Electrophoretic identification of prokaryotic expression product of pGEX-4T-3/Myo5a-D1
2.4 融和蛋白的纯化鉴定 将裂解后上清采用镍亲和层析柱纯化,结果见图4,PGEX-4T-3/Myo5a-D1得到大量纯化的蛋白。对PGEX-4T-3/Myo5a-D1 进行Western blot 鉴定,见图5。显色条带大小约为30 kD,符合预期,表明目的蛋白表达成功。

图4 蛋白纯化的电泳鉴定Fig.4 Electrophoretic identification of protein purification

图5 纯化蛋白的免疫印迹鉴定Fig.5 Western blot identification of purified protein
2.5 多克隆抗体鉴定 包括滴度和特异性的测定。PGEX-4T-3/Myo5a-D1 融合蛋白包被酶标板,ELISA 间接法检测制备的兔抗人PGEX-4T-3/Myo5a-D1抗血清滴度为1∶128 000。将兔抗人PGEX-4T-3/Myo5a-D1抗血清(1∶100 00)作为一抗,与PGEX-4T-3/Myo5a-D1融合蛋白反应,以Western blot 实验检测其抗原特异性,见图6。结果表明,在分子量30 kD左右显现特异条带,说明兔抗人PGEX-4T-3/Myo5a-D1 多克隆抗体具有良好的抗原特异性。脑组织细胞因富含Myo5a 在荧光显微镜下出现绿色荧光,阴性对照无荧光(图7)。证明制备的抗血清与天然的Myo5a蛋白发生特异性反应。

图6 Western blot检测兔抗血清Fig.6 Western blot detection of rabbit antiserum

图7 免疫荧光染色Fig.7 Immunofluorescence staining
3 讨论
目前发现Myosin 中的很多类型都和各型肿瘤发生及发展关系密切。可能原因是传统的Myosin的主要功能是参与肌肉收缩,而非传统的Myosin 是细胞骨架的组成,为细胞质流动、物质运输、有丝分裂、胞质裂解等提供所需的能源[5]。癌症主要生物学特征是癌细胞转移,癌细胞转移涉及过程极其复杂,但有研究认为癌细胞转移运动需要细胞骨架提供支撑与动力[6]。目前研究比较多的是非传统的Myosin2、Myosin9 和Myosin10 等。研究显示非传统的Myosin2 与消化道肿瘤、乳腺癌、膀胱癌、肺癌等肿瘤有紧密的关系,也有研究表明适当的T 细胞反应和T细胞特异性抗原受体相互作用的强度与细胞骨架重组有关,丝状肌动蛋白和非肌肉肌球蛋白Ⅱ(NMMⅡ)起主要作用[7-8]。Myosin9是近年新发现的癌细胞转移相关蛋白,研究显示,Myosin9 可促使胃癌细胞向腹膜转移[9]。同时Myosin10可导致多种疾病,包括恶性肿瘤和病原微生物感染。与正常结直肠组织相比,结直肠癌组织中Myosin10 表达会明显升高,推测Myosin10 可能与结直肠癌的发生发展关系密切[10]。除结直肠癌外,也有研究报道Myosin10在乳腺癌和非小细胞肺癌等几种侵袭性恶性肿瘤中高表达[11]。此外,乳腺癌患者的预后不良也与高水平的Myosin10 有关。而关于Myosin5 近十几年也陆续发现其与某些肿瘤的发生发展关系密切,因此本研究选择Myosin5作为切入点。
Myosin5 是迄今为止在细胞功能、酶性质和调控方面最具特色的非传统肌球蛋白。脊椎动物有3 个Myosin5 基 因,分 别 编 码Myo5a、Myo5b 和Myo5c[12]。Myosin5 参与了许多膜质载体:如分泌囊泡、液泡、黑素体、色素颗粒、循环核内体等和mRNA的运输[13]。因此脊椎动物Myo5a的调控也已经受到了广泛的关注。文献显示Myo5a高表达与肿瘤浸润深度显著相关。有文献报道食管鳞状细胞癌患者中Myo5a表达水平可用于预测肿瘤的侵袭性及预测患者的临床生存期,可用于指导临床诊疗方案和评估疗效,此外,Myo5a在其他许多恶性肿瘤中高表达并与癌细胞侵袭相关,例如胰岛细胞瘤、乳腺癌、结肠癌、肺癌、前列腺癌和恶性黑素瘤等[14-15]。因此,近年来对Myo5a 的运动和循环都进行了较深入的探讨。
本文采用PCR扩增了Myo5a末端特异性片段的蛋白编码序列,用BamHⅠ和XhoⅠ双酶切,用原核表达载体pGEX-4T-3 将片段插入,构建了重组质粒PGEX-4T-3/Myo5a-D1。原核重组质粒PGEX-4T-3/Myo5a-D1 经测序等证实构建成功。而后将重组质粒依次转化至大肠杆菌BL21 感受态细胞,经IPTG诱导重组蛋白表达,后制备了一个小片段的多克隆抗体。因国外有文献报道,许多外源蛋白在BL21中表达时,以一种不溶性的沉淀即包涵体形式存在,这样不利于外源蛋白施展生物学活性。所以本研究分别对菌体沉淀和裂解液中的蛋白质进行SDSPAGE 电泳,最后选取在裂解细菌后的上清中能找到目的蛋白的质粒,这样的质粒才具有可溶的生物学活性。同时电泳显示蛋白相对分子量约为30 kD,与预期相符。Western blot 也同时证实该蛋白具有免疫反应特异性。因此最终经过亲和层析柱对蛋白进行了纯化,得到了PGEX-4T-3/Myo5a-D1融合蛋白的纯品制备多克隆抗体,为后续进一步研究Myo5a 与其他肿瘤的作用提供了铺垫,从而能够继续探讨Myo5a在癌细胞转移中的作用。

