不同免疫状态侵袭性肺曲霉菌病患者实验室指标分析①
林亚纳 张小菲 洪亚妮 黄星花 郭瑞瑞 (树兰(杭州)医院,杭州 310004)
曲霉菌是一种广泛存在于自然界的丝状真菌,属于条件致病菌,其代谢需求较简单,对环境变化的承受能力较强,烟曲霉在曲霉菌中致病力最强,可寄生于上呼吸道、肺部等,机体处于免疫功能正常状态时,曲霉菌入侵后,黏膜纤毛或先天免疫机制可清除杀灭孢子,通常不会被感染,然而当宿主机体免疫力低下或合并全身性疾病时极易感染曲霉菌[1-2]。肺曲霉菌病是因曲霉菌侵袭肺部所致的感染性疾病,因早期症状不明显,出现症状时已经发展为较严重的侵袭性肺曲霉菌病[3]。侵袭性肺曲霉菌病的临床病死率高达56%~88%,特别是恶性肿瘤、中性粒细胞减少、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、器官移植、长期使用免疫抑制剂、糖皮质激素等免疫力低下的患者,随着研究的深入,发现即使免疫轻度损伤或免疫功能正常者也会发生侵袭性肺曲霉菌病,且呈逐年升高趋势,多数患者预后不良[4-5]。研究显示,当曲霉菌入侵后,不同免疫状态患者临床表现不同,机体免疫状态与侵袭性肺曲霉菌病的进展密切相关[6]。目前有关不同免疫状态下侵袭性肺曲霉菌病患者预后状况的研究较少,本研究以侵袭性肺曲霉菌病患者为研究对象,分析不同免疫状态下患者实验室指标表达情况,为临床侵袭性肺曲霉菌病的研究提供参考。
1 资料与方法
1.1 资料 选取2020 年1 月至2022 年12 月树兰(杭州)医院呼吸与危重症医学科病房收治的44例侵袭性肺曲霉菌病患者作为研究对象,男35 例,女9 例,年龄26~87 岁,平均年龄69.27 岁,致病菌:烟曲霉30例,黄曲霉4例,土曲霉菌2例,黑曲霉菌3例,杂色曲霉菌1 例,曲霉菌属4 例。诊断标准:所有患者均符合侵袭性肺曲霉菌病的诊断标准,至少经镜检/肺泡灌洗液/痰液/半乳甘露聚糖(galactomannan,GM)试验提示曲霉菌感染[7-8]。纳入标准:①符合诊断标准,年龄≥18 岁;②影像学提示患者气道及肺部多发斑片影或树芽征等曲霉菌感染征象;③未使用半合成青霉素等抗感染药物治疗;④均规范抗真菌治疗,且定期复查随访(包括死亡)至12 周;⑤患者及家属对本次研究均知情,并签署知情同意书,且经过树兰(杭州)医院伦理委员会批准。排除标准:①临床资料不全者;②病情急剧恶化,无法控制者;③既往肺部真菌感染者或合并其他部位真菌感染者;④精神障碍者。
1.2 方法
1.2.1 研究分组 依据文献[9]评估患者基础免疫状况,根据患者基础免疫状况分为免疫低下组27 例、免疫正常组17 例。免疫力低下标准:①HIV感染/艾滋病(AIDS)者;②器官移植者;③终末期肾病者;④糖尿病者;⑤长期使用糖皮质激素者,特别是入院前2周内使用糖皮质激素冲击治疗或强的松持续2 周使用剂量≥20 mg/d 者;⑥中性粒细胞减少者;⑦原发性免疫缺陷病者;⑧恶性肿瘤,且接受正规化疗者;⑨血液系统恶性肿瘤者;⑩免疫风湿性疾病者。
1.2.2 资料收集 收集所有患者以下资料:①实验 室 指 标:白 细 胞 计 数(white blood cell count,WBC)、中性粒细胞计数(neutrophil count,NT)、血小板计数(platelet count,PLT)、IFN-γ、IL-6、IL-10、C 反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、免疫因子(CD3+T 细胞、CD4+T 细胞、CD8+T 细胞、CD4+/CD8+)、GM、(1,3)-β-D-葡聚糖[(1,3)-beta-d-glucan,BG]等;②病原学结果:烟曲霉、黄曲霉、土曲霉菌、黑曲霉菌、杂色曲霉菌等曲霉菌属。
1.3 统计学分析 采用SPSS22.0统计软件对数据进行分析处理。应用Kolmogorov-Smirnov 检验数据是否符合正态分布,符合正态分布的计量资料采用±s描述,组间比较采用独立样本t检验。计数资料采用频数和百分比表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 不同免疫状态侵袭性肺曲霉菌病患者一般资料比较 免疫正常组和免疫低下组患者在性别、年龄、体重指数、吸烟史、饮酒史、基础疾病等基础资料中比较,差异无统计学意义(P>0.05);免疫正常组、免疫低下组患者在临床症状、临床体征等资料中比较,差异有统计学意义(P<0.05),免疫低下组临床症状主要表现为咳嗽、发热、呼吸困难,临床体征主要表现为湿啰音。见表1。
2.2 不同免疫状态侵袭性肺曲霉菌病患者WBC、NT、PLT 计数比较 免疫正常组和免疫低下组患者WBC、NT、PLT 计数比较差异无统计学意义(P>0.05)。见表2。
表2 不同免疫状态侵袭性肺曲霉菌病患者WBC、NT、PLT计数比较(±s)Tab.2 Comparison of WBC, NT and PLT counts in patients with invasive pulmonary Aspergillus with different immune states (±s)
Groups Immunonormal Immunocompromised n 17 27 t P WBC/(×109 L-1)8.12±1.43 8.23±1.08 0.290 0.773 NT/(×109 L-1)5.34±0.54 5.58±0.36 1.772 0.144 PLT/(×109 L-1)284.43±14.53 285.11±15.67 0.084 0.886
2.3 不同免疫状态侵袭性肺曲霉菌病患者CRP、PCT、GM、BG 水平比较 与免疫正常组比较,免疫低下组CRP、PCT、GM、BG 升高,差异有统计学意义(P<0.05)。见表3。
表3 不同免疫状态侵袭性肺曲霉菌病患者CRP、PCT、GM、BG水平比较(±s)Tab.3 Comparison of CRP, PCT, GM and BG levels in patients with invasive pulmonary Aspergillus with different immune states (±s)

表3 不同免疫状态侵袭性肺曲霉菌病患者CRP、PCT、GM、BG水平比较(±s)Tab.3 Comparison of CRP, PCT, GM and BG levels in patients with invasive pulmonary Aspergillus with different immune states (±s)
Groups Immunonormal Immunocompromised n 17 27 t P CRP/(mg·L-1)6.89±1.23 10.23±3.42 3.858<0.001 PCT/(µg·L-1)11.97±2.47 16.09±2.33 5.581<0.001 GM/(µg·L-1)0.65±0.11 1.03±0.24 6.116<0.001 BG/(pg·ml-1)40.98±6.75 128.98±15.43 22.140<0.001
2.4 不同免疫状态侵袭性肺曲霉菌病患者T 淋巴细胞亚群指标水平比较 与免疫正常组比较,免疫低下组CD3+T 细胞、CD4+T 细胞、CD4+/CD8+降低,CD8+T 细胞升高,差异有统计学意义(P<0.05)。见表4。
表4 不同免疫状态侵袭性肺曲霉菌病患者T淋巴细胞亚群指标水平比较(±s)Tab.4 Comparison of T lymphocyte subsets in patients with invasive pulmonary Aspergillus with different immune states(±s)

表4 不同免疫状态侵袭性肺曲霉菌病患者T淋巴细胞亚群指标水平比较(±s)Tab.4 Comparison of T lymphocyte subsets in patients with invasive pulmonary Aspergillus with different immune states(±s)
Groups Immunonormal Immunocompromised n 17 27 tP CD3+T cells/(PCS·µl-1)856.64±98.09 399.98±42.32 21.350<0.001 CD4+T cells/(PCS·µl-1)768.99±75.64 66.75±7.89 48.160<0.001 CD8+T cells/(PCS·µl-1)324.54±35.64 536.74±50.96 14.990<0.001 CD4+/CD8+1.78±0.34 0.17±0.04 24.510<0.001
2.5 不同免疫状态侵袭性肺曲霉菌病患者IFN-γ、IL-6、IL-10 水平比较 与免疫正常组比较,免疫低下组IFN-γ、IL-6、IL-10 水平升高,差异有统计学意义(P<0.05)。见表5。
表5 不同免疫状态侵袭性肺曲霉菌病患者IFN-γ、IL-6、IL-10水平比较(±s)Tab.5 Comparison of IFN-γ, IL-6 and IL-10 levels in patients with invasive pulmonary Aspergillus with different immune states (±s)

表5 不同免疫状态侵袭性肺曲霉菌病患者IFN-γ、IL-6、IL-10水平比较(±s)Tab.5 Comparison of IFN-γ, IL-6 and IL-10 levels in patients with invasive pulmonary Aspergillus with different immune states (±s)
Groups Immunonormal Immunocompromised n 17 27 tP IFN-γ/(ng·L-1)20.32±2.14 35.87±6.98 69.970<0.001 IL-6/(ng·L-1)26.53±4.53 50.12±7.96 11.110<0.001 IL-10/(ng·L-1)23.42±5.67 45.64±5.53 12.850<0.001
2.6 不同免疫状态侵袭性肺曲霉菌病患者病原学结果比较 免疫正常组、免疫低下组患者病原学结果比较差异无统计学意义(P>0.05)。见表6。
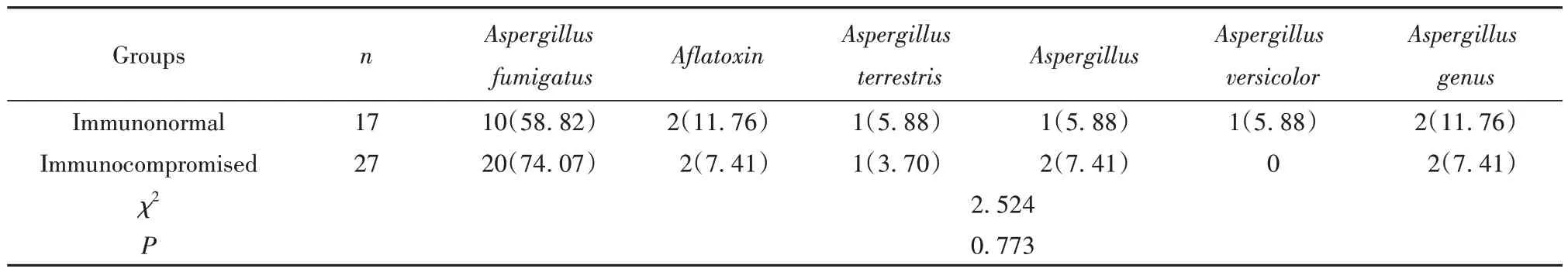
表6 不同免疫状态侵袭性肺曲霉菌病患者病原学结果比较[例(%)]Tab.6 Comparison of etiological results of patients with invasive pulmonary Aspergillus with different immune states [n(%)]
3 讨论
侵袭性肺曲霉菌病是近年来发病率显著升高的真菌感染性疾病,包括原发性和继发性。原发性主要发生于基础免疫正常人群,此类人群在工作时可能吸入过量的曲霉菌孢子,在孢子大量形成,超过机体防御能力时发病[10-12]。而继发性好发于恶性肿瘤、器官移植、HIV感染等患者,相较于原发性,继发性患者病情发展较快,症状更严重[13]。刘晓慧等[14]报道,免疫正常和免疫低下患者临床症状/体征存在明显差异,基础免疫低下的患者临床表现为咳嗽、发热、呼吸困难,临床体征表现为湿啰音,此结果可能是由于曲霉菌侵袭肺部时,机体可通过自身屏障清除,免疫低下患者自身防御功能损伤,曲霉菌大量繁殖,加重病情,进而表现为更加严重的咳嗽、发热等症状。流行病学调查显示,世界范围内每年约有1 100 万人感染曲霉菌,病死率高达45%~95%,死于侵袭性肺曲霉菌病的患者多达55 万,侵袭性肺曲霉菌病的发生严重影响患者的生存质量[15]。因此分析患者临床特征和预后状况对降低死亡风险具有重要意义。本研究以侵袭性肺曲霉菌病患者为研究对象,分析不同免疫状态患者实验室指标表达状况,以全面了解机体免疫状态对侵袭性肺曲霉菌病患者的影响,以期改善患者预后,降低病死率。
CRP 在机体受到感染时在血清中的含量急剧上升,PCT水平升高程度与机体感染程度呈正相关,均属于较为常见的炎性介质,在机体受到寄生虫感染、病毒感染、细菌感染时期含量升高[16]。研究认为,肺部受到感染后,会产生脂多糖、内毒素等有毒物质,经多种途径诱导炎症介质释放,在炎症介质的作用下,CRP、PCT 过量分泌,加速疾病进展[17]。本研究发现,与免疫正常组比较,免疫低下组CRP、PCT 升高,提示不同免疫状态下侵袭性肺曲霉菌病机体炎症程度不同,免疫低下患者局部炎症级联。
GM、BG 均属于附着于真菌细胞壁上的多糖抗原成分,有报道发现,β(1-5)呋喃半乳糖残基是曲霉菌特有的细胞壁多糖成分,在曲霉菌生长时,GM 从薄弱的菌丝顶端释放,在侵袭肺组织后,曲霉菌大量释放GM,在释放GM 的同时会激活机体免疫系统,GM 释放量与曲霉菌量成正比,与侵袭性肺曲霉菌病感染程度密切相关[18-19]。另有研究显示,BG 广泛存在于包括曲霉菌在内的多种真菌细胞壁中,曲霉菌菌丝生长和侵袭人体组织后,在吞噬细胞吞噬、消化处理后,BG 从细胞壁中释放,导致BG 在血液和体液中含量升高,BG与侵袭性肺曲霉菌病严重程度相关,当曲霉菌含量减少时,机体免疫可迅速清除BG,进而促进疾病转归[20]。本研究结果发现,与免疫正常者相比,免疫低下患者GM、BG 水平更高,此结果可能与免疫低下患者体内菌载量更多,释放入血的GM、BG更多有关。
机体免疫状态是侵袭性肺曲霉菌病发病的重要因素之一,曲霉菌侵入机体后启动固有免疫和适应性免疫系统进行免疫防御,其中固有免疫是免疫系统的第一道防线,NK 细胞可直接或间接杀灭曲霉菌[21]。而由T细胞介导的机体适应性免疫是抵抗曲霉菌侵袭的第二道防线,与侵袭性肺曲霉菌病严重程度相关[22]。CD3+T 细胞、CD4+T 细胞、CD8+T 细胞是与T 细胞免疫相关的细胞因子,其中CD3+T 细胞广泛分布于所有成熟T 细胞膜上,具有协同T 细胞抗原受体转导抗原信息,激活T 细胞的作用[23]。CD4+T 细胞通过促进IFN-γ、IL-6、CRP 等细胞因子的合成分泌激活巨噬细胞,抑制曲霉菌繁殖,但在侵袭性肺曲霉菌病患者中表达降低,影响其作用[24]。另外与CD3+T、CD4+T 相同,CD8+T 细胞同样是机体适应性免疫的重要组成部分[25]。本研究经分析侵袭性肺曲霉菌病患者免疫状态发现,无论是基础免疫正常的患者还是免疫低下的患者,其血清CD3+T 细 胞、CD4+T 细 胞、CD4+/CD8+显 著 降 低,CD8+T 细胞升高,且与之相关的炎症细胞因子同样升高,此结果说明,在曲霉菌侵袭肺部后,患者固有免疫、适应性免疫进行免疫防御,以抵抗曲霉菌定植,但基础免疫低下的患者免疫防御功能丧失较严重,无法抵抗曲霉菌入侵,因此表现为更加显著的免疫丧失,此结果与黄宛虹等[6]的报道结果一致。
CD4+T 细胞按其所产生的细胞因子谱分为Th1型和Th2 型细胞,故机体细胞因子一类主要由Th1细胞产生IFN-γ 等促进细胞免疫,一类主要由Th2型细胞产生IL-6、IL-10 等促进肥大细胞和嗜酸粒细胞的活化与增殖,主要参与体液免疫反应[26]。IFN-γ主要激活单核巨噬细胞,IL-6、IL-10抑制IFN-γ细胞因子产生,IFN-γ 增加巨噬细胞的抗菌活性,因而对肺曲霉菌感染起到保护性免疫应答作用,有利于疾病的控制,IL-6、IL-10 降低巨噬细胞的抗菌活性,使肺曲霉菌病的免疫应答减弱,促进疾病发展[27]。动物研究表明,在免疫健全宿主中烟曲霉菌侵入下呼吸道时巨噬细胞和多型核白细胞等炎症细胞迅速聚集于感染部位,释放多种炎症因子,体内产生Th1型细胞反应,IFN-γ 增多,激活效应细胞的抗曲霉菌能力,有利于宿主清除曲霉菌[28]。本研究结果显示,与免疫正常组比较,免疫低下组IFN-γ、IL-6、IL-10水平均升高,此结果提示在侵袭性肺曲霉菌病发生过程中,CD4+T 细胞介导的免疫应答异常,Th1细胞因子IFN-γ 为抵抗曲霉菌侵袭大量生成,同时Th2型细胞因子IL-6、IL-10在炎症刺激下,同样大量生成,抑制IFN-γ 作用,从而影响宿主清除曲霉菌的能力,因此表现为IFN-γ、IL-6、IL-10均升高。
有报道显示,肺曲霉菌病患者基础免疫状态是决定预后的重要因素,基础免疫低下的患者对外界刺激防御能力减弱,更易引起全身性病变,年龄≥60 岁的免疫低下患者治愈率较低,大多预后不良[29]。进一步分析影响免疫低下患者实验室指标发现,PCT、CRP、CD8+T 细胞、GM、BG 水平升高,CD3+T 细胞、CD4+T 细胞、CD4+/CD8+降低均影响免疫低下患者预后结局。上述结果说明,免疫低下患者一般年龄较大,身体机能较弱,感染较重,免疫功能丧失,症状更严重,可能会对周围正常组织产生不利影响,引起全身性症状,导致治疗无效或增加死亡风险,提示临床需重点关注免疫低下患者基础病的控制,提高患者机体免疫力,从而改善预后。
不同免疫状态侵袭性肺曲霉菌病患者临床表现不同,免疫低下患者临床症状/体征主要表现为咳嗽、发热、湿啰音等,大多免疫低下患者预后不良,治愈率较低,且患者预后不良受多种因素共同影响,临床应针对不同免疫状态患者的疾病特征和预后状况采用有效的措施干预,以促进患者预后恢复。

