矿泉水中大肠菌群检测能力验证结果及分析
赵金丹 姚艳春 杨海进 雷梦 胡鹏燕 胡威威
(中国家用电器研究院,北京 100053)
总大肠菌群是一群在37℃培养,24 h 内能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽孢杆菌[1],是评价生活饮用水卫生质量的重要指标之一,我国生活饮用水卫生标准要求每100 mL 的生活饮用水中不得检出总大肠菌群[2]。水质对用水者的健康有很大影响,总大肠菌群的测定对把控用水水质有重要意义。
能力验证是指利用实验室间比对,按照预先制定的准则评价参加者的能力[3]。能力验证作为重要的外部质量评价活动,是考查检验检测机构能力维持情况和促进能力提升的重要手段。李文绮等[4]对2020 年和2021 年连续两年参加食品中菌落总数的检测能力验证活动进行了经验总结,分析了关键影响因素。方莹等[5]通过生活饮用水中微生物学检验能力验证活动,利用|z|值有效评价了实验室操作人员的检测能力,分析实验过程中存在的问题。本文对ACAS-PT1625(2023)矿泉水中大肠菌群的检测能力验证的实施过程和结果进行了分析总结,以期提升实验室技术能力水平。
1 材料与方法
1.1 测试样品及阳性菌株
测试样品:2 份真空西林瓶样品,编号1#、2#,中国检验检疫科学研究院测试评价中心组织的ACAS-PT1625(2023)矿泉水中大肠菌群的检测能力验证样品。
阳性菌株:大肠埃希氏菌(CGMCC1.90),中国普通微生物菌种保藏管理中心。
1.2 仪器设备
Thermo 1384 型二级生物安全柜,德国Thermo Scientific;Heratherm IMH180 微生物培养箱,德国Thermo Scientific;CL-32L 高压灭菌器,日本ALP;2009D 型程控定量封口机,美国爱德士公司。
1.3 试剂
乳糖胆盐发酵培养液,货号CM108,北京陆桥技术有限责任公司;亮绿乳糖胆盐培养液(BGLB),货号CM143,北京陆桥技术有限责任公司;科立得试剂,美国爱德士公司。
1.4 检验方法
ACAS-PT1625(2023)矿泉水中大肠菌群的检测能力验证参试指导书建议使用GB 8538-2022《食品安全国家标准 饮用天然矿泉水检验方法》55 大肠菌群检测方法中15 管发酵法和滤膜法或实验室常用方法进行样品检测。本次测试采用GB 8538-2022 中15 管发酵法和GB/T 5750.12-2023《生活饮用水标准检验方法 第12 部分:微生物指标》中51 孔定量盘法进行大肠菌群检测。
1.5 检验步骤
1.5.1 样品接收
实验室接收到能力验证样品后应先确认样品包装状态是否完好,识别瓶身标识并进行登记,仔细阅读参试指导书。能力验证样品收到后应立即进行检测,如不能立即检测,按照参试指导书要求在指定温度下进行保存。
1.5.2 样品处理
样品需要用520 mL 无菌水再水化。样品开启后,立即加入10 mL 无菌水进行再水化,待溶解后,吸出放入无菌瓶中,再反复用余下的无菌水清洗西林瓶内壁,回收清洗液放入上述无菌瓶中,此溶液即是待测样品原液。操作各环节应保证无菌和充分混匀。
1.5.3 15 管发酵试验
用移液枪吸取10 mL 样品原液置于盛有90 mL 无菌生理盐水的锥形瓶中,充分混匀,制成1∶10 的样品匀液。按照相同方式制备10 倍系列稀释样品匀液。选择2 个~3 个适宜稀释度的样品匀液分别做15 管发酵,轻摇试管(避免小倒管中产生气泡),使液体充分混合,置36℃培养箱内培养24 h。取一接种环产酸产气阳性管培养液,接种到10 mL BGLB 中,置36℃培养箱中培养48 h。观察BGLB 管中小倒管内的产气情况,如有气体产生,确定为大肠菌群阳性。
1.5.4 51 孔定量盘法
检测所需水样为100 mL,将待测样品原液进行10 倍梯度稀释,选择2 个~3 个适宜稀释度的样品匀液进行检测。将100 mL 待测水样加入到无菌三角瓶中,加入科立得试剂,混合均匀使之完全溶解后倒入51 孔定量盘中,轻拍除去气泡,热封后于36℃培养箱内培养24 h。
1.5.5 阳性对照和空白对照
采用大肠埃希氏菌(CGMCC1.90)作为阳性对照菌株,制备成菌液浓度约为10 CFU/mL~102CFU/mL 的菌悬液,采用同批次无菌生理盐水做空白对照,按1.5.3 节和1.5.4 节方法接种培养。
2 结果与分析
2.1 15 管发酵试验结果
两份样品经乳糖胆盐发酵后产酸、产气阳性管转接种于BGLB 培养仍为阳性。阳性菌株接种管均有阳性反应,空白对照管均没有菌生长,试验有效。大肠菌群15 管发酵试验结果如表1 所示。经实验室综合评定,将人员2 的15 管发酵试验结果作为最终结果并上报,即样品1#中大肠菌群的浓度为7.9×104MPN/100 mL,样品2#中大肠菌群的浓度为5.4×104MPN/100 mL。
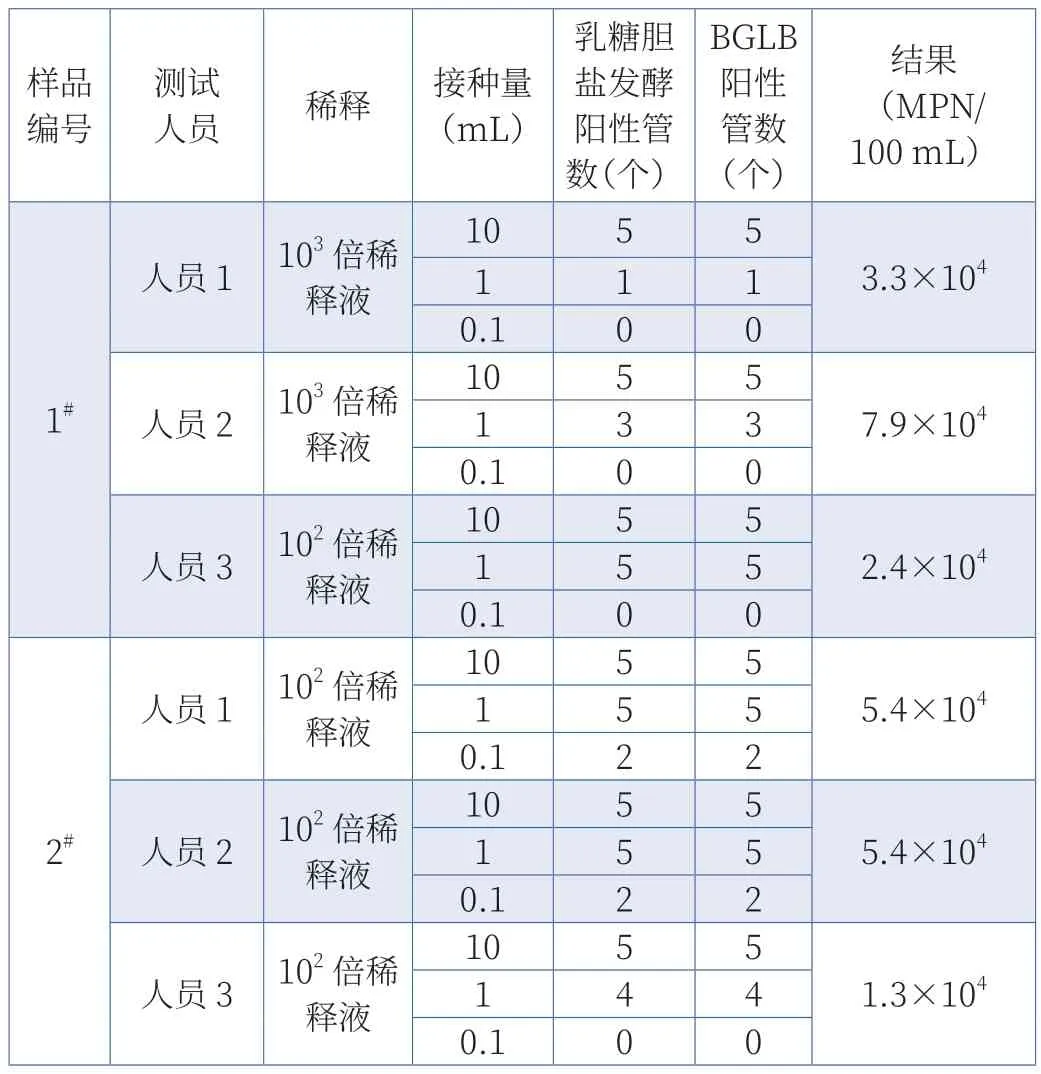
表1 2 份样品大肠菌群15 管发酵试验结果
2.2 51 孔定量盘试验结果
本次能力验证样品再水化后液体量较大,为了进一步考察实验室不同人员、不同方法对同一指标的检测能力,采用51孔定量盘法对待测原液进一步检测。阳性菌株接种培养定量盘均呈黄色,生理盐水接种空白对照定量盘无颜色变化,试验有效。大肠菌群51 孔定量盘试验结果如表2 所示。

表2 2 份样品大肠菌群51 孔定量盘试验结果
2.3 能力验证结果
能力验证提供者对参加者的检测结果经对数转换后,按式(1)进行z值计算。|z|≤2.0 为满意结果,2.0 <|z|<3.0为可疑结果,|z|≥3.0 为不满意结果(离群值)。
式中:x-参加者检测结果;X-指定值;σ-能力评定标准偏差。
本次能力验证共有33 家实验室参加并反馈结果,能力验证提供者采用稳健平均值作为指定值,采用稳健标准差作为能力评定标准差,指定值和能力评定标准差如表3 所示。忽略单一实验室反馈数值对整体能力验证指定值和能力评定标准差的影响,对本次实验室获得数据进行z值分析,分析结果如表4所示。

表3 指定值和能力评定标准差汇总

表4 试验数据汇总及z 值分析
2.4 质量控制分析
2.4.1 过程分析
微生物检测领域能力验证检测周期较短,样品处理后需要及时检测,不容复测,具有一定难度,这就要求实验室提前做好各项准备工作,对过程中可能出现的不稳定因素进行必要控制。以本次能力验证为例对操作过程进行简要分析:
(1)实验室在接到寄样通知后需要关注样品物流进度,及时收样,收到样品后检查样品状态,如不能及时检测,需要按照参试指导书要求进行存储。
(2)确定能力验证试验方法,一般情况下参试指导书会给出推荐方法,实验室也可以根据日常检测情况选择常用方法,方法确定后对实验过程中要用到的仪器、设备、环境进行核查,确保各项参数以满足试验要求。
(3)微生物检测试验所用的耗材、试剂均需要进行灭菌处理,同时要监测灭菌效果。不同培养基灭菌温度条件可能不同,配制时要严格按照相应要求进行操作,避免其成分性状发生改变。
(4)再水化是能力验证操作过程中的第一步,也是至关重要的一步,会对后面整体试验过程产生不可逆的影响。参试指导书中给出了详细的再水化操作,操作人员要仔细阅读并按照要求进行试验,一般反复清洗西林瓶内壁不少于3 次,以保证获得全部待测样品。
(5)能力验证样品模拟污染水体的实际情况,添加多种背景菌,增加考核难度,实验室根据参试指导书要求,预先判断样品污染程度并进行稀释,以保证结果的有效性和准确性。试验过程中应根据需要增加阳性对照、阴性对照、空白对照,降低对试验结果的误判,以保证结果的可靠性。
(6)按照参试指导书和结果报告单中要求报告结果,按实验室要求填写能力验证原始记录,检验原始记录详实,包含试验环境、设备、试剂、操作步骤以及关键步骤下的结果、结论等信息,以便审核人员进行复核。
2.4.2 结果分析
将数据录入SPSS 27 进行统计分析,1#测试结果P=0.105、2#测试结果P=0.616,实验室不同人员采用2 种方法对2 份能力验证样品检测结果无显著性差异(P>0.05),且3 名检测人员的2 种方法检测|z|值均≤2.0,均可以顺利通过本次能力验证。
2.4.3 检测方法分析
从检测方法来看,51 孔定量盘法|z|值较小,最大为0.3,准确性高于15管发酵法,无需确认试验、操作简单、检测周期短,可以很好地满足实验室日常检测需求,特别是应对大批量或应急检测,不足之处是成本较高;15 管发酵法|z|值差别较大,最小0.1,最大1.3,对人员操作熟练度要求较高,相较于51孔定量盘法操作繁琐,前期准备试剂、耗材较多,需要确认试验,检测周期长,但检测成本低,整体满足日常检测需求,不适应大批量或者应急检测。
2.4.4 人员操作分析
为评价实验室多名检测人员能力,本次能力验证由3 名人员同时进行。操作均在生物安全柜中进行,移液枪加样,固定温度培养箱中培养,所用仪器设备均在计量有效期内,且进行了期间核查,一定程度内排除仪器设备对试验的影响。从表4可以看出人员2 检测结果更接近于样品指定值,人员3 检测结果误差较大,分析原因是在日常检测工作中人员3 对大肠菌群项目检测次数较人员1 和人员2 少,熟练程度低。通过本次能力验证可以有效评价检测人员操作水平,为后续人员培训、监督、考核提供依据。
3 结论
实验室由3 名检测人员采用GB 8538-2022 中15 管发酵法和GB/T 5750.12-2023 中51 孔定量盘法对本次能力验证样品进行大肠菌群检测,|z|值均≤2.0,可以顺利通过本次能力验证。15 管发酵法和51 孔定量盘法均可以满足日常检测需求,51 孔定量盘法操作更为便捷,可以应对大批量或应急检测。
通过本次矿泉水中大肠菌群的检测能力验证活动,有效利用z值结果对实验室技术水平进行分析,评价检验人员的业务能力,对试验过程中可能存在的问题进行预防和纠正,同时完善实验室质量控制和管理。能力验证作为实验室重要的外部质量控制手段,可以有效考核实验室技术能力,有利于实验室自我评定,对实验室质量控制具有重要意义。

