rhG-CSF治疗儿童ALL的药效学及药代动力学分析
成亚涛, 张古英
河北省儿童医院药学部,河北石家庄 050000
急性白血病发病具有病情发展迅速且复杂、预后不佳等特点,其中30%~40%为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),年龄低于15岁男性为ALL高发群体[1]。患儿主要表现为出血、免疫功能异常以及贫血[2]。目前临床对于ALL采用化疗方案,化疗导致骨髓抑制会造成患者中性粒细胞水平下降,感染发生率升高[3]。重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)为造血调控因子,可以明显促进祖细胞增殖、分化、成熟,同时还可以刺激中性粒细胞释放,在肿瘤疾病化疗后应用有助于减少感染发生[4-5]。本文探讨ALL患儿采用rhG-CSF治疗药效学以及药代动力学特征,为后期临床治疗方案制定提供参考。
1 资料和方法
1.1 一般资料
收集2019年9月—2021年9月期间收治的126例ALL患儿相关资料进行回顾性分析,所有患者均接受柔红霉素+阿糖胞苷+依托泊苷(daunorubicin+arabinoside+etoposide,DAE)化疗方案,按照患者治疗期间是否应用rhG-CSF治疗将患儿分为研究组(n=38)与对照组(n=88)。研究组男26例,女12例;年龄3~17岁,平均(11.34±3.08)岁;临床分型:低危、中危以及高危分别19例、13例以及6例;FAB分型:L1型9例,L2型29例。对照组男58例,女30例;年龄3~17岁,平均(11.72±3.19)岁;临床分型:低危、中危以及高危分别48例、29例以及11例;FAB分型:L1型13例,L2型75例。两组患儿一般资料比较差异无显著性(P>0.05),具有可比性。纳入标准:①参照患儿临床症状、血象变化、骨髓形态变化确诊为ALL[6];②年龄不足18岁;③接受DAE化疗方案治疗;④患儿各项资料完整。排除标准:①伴肝肾功能异常、感染性疾病或者恶性肿瘤疾病患儿;②近期应用糖皮质激素治疗者;③资料不全者。
1.2 治疗方法
对照组接受DAE方案进行治疗,化疗完成后每间隔1~2天需要进行血常规检查。研究组在对照组用药基础上加用rhG-CSF治疗,每天皮下注射rhG-CSF(华北制药金坦生物技术股份有限公司)100 μg/kg,1次/天,待中性粒细胞绝对值(absolute value of neutrophil cell,ANC)低于0.5×109/L开始注射,而连续2~3次血常规检查ANC超过0.5×109/L停止注射。
1.3 rhG-CSF药代动力学分析
研究组患者在用药后第1天晨起食用清淡饮食后收集2 mL空白血样,在用药rhG-CSF后6、12、24、36、48、72、96、144、192、240、288、336、384、432、480 h时收集肘静脉血2 mL,离心处理后保存在-20 ℃冰箱待测,rhG-CSF采用酶联免疫吸附试剂盒测定。所有样品血药质量浓度-时间曲线均采用DAS 3.2.4药动力学软件计算,同时测定药峰浓度、总清除率、消除半衰期、达峰时间、平均滞留时间以及药时曲线下面积(area under the curve,AUC)等药代动力学指标。
1.4 药效学试验
①标准曲线:采用人空白血清配置rhG-CSF校正标准样品,样品质量浓度分别为0、50、100、200、400、800、1 600、3 200 ng/L,分别以药物质量浓度与吸光度分别作为横坐标、纵坐标绘制标准曲线,并定量测定下限。②特异性试验:选用5种内源性蛋白或者细胞因子确定rhG-CSF测定方法特异性。③稳定性试验:应用人空白血清配置100、800 ng/L rhG-CSF样品,测定其在不同环境及不同保存时间下稳定性。④稀释线性试验:配置高质量浓度含有rhG-CSF血清样品,随后依次稀释,测定期望指数(测定值/期望值)以及质量浓度精确度、准确度。⑤平行性试验:选择患者给药后Cmax血清样品,采用人空白血清进行倍比稀释后测定rhG-CSF血清样品质量浓度。
1.5 观察指标与评价标准
①疗效指标:包括患者疾病控制率、ANC最低值、粒细胞减少时间以及粒细胞缺乏(粒缺)时间。疾病控制率:依据《血液疾病诊断及疗效标准》[7]予以判断,完全缓解为患儿血小板计数超过100×109/L,血红蛋白男性与女性分别超过110 g/L与100 g/L,ANC超过1.5×109/L,红细胞以及巨核细胞正常,骨髓象幼稚淋巴细胞+原始淋巴细胞低于5%;部分缓解为血象与患儿临床症状中有1项不符合完全缓解标准,骨髓象幼稚淋巴细胞+原始淋巴细胞范围为5%~20%;未缓解为患儿没有达到部分缓解标准,疾病控制率(%)=(完全缓解例数+部分缓解例数)/总例数×100%。粒细胞减少时间为ANC从最低值上升至≥1.5×109/L时间,粒细胞缺乏时间为ANC从最低值上升至≥0.5×109/L时间。②感染率:主要包含胃肠道感染、肺炎以及败血症发生率。③不良反应发生率:主要包括治疗后肝功能异常、骨髓抑制、消化道反应以及黏膜损伤等。④研究组患者血清rhG-CSF批内与批间精确度与准确度、血清rhG-CSF测定稳定性。⑤研究组患者rhG-CSF血药质量浓度与ANC水平变化。
1.6 统计学方法
采用SPSS 20.0软件进行分析,计量资料采用两独立样本t检验,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者疗效比较
研究组患者疾病控制率、ANC最低值高于对照组,粒细胞减少时间、粒细胞缺乏时间、粒缺伴发热时间低于对照组(P<0.05;表1)。
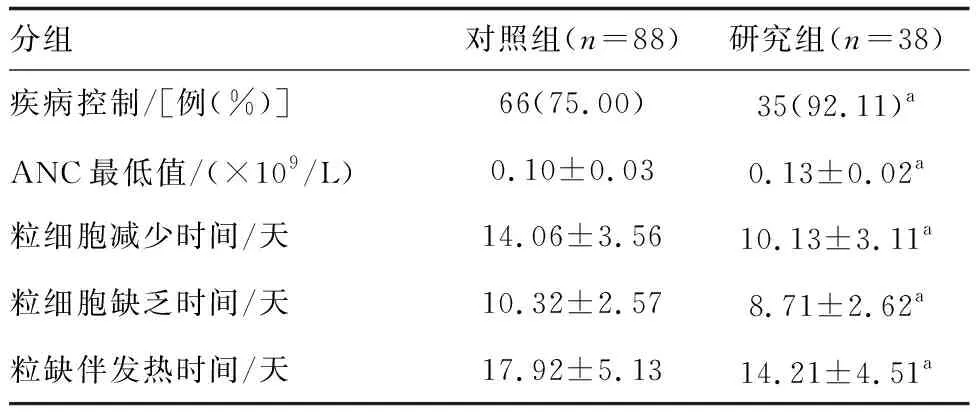
表1 两组患者治疗疗效比较 例(%)
2.2 两组患者治疗后感染发生率比较
研究组患者胃肠道感染、肺炎、败血症发生率低于对照组(P<0.05;表2)。
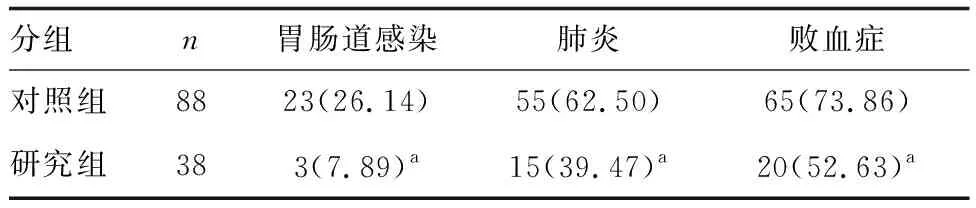
表2 两组患者治疗后感染发生率比较 例(%)
2.3 两组患者不良反应发生率比较
研究组骨髓抑制不良反应发生率低于对照组(P<0.05;表3)。
2.4 血清rhG-CSF稳定性分析
-20 ℃ 30天条件下测定800 ng/L rhG-CSF质控样品准确度(99.48%)较高,3次冻融条件下测定100 ng/L rhG-CSF质控样品准确度(98.66%)较高(表4)。
2.5 rhG-CSF血药质量浓度分析
研究组患儿rhG-CSF血药质量浓度-时间曲线均为单峰,血药质量浓度随着rhG-CSF注入时间先上升后下降(图1)。ANC水平低时,rhG-CSF清除速度缓慢,ANC水平逐渐上升,至其水平恢复正常时,rhG-CSF清除速度上升,与中性粒细胞介导清除机制相符。
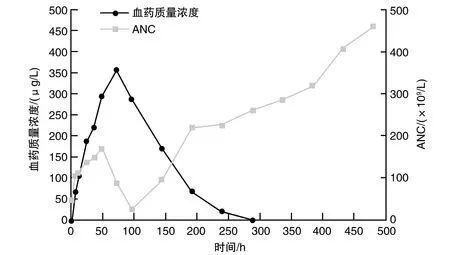
图1 rhG-CSF血药质量浓度与ANC水平变化
2.6 rhG-CSF药代动力学参数分析
研究组患者rhG-CSF药动力学参数药峰浓度为356.24(106.28~552.23)μg/L、总清除率为3.13(1.52~8.95)mL/(h·kg)、消除半衰期为15.24(10.37~19.52)h、达峰时间为48.00(12.00~72.00)h、平均滞留时间为79.53(52.81~103.54)h,AUC0-t为39 141.53(11 582.81~75 135.78)ng·h/mL,AUC0-∞为39 276.42(11 596.72~75 141.52)μg·h/L。
3 讨 论
rhG-CSF经由刺激骨髓细胞,使中性粒细胞集落单位增多,进而上调机体单核细胞、中性粒细胞以及T淋巴细胞数量[8]。ALL患儿由于肿瘤病情已存在免疫功能异常,而化疗治疗所用各种药物除了会杀伤病灶细胞外,也会杀伤正常造血细胞,进而导致机体出现骨髓抑制[9]。本研究显示,研究组患儿ANC最低值高于对照组,骨髓抑制发生率低于对照组,显示加用rhG-CSF治疗确实可以纠正ALL患者化疗治疗后骨髓抑制。rhG-CSF可能经由改善骨髓基质衍生细胞因子1水平,下调趋化因子受体4表达,促进Treg细胞向骨髓转移与黏附,保证足够Treg细胞进入外周血,发挥免疫作用,进而减轻机体骨髓抑制作用。研究发现,白血病化疗后粒细胞缺乏患者采用聚乙二醇化粒细胞刺激因子治疗后可以有效缩短粒细胞减少以及缺乏时间[10],这与本研究粒细胞缺乏与减少相关时间结论一致。本研究发现,ALL患儿采用rhG-CSF可以有效纠正体内粒细胞缺乏现状,因此骨髓抑制发生率较低,而其他不良反应差异不大。
rhG-CSF在人体发挥促进中性粒细胞形成作用,其自我调节清除作用需要占主导地位,即ANC水平下降时,中性粒细胞介导清除过程相对缓慢,rhG-CSF可以在人体内积聚,使rhG-CSF血药质量浓度逐渐增加,进而促进ANC水平上升;在ANC水平上升时,中性粒细胞介导清除机制发挥作用,rhG-CSF血药质量浓度迅速减少,ANC水平逐渐上升[11-12],这与本研究中rhG-CSF血药-时间曲线趋势一致,显示rhG-CSF药动力学符合粒细胞介导清除机制。本研究显示,ALL患儿药峰浓度较成人高,且消除半衰期、达峰时间较成年人短,其可能与儿童群体新陈代谢迅速、代谢循环时间短,对于药物排泄速度迅速有关[13]。
综上,ALL患儿采用rhG-CSF治疗药动力学符合粒细胞粒细胞介导清除机制,同时治疗疗效以及安全性相对优异,临床应用价值优异。

