新型冠状病毒检测技术的研究进展
陈子杰, 刘臻, 伍倩, 廖力夫, 肖锡林, 谭琰
南华大学 1.衡阳医学院公共卫生学院, 2.化学化工学院,湖南衡阳 421001
新型冠状病毒,即严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2),对全球的公共卫生安全造成了极大的威胁,也对全球经济和社会发展造成了巨大冲击。世界卫生组织公布了五种关切变异株[1],即阿尔法(Alpha)、贝塔(Beta)、伽马(Gamma)、德尔塔(Delta)、奥密克戎(Omicron),因此,准确地筛查并确诊SARS-CoV-2感染者是新冠疫情防控的首要任务。选择合适的新型冠状病毒检测技术和方法在应对传染病暴发流行与诊治防控方面起着关键作用。本文对目前应用的SARS-CoV-2实验室检测方法进行概述,为新型冠状病毒的检测和防控提供参考。
1 SARS-CoV-2病原学结构特点
SARS-CoV-2是目前发现的第7种β属冠状病毒,呈圆形或椭圆形,直径60~140 nm。SARS-CoV-2基因组是单股正链的核糖核酸,大小27~32 kb。SARS-CoV-2除了有β冠状病毒属结构的血凝素-酯酶蛋白外,还含有4种结构蛋白,即表面刺突(spike,S)蛋白、核衣壳(nucleocapsid,N)蛋白、膜(membrane,M)蛋白和包膜(envelop,E)蛋白。SARS-CoV-2通过S蛋白能特异性地识别细胞表面受体血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)并与之结合[2],随后很快催化病毒基因组释放到细胞中。S蛋白位于囊膜上,可分为N端S1结构域和C端S2结构域,S1结构域负责病毒与细胞受体的结合,S2结构域负责介导病毒与细胞膜融合作用。研究发现,SARS-CoV-2的S蛋白对ACE2的亲和力非常高,同时S蛋白也是大部分疫苗针对的标靶[3]。
2 SARS-CoV-2主要检测技术
2.1 病毒实验室分离、培养、鉴定
Zhu等[4]将患者支气管肺泡灌洗液的病毒接种到人呼吸道上皮细胞、猴肾Vere-E6和人肝癌Huh-7细胞株分离培养出新型冠状病毒。SARS-CoV-2的分离培养在呼吸道上皮细胞内只需96 h,在Vero-E6和Huh-7细胞系中分离培养则需6天。新型冠状病毒的分离培养与鉴定为致病机制的研究、快速检测试剂的开发、疫苗和抗病毒特效药的研制奠定了基础[5]。但病毒培养必须在生物安全三级及以上的实验室进行,实验操作存在很大的感染风险,而且单次培养成本高。因此,当面临新冠感染人数多、检测样本量大的情况,病毒培养鉴定的方法则不适用。
2.2 高通量测序
高通量测序是新型冠状病毒疫情初期检出SARS-CoV-2的方法之一,其原理是对标本的病毒核酸进行广泛独立平行的测序,通过比对生物信息来分析病毒的全部序列结构。SARS-CoV-2的测序方法主要包括宏基因组测序、探针捕获测序、多重PCR扩增子测序和纳米孔靶向测序。研究表明,探针捕获测序和多重PCR扩增子测序在高病毒载量(≥105copies/mL)标本中都具有很好的富集效果,但在低病毒载量(≤104copies/mL)样本中,多重PCR扩增子测序的富集效果更好[6]。纳米孔靶向测序法是第三代测序方法,其检测设备小巧便携,同时适用于从临床样本中识别SARS-CoV-2的突变监测。宏基因组测序平台的建立需要昂贵的仪器设备和专业的技术人员,不适用于SARS-CoV-2的快速检测和大规模标本的筛查和诊断,因此较难推广普及。高通量测序目前主要用于科学研究,临床医疗机构的应用还需要制定规范化的操作流程。
2.3 荧光定量PCR
SARS-CoV-2属RNA病毒,荧光定量PCR法先将RNA经过反转录为cDNA再进行扩增检测,通过荧光定量PCR反应所得到的样本循环阈值的大小来判断患者标本中是否有SARS-CoV-2的存在。荧光定量PCR法一般能在4 h内获得结果。
由于RNA病毒容易发生变异,为了防止错检,SARS-CoV-2的实时荧光定量反转录聚合酶链反应检测分别在ORF1ab基因、N基因上选取两个靶标,同时在E基因上选取第3个靶标,能有效提高病毒的阳性检出率。荧光定量PCR法对病毒RNA进行定量分析,检测效率快,而且整个检测过程无需对PCR产物进行后期处理,还可以使用特异性探针等方式降低非特异性扩增,降低了检测过程中可能出现的污染和假阳性,具有操作便捷,特异度强,灵敏度高的优点。诊疗方案提出,新型冠状病毒核酸检测阳性是确诊新型冠状病毒感染的首要标准[7]。荧光定量PCR法检测结果容易受到采样操作不规范,RNA易被环境RNase降解,核酸提取量不足和测试剂盒质量不达标等诸多因素影响而成假阴性,因此,应对疑似患者多部位同时采样,从而确保SARS-CoV-2检出结果的准确性。
2.4 反转录环介导恒温扩增
反转录环介导恒温扩增技术在传统的环介导恒温扩增技术上,加入了有热稳定性的反转录酶,可同时进行核酸扩增和反转录反应,在50~65 ℃的条件下,1 h内扩增DNA产量是常规PCR的100倍以上。李欢等[8]利用RT-LAMP技术建立了一种新型冠状病毒核酸的快速检测方法,只需要肉眼观察即可判断有无扩增反应产物生成和确认是否有靶基因存在,适合条件有限的边境地区进行SARS-CoV-2的核酸检测。RT-LAMP法不需要改变扩增中的温度,而且具有灵敏度高、反应时间短和扩增结果可直观判读的优点。因此,该技术可现场快速检测SARS-CoV-2,实现核酸提取、扩增和检测一体化,但是恒温扩增法对引物集的设计、专业人员技术要求较高。
2.5 基因芯片
基因芯片是微流控芯片的一种特殊类型,原理是通过微加工技术,将大量特定的序列基因探针集成在硅片上,构成一个高密度的探针阵列,再与标记的样品分子进行杂交,通过检测杂交信号分子可得到样品分子的序列结构。博奥生物集团等研发了一款基于恒温扩增芯片法的多病毒核酸联合检测试剂盒;该试剂盒获得国家药监局应急审批批准,并迅速应用于中国SARS-CoV-2的检测,能在90 min内同时检测包括新型冠状病毒在内的6种呼吸道病毒[9]。基因芯片虽然可以一次性对样品中大量序列进行检测分析,能快速同时检测多种疾病,但是容易出现假阳性结果。基因芯片技术成本昂贵,信息解读复杂,难以实现标准化和大批量生产,目前不能在多种病原体混合感染时鉴别主要病原体,不适于医疗机构的常规检测。
2.6 抗原抗体检测
新型冠状病毒抗体检测试剂主要是检测N蛋白和S蛋白IgM、IgG抗体。研究表明,高滴度恢复期抗体血浆治疗有助于降低新冠病毒感染住院患者的死亡风险[10]。在核酸检测的基础上,增加抗原检测作为补充,可有助于早期筛查疑似SARS-CoV-2病例[11]。SARS-CoV-2的抗原抗体检测主要包括胶体金免疫层析法和磁微粒化学发光法。
2.6.1 胶体金免疫层析法 胶体金是氯金酸水溶液在还原剂作用下聚合成特殊大小的金颗粒,颗粒之间因静电作用形成一种稳定的胶体状态。SARS-CoV-2的胶体金免疫层析法检测包括了抗原检测和抗体检测,两种试剂盒均获得国家药监局批准,使用时应当注意区分开。胶体金免疫层析法的样本为血清、血浆和鼻咽拭子,以实时荧光PCR法作为对比,IgM和IgG抗体检测的灵敏度和特异度有所不同,二者联合检测的检出率大大提高[12]。胶体金免疫层析法可实现现场即时检验,可用于社区居民自我检测,可在15~20 min即可肉眼观察检测结果,可辅助确诊SARS-CoV-2,具有操作简便、检测时间短和无需复杂仪器等优点。但是该法存在窗口期,具有无法定量检测和有交叉反应等缺点。作为前期筛选的阳性病例,仍然需要核酸检测进行确诊。
2.6.2 磁微粒化学发光法 磁微粒化学发光法采用化学发光法和磁性纳米粒子技术相结合。该方法比普通化学发光检测法有更高的灵敏度和更快的检测速度(只需30~60 min)。研究发现,磁微粒化学发光法检测IgM和IgG抗体阳性率均高于胶体金免疫层析法,两种方法的IgM抗体检测差异大于IgG抗体检测[13]。该法具有检测范围宽、操作标准化的特点,但选择性差,会对一系列的化合物做出反应,而且需要特殊的化学发光检测分析仪,单次检测成本较高,很难在医院和基层社区进行普及。
2.7 基于CRISPR/Cas系统的核酸检测技术
2.7.1 DETECTR DETECTR技术是利用Cas12a的特性建立的核酸检测方法[14]:通过激活Cas12a使crRNA-Cas12a复合物与靶DNA结合并诱导与荧光报告分子偶联的ssDNA的非特异性切割,从而释放荧光信号,荧光信号可做成流层析纸条,以此判定目标序列的存在,实现病毒DNA检测可视化。Broughton等[15]开发了一种基于CRISPR/Cas12的DNA内切酶靶向的CRISPR反式报告器新型SARS-CoV-2检测系统,可检测SARS-CoV-2 N和E基因。总之,DETECTR可将恒温扩增与CRISPR/Cas检测相结合,检测时间<40 min,可通过定性和可视化的横向流动分析输出结果,实现快速且可视化的SARS-CoV-2核酸检测。
2.7.2 SHERLOCK SHERLOCK技术是Gootenberg等[16]在拉沙热等RNA病毒核酸检测基础上用Cas13a蛋白的非特异切割活性和重组酶聚合酶扩增技术所研发的一种核酸检测方法;该方法设计了新型冠状病毒的向导RNA,分别用于识别新冠病毒的S基因和ORF1ab基因。Gootenberg等[17]将SHERLOCK进一步改进,SHERLOCK V2将Cas13a与Csm6结合,实现了四通道(LwaCas13a、CcaCas13b、As-Cas12a、PsmCas13b)多重检测分析与横向金标流动试纸读数,使灵敏度提高了3.5倍,能定量检测到最低病毒载量为2×10-18mol/L。目前SHERLOCK技术已经应用于检测鼻咽拭子样本的SARS-CoV-2,实现了检测限内100%敏感的荧光信号监测[18]。
2.7.3 STOPCovid STOPCovid技术采用反转录环介导等温扩增RT-LAMP和SHERLOCK技术相结合。先采用RT-LAMP在60 ℃下扩增病毒RNA,然后扩增的病毒核酸被Cas12b识别介导切割,最后把样品添加到横向流动试纸条进行检测。STOPCovid技术是基于核酸检测的即时检验,优点是不需要从患者样本中提取和纯化RNA,检测SARS-CoV-2只需在一个试管中一步完成,不需要使用任何大型的仪器,20~45 min就能获得结果,而且灵敏度与荧光定量PCR一样高。STOPCovid升级改进后,STOPCovid V2通过引入磁珠来富集SARS-CoV-2的RNA,去除了乙醇清洗和洗脱过程,将RNA富集过程精简到15 min之内,使反应起始RNA数量大大提高[19]。该方法的不足是检测数据有限,需要进一步的临床验证来确定关键性能指标。
综上所述,基于CRISPR/Cas系统的检测技术具有高灵敏度和高特异性,同时能定量检测,在SARS-CoV-2的感染检测中呈现出优异的检测性能。该技术具有操作步骤简单、耗时短、污染小和检测结果可视化的特点,有望成为检测SARS-CoV-2的下一代主流核酸检测技术[20]。但该技术对操作人员要求高,需要进行专业培训,同时实验检测的数据还需要进行临床验证,研究体系和平台仍需完善。表1对DETECTR、SHERLOCK、STOPCovid技术进行了比较。
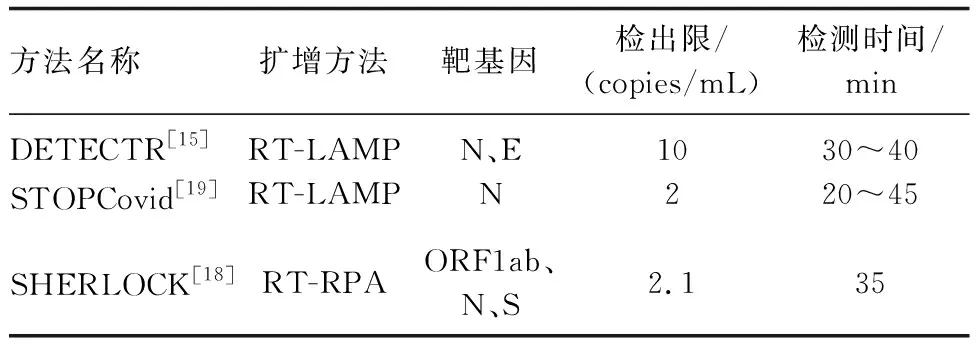
表1 DETECTR、SHERLOCK、STOPCovid技术比较
3 总结与展望
快速有效地检出SARS-CoV-2是疫情防控的关键环节。在了解SARS-CoV-2的病原学结构特点后,可采用多种检测方法来判断结果。检测过程中各个环节的疏忽都有可能导致假阴性结果,因此,SARS-CoV-2的检测应该严格按照标准操作规范进行,如样品的采集、保存、运输、病毒预处理、RNA提取、扩增检测、结果报告及对操作人员进行规范化技术培训,同时注重对实验室环境的清洁和安全管理工作。
目前,实时荧光PCR法仍然是诊断新冠病毒感染的金标准[21]。抗原抗体检测可作为筛选SARS-CoV-2的前期手段,适应于居家隔离群众、密切接触者、封控区和管控区内人员。基于CRISPR/Cas系统的核酸检测技术(DETECTR、SHERLOCK、STOPCovid)具有灵敏度高和特异性强的特点,在新型冠状病毒感染检测中呈现出优异的检测性能,是目前具有良好发展前景的检测技术。为了发挥好快速检测SARS-CoV-2在疫情防控中的关键作用,应该就提高SARS-CoV-2检测技术的灵敏度、特异性、样品通量,减少检测时间和检测成本方面开展深入研究。信息化、智能化技术的广泛运用,能够为快速检测SARS-CoV-2技术的发展提供更广阔的思路。

