2019—2020年9株H9N2亚型禽流感病毒抗原性分析及候选疫苗株筛选
蒋文明,张琳,彭程,刘朔,尹馨,李金平,侯广宇,刘华雷*
(1. 中国动物卫生与流行病学中心,山东 青岛 266032;2. 农业农村部动物生物安全风险预警及防控重点实验室(南方),山东 青岛 266032;3. 乌兰察布职业学院,内蒙古 乌兰察布 012000)
1966年,在北美威斯康辛州的火鸡体内首次发现并分离出H9N2亚型禽流感病毒(avian influenza virus,AIV)[1]。随后,H9N2亚型AIV传播到世界各地,严重危害养禽业的发展,成为全球主要流行的AIV亚型之一。我国于1992年在广东地区首次分离出H9N2亚型AIV[2]。随后,该亚型禽流感病毒快速传播到主要养禽地区,在我国呈地方性流行、持续存在。病毒在进化过程中,抗原漂移、基因重组现象十分普遍,甚至在同一个省份有多种H9N2亚型禽流感病毒流行。H9N2亚型禽流感一年四季均有发生,秋冬季最为严重,各日龄鸡群均易感。H9N2亚型AIV除了引起典型的呼吸系统症状,导致较高的发病率外,还会成免疫抑制,如新城疫免疫失败,产蛋率下降,继发感染等,给养禽业造成巨大的经济损失。
H9N2病毒除了危害养禽业,本身还可感染人类造成发病[3],此外还为其他亚型流感病毒重组提供基因供体,危害人类的生命健康。2013年出现的H7N9病毒[4]和H10N8病毒[5]、2021年出现的H10N3病毒[6]、2022年出现的H3N8病毒[7],这些病毒的内部基因都来自H9N2病毒,重组后造成了人发病或死亡,严重威胁人类的健康。
为控制H9N2亚型AIV的传播,中国大陆广泛实施H9N2亚型AIV疫苗免疫计划[8-9],有效地减少了H9N2亚型AIV造成的经济损失,在H9N2亚型禽流感防控中发挥了重要作用。当前,疫苗免疫仍是防控H9N2亚型AIV的主要手段,截至目前,我国批准和使用的H9N2亚型禽流感疫苗毒种超过20种。然而随着疫苗的高强度、高频次使用,病毒的进化和抗原变异也随之加速[10],加上病毒传播能力强和传播途径多样等因素导致了防控该病变得愈发困难,虽然疫苗免疫覆盖率较高,但近年来H9N2亚型AIV在中国大部分地区仍然一直呈流行态势。
密切关注该病毒的流行与变异,筛选候选疫苗株,对H9N2亚型禽流感防控及公共卫生安全具有重要意义。本研究选取2019—2020年在全国分离获得的9株H9N2亚型AIV,对其进行了基因特性分析。进一步利用血清学技术对这些毒株进行了抗原性分析,并根据抗原性分析结果选择合适的病毒株作为候选疫苗株进行免疫攻毒保护试验,评价疫苗免疫效力。
1 材料与方法
1.1 病毒株
9株H9N2亚型禽流感病毒(A/chicken/Sichuan/C2300/2019、A/chicken/Guangdong/G2225/2019、A/chicken/Hubei/H2049/2019、A/goose/Jilin/N2029/2019、A/chicken/Jiangxi/X2210/2019、A/chicken/Jiangxi/X2326/2019、A/duck/Yunnan/Y2432/2020、A/chicken/Jiangsu/J1443/2020、A/duck/Shandong/BHXH/2020)由本室分离鉴定保存。
1.2 主要试剂
RNA提取试剂盒QIAamp Viral RNA mini Kit,购自凯杰生物技术(上海)有限公司;RT-PCR试剂盒Hiscript One Step RT-PCR Kit,购自南京诺唯赞生物科技有限公司;SPF鸡胚自济南斯帕法斯家禽有限公司;SPF鸡购自北京梅里亚维通实验动物技术有限公司。
1.3 病毒RNA提取与血凝素(HA)基因扩增分析
根据QIAamp Viral RNA mini Kit说明书提取病毒RNA,参考文献[11]对提取病毒RNA进行HA基因扩增,产物送青岛睿博生物科技有限公司测序。对序列进行同源性、受体结合位点、糖基化位点等生物特性分析。
1.4 单因子血清制备
对病毒进行10倍倍比稀释,以10-4稀释度接种9~11日龄鸡胚,每胚接种0.1 mL,37 ℃孵化培养72 h,测定血凝价后无菌收集尿囊液,加入甲醛溶液至终浓度0.2%,4 ℃灭活48 h。灭活后的病毒通过皮下途径免疫4~5周龄SPF鸡,首次免疫14 d后加强免疫1次,二免后每7 d采集1次血液分离血清,测定血凝抑制(HI)效价,如果大于1∶256,则剖杀鸡只,收集所有血清,置于-20 ℃保存备用。
1.5 交叉HI试验
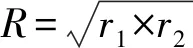
1.6 鸡胚半数感染量(EID50)测定
将病毒进行10倍倍比稀释,接种(10-6、10-7、10-8、10-9)9~11日龄SPF鸡胚,37 ℃孵育3 d,测定鸡胚尿囊液的血凝效价,根据Reed-Muench法计算病毒的EID50。
1.7 交叉中和试验
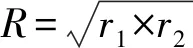
1.8 抗原谱绘制
使用AntigenMap软件对交叉HI试验和中和试验进行分析,绘制抗原图谱。
1.9 攻毒试验
选择抗原谱较广的Y2432作为种毒制备油乳剂灭活疫苗。将3周龄SPF鸡45只分成6组,3组试验组,每组10只;3组对照组,每组5只。试验组每只鸡颈部皮下注射疫苗0.3 mL。接种3周后,试验组和对照组采用静脉注射途径分别用亲本毒Y2432、抗原性差异较大的毒株H2049以及临床发病毒株LH240攻毒,0.2 mL/只(含2 × 106.0EID50)。攻毒后分别于第3和5天采集每只鸡的咽拭子和泄殖腔拭子,进行病毒分离。对病毒分离阴性的样品,盲传1次。
1.10 免疫持续期试验
以Y2432毒株制备油乳剂灭活疫苗,免疫5只3周龄SPF鸡,每周分离血清测定HI效价,试验持续到140 d结束。
2 结果
2.1 HA基因扩增与序列分析
HA基因经RT-PCR扩增测序,发现除X2326毒株外,其余8株病毒HA编码区基因全长均为1 683 bp,编码561个氨基酸;而X2326毒株在nt42之后插入6个碱基,编码563个氨基酸。9株病毒HA基因核苷酸同源性为91.2%~98.9%(表1),遗传进化树显示2019—2020年我国H9N2亚型禽流感毒株之间HA基因分化明显,部分毒株之间差异较大(图1)。9株病毒HA蛋白裂解位点序列均为RSSR,符合低致病性禽流感分子特征[13]。所有9株病毒HA均含有7个潜在的糖基化位点,分别位于29、82、141、298、305、313、492位。对9株病毒HA关键受体结合位点分析,234位氨基酸由谷氨酰胺(Q)变为亮氨酸(L),提示这些毒株具有结合α2,6-Sialidase受体的能力[14]。
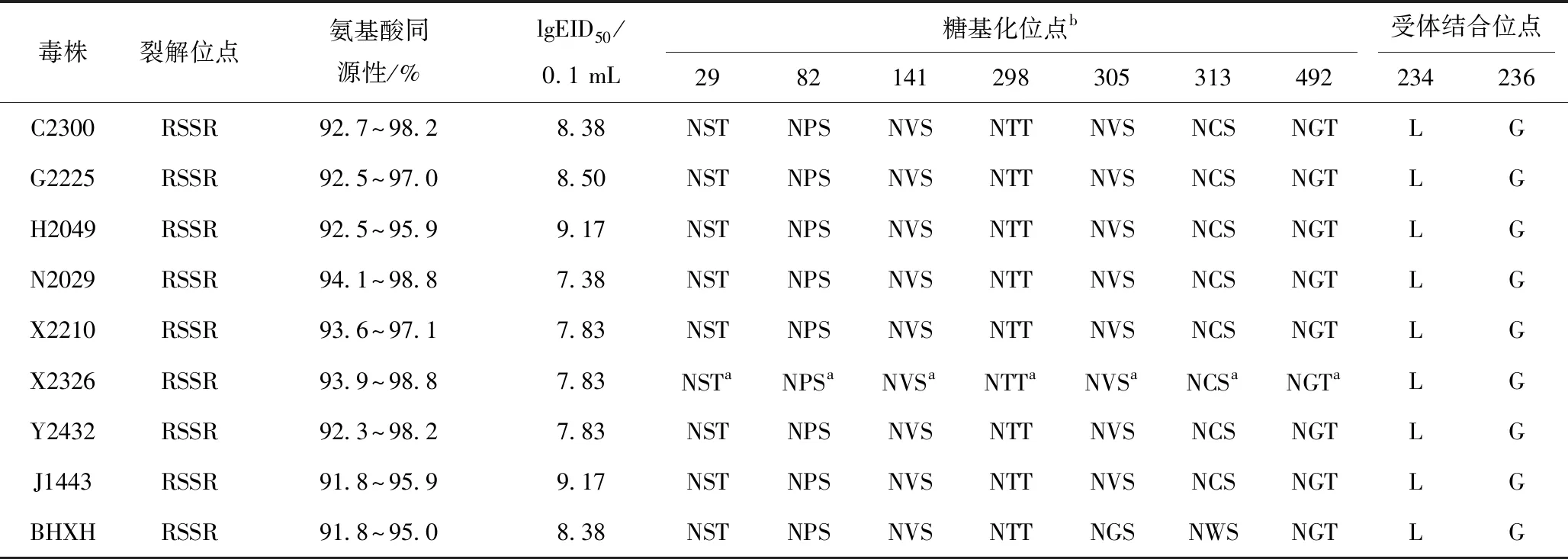
表1 9株H9N2亚型AIV生物学特征

●为本研究毒株
2.2 EID50
如表1,各毒株的EID50为10-7.38~10-9.17/0.1 mL。
2.3 交叉HI试验
如表2显示,各毒株之间出现了0~64倍的抗原性差异。根据抗原相关系数(表3),Y2432、BHXH、C2300 3个毒株与所有毒株HI反应性较好,抗原性无明显差异。H2049与G2225、N2029、X2210、X2326毒株抗原性出现小的差异,N2029与J1443之间、J1443与X2210之间抗原性出现小的差异。结果显示,即使同一时期分离的毒株,HI抗原性也出现差异。
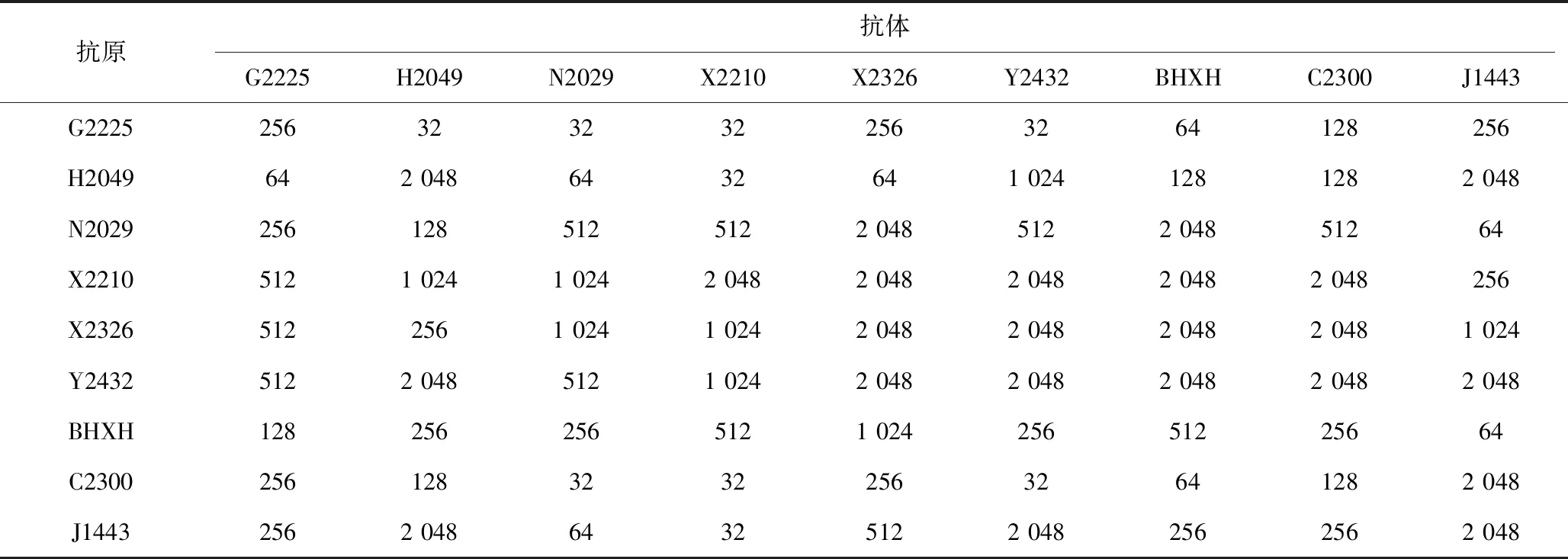
表2 毒株之间交叉血凝抑制试验结果(血凝抑制效价)
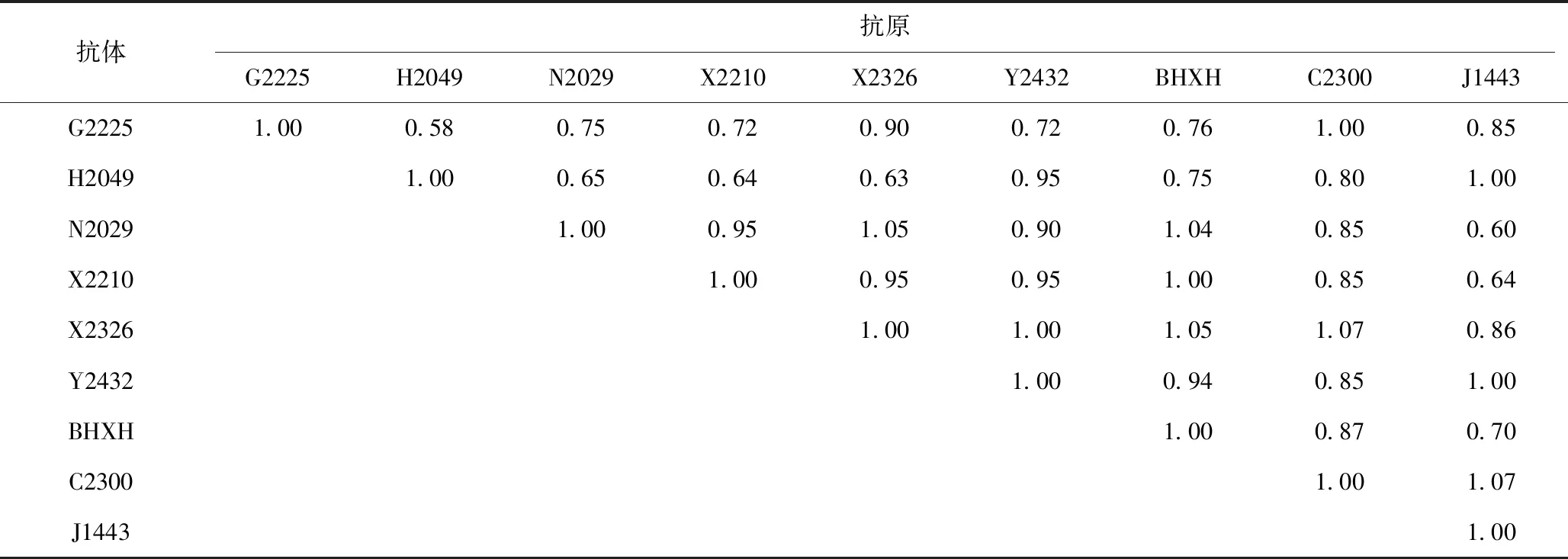
表3 交叉血凝抑制试验抗原相关系数
2.4 交叉中和试验
如表4显示,各毒株之间出现了0~1 024倍的抗原性差异。H2049和J1443 2个毒株只对自身和互相之间反应性较好,对其他毒株的交叉反应性差,而X2326、Y2432、BHXH除了对H2049和J1443 2个毒株的交叉反应性较差以外,对其他毒株的交叉反应性都很好,结果提示可能至少存在2种不同抗原类型。根据计算的抗原相关性系数,H2049和J1443毒株与其他毒株间的抗原性存在明显差异(表5)。
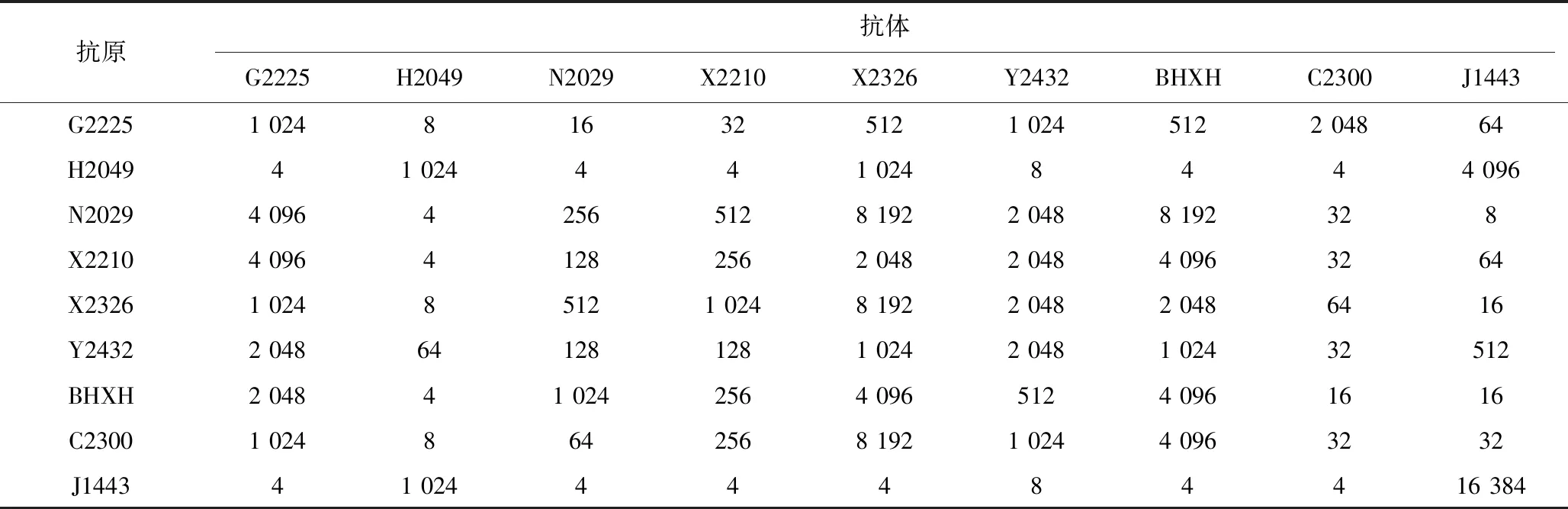
表4 各毒株之间交叉中和试验结果(中和效价)
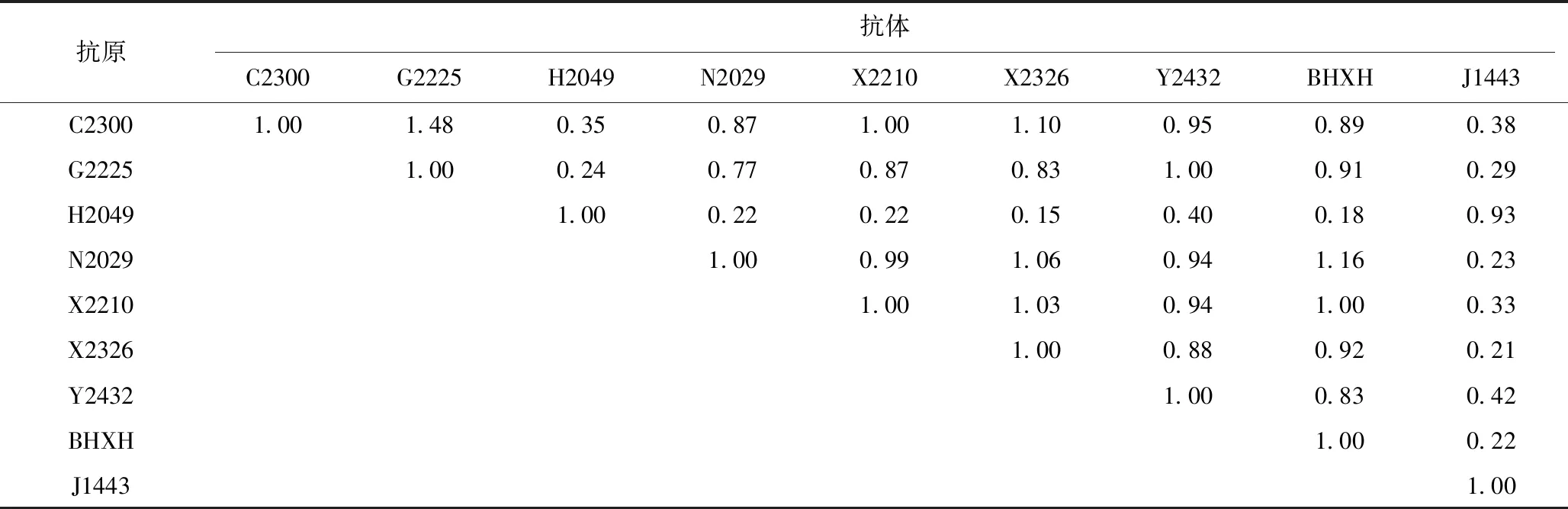
表5 交叉中和试验抗原相关系数
2.5 抗原图谱绘制
根据中和试验结果,利用AntigenMap制作抗原图谱(图2)。若交叉中和试验抗体效价存在2倍差异,则用一个网格进行表示。根据抗原图谱中不同抗原群的分布,可以看出存在2个主要抗原群。
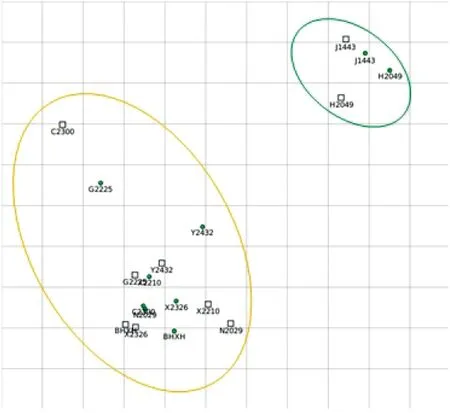
图2 9株H9N2病毒抗原图谱分析
2.6 免疫攻毒试验
灭活疫苗Y2432免疫鸡群后21 d,针对同源毒株平均HI效价达到13.6 log2,选择疫苗同源毒株和抗原群明显不同的H2049毒株以及实验室2021年分离自临床发病鸡群的毒株A/chicken/Shandong/LH240/2021(LH240)进行攻毒试验。攻毒后第3、5天分别采集鸡群的咽肛拭子接种接胚,免疫组病毒分离结果全部为阴性,而对照组全部排毒,说明疫苗针对同源和异源毒株的保护率均为100%(表6)。
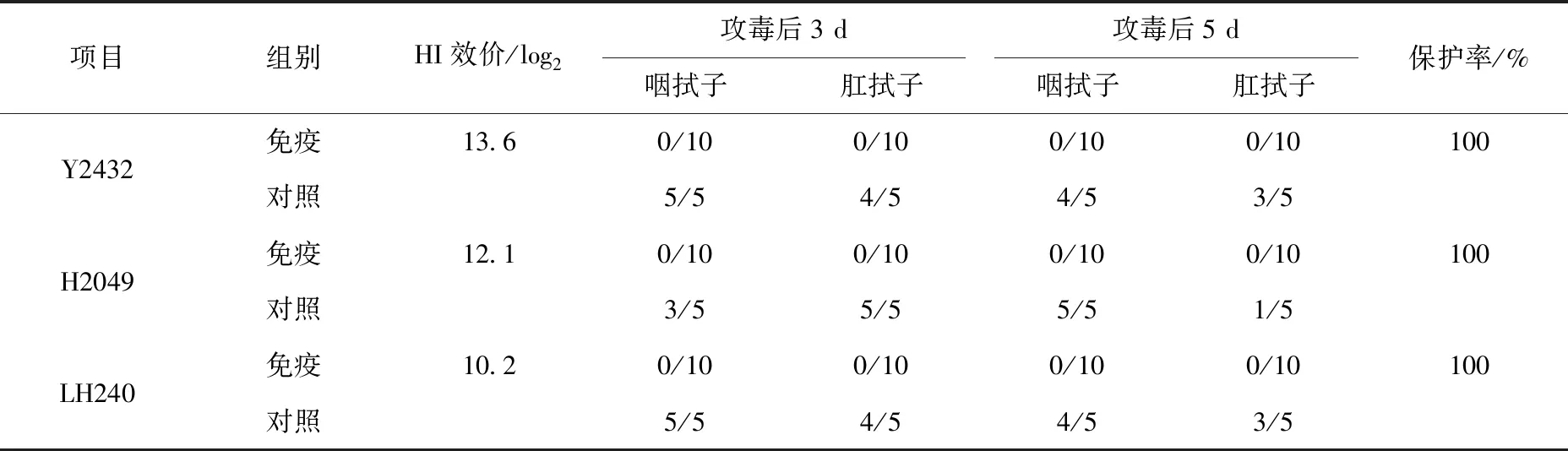
表6 Y2432灭活疫苗免疫效果评估(免疫后21 d)
2.7 抗体消长规律
灭活疫苗Y2432免疫5只SPF鸡,每周测定抗体效价,连续监测20周,观察抗体的消长变化。如图3所示,抗体在0~21 d呈对数增长,到42 d达到高峰,平均效价达到14.4 log2,之后抗体保持一段时间的平台期。第11周后抗体滴度开始下降,到监测的最后一周HI滴度下降至8.8 log2。
3 讨论
H9N2亚型AIV虽然属于低致病性AIV,但是病毒可以侵害家禽的多个系统,如呼吸、系统、免疫系统等。单一感染后家禽往往不表现明显的临床症状,有时只表现轻微的呼吸道症状,如咳嗽、喷嚏。但病毒对免疫系统的抑制作用,使其容易与其他病毒混合感染,或者继发细菌感染,从而导致家禽发病加重,出现较为严重的诸如呼吸道症状、产蛋率和孵化率下降、蛋品质下降,肉禽出现生长迟缓、料肉比上升以及后期死亡率升高、死淘率增加,对家禽养殖业造成的经济损失巨大[15]。
值得一提的是,H9N2亚型AIV的内部基因可以作为供体为其他亚型的AIV提供内部基因,例如2013年我国出现的H7N9亚型流感病毒的6个内部基因都是来自H9N2亚型AIV,最终造成了1 568人感染和615人死亡[16]。该病毒的多年持续流行已经对我国家禽养殖业和公共卫生安全形成了巨大隐患[17-18]。
目前疫苗接种仍然是防控H9N2亚型禽流感的重要措施。但是随着病毒的不断变异,家禽经过免疫后,H9N2亚型禽流感仍时有发生。研发抗原谱更广、抗原性更强的疫苗对于控制H9N2亚型AIV的传播显得更为重要。HA蛋白是AIV最主要的保护性抗原,其在病毒吸附以及穿膜过程中起关键作用,并可刺激机体产生中和抗体,从而抵抗病毒感染[19]。此外,HA是AIV变异率最高的蛋白,是病毒发生抗原变异的主要原因。本研究的9株病毒HA同源性最大的差异已经达到8.2%,说明部分毒株间HA蛋白变异明显。而HI交叉中和试验中毒株间抗原性最大相差64倍,血清中和试验中毒株间抗原性最大相差1 024倍,这与基因序列分析结果相符。
HA蛋白的糖基化与病毒的感染和入侵、宿主细胞受体结合、病毒免疫逃逸以及抗原性密切相关[20]。本研究中的9株病毒糖基化位点相同,说明其抗原性的差异可能与糖基化无关[21],可能受抗原表位差异的影响所导致[22]。
本研究选取了9株2019—2020年实验室分离的H9N2亚型AIV,利用血清学技术对这些毒株进行抗原性分析。同时,根据抗原性分析结果选择病毒株作为疫苗候选株进行攻毒免疫保护试验,评估疫苗免疫效力。血凝抑制试验结果显示,9个毒株免疫SPF鸡后,针对同源毒株抗体水平都较高,具有良好的免疫原性;中和试验结果显示,毒株H2049和J1443 2个毒株只对自身和互相产生较高的保护力,而对其他毒株没有较高的保护力,而其他的6个毒株的交叉保护力相差不大,结果提示可能存在2种不同抗原类型。抗原相关系数分析表明,H2049、J1443毒株与其他毒株间的R值都较小,表示抗原之间抗原性差异大。综合交叉血凝抑制试验和中和试验的结果,分析存在明显不同的2个抗原群。根据交叉血凝抑制试验和中和试验的结果,选择抗原性好、抗原谱广的Y2432毒株作为疫苗候选株,免疫鸡群后用2个抗原群的病毒攻毒,都能够完全保护。免疫持续期结果显示,Y2432灭活疫苗免疫鸡群后,14 d即可产生高水平抗体,最高可达到14.4 log2,且抗体可维持140 d以上,疫苗免疫原性和免疫保护效果较好,能达到临床使用要求。该疫苗为预防H9N2亚型禽流感的流行提供了重要技术储备。

