新辅助化疗联合PD-1抑制剂治疗三阴性乳腺癌的临床疗效
张晓宇 任悦 刘伟 苗彦玲 张辉 靳丽君 张恒乐 康晓宁 白杰 王遵义

摘要:目的 探討新辅助化疗联合PD-1抑制剂治疗三阴性乳腺癌的临床疗效及其对免疫功能的影响。方法 将80例三阴性乳腺癌患者随机分为对照组和观察组,每组40例。对照组接受多柔比星脂质体+环磷酰胺+白蛋白紫杉醇(AC-T)序贯化疗,观察组在对照组的基础上联合PD-1抑制剂治疗。所有患者完成免疫治疗及新辅助化疗3周后无手术禁忌证,均行乳腺癌改良根治术。比较2组患者的生活质量、临床疗效、手术时间、术中出血量、免疫指标及不良反应。结果 治疗后,观察组生活质量评分高于对照组(84.55±6.09 vs. 75.93±6.12,P<0.05)。治疗8个周期后,观察组完全缓解率(CRR)、CD4+、CD8+、CD4+/CD8+、IgG、IgA和IgM水平均优于对照组(P<0.05)。观察组手术时间[(43.25±6.85)min vs. (82.53±8.53)min]和术中出血量[(136.52±8.74)mL vs. (241.63±8.32)mL]均少于对照组(P<0.05);2组不良反应发生率差异无统计学意义(P>0.05)。结论 三阴性乳腺癌采用新辅助化疗联合PD-1抑制剂治疗可以有效改善患者免疫功能和生活质量,保证临床治疗的安全性。
关键词:免疫检查点抑制剂;放化疗,辅助;三阴性乳腺癌;生活质量;免疫,主动
中图分类号:R737.9 文献标志码:ADOI:10.11958/20221554
Clinical efficacy of neoadjuvant chemotherapy combined with PD-1 inhibitor in the
treatment of triple negative breast cancer
ZHANG Xiaoyu REN Yue LIU Wei MIAO Yanling ZHANG Hui JIN Lijun ZHANG Hengle KANG Xiaoning BAI Jie WANG Zunyi
1 Department of Thyroid and Breast Surgery Ⅲ, Cangzhou Central Hospital, Cangzhou 061000, China; 2 Graduate School, Hebei Medical University; 3 Department of Ultrasound Ⅱ, Cangzhou Central Hospital
Corresponding Author E-mail:181176788@qq.com
Abstract: Objective To investigate the clinical efficacy of neoadjuvant chemotherapy combined with PD-1 inhibitor in the treatment of triple negative breast cancer and its effect on immune function. Methods Eighty patients with triple negative breast cancer were randomly divided into the control group and the observation group, with 40 cases in each group. The control group received sequential chemotherapy of doxorubicin liposome + cyclophosphamide + albumin paclitaxel (AC-T), and the observation group was treated with PD-1 inhibitor on the basis of the control group. The quality of life, clinical efficacy, operation time, intraoperative blood loss, immune function and adverse reactions were compared between the two groups. Results After treatment, the SF-36 score was significantly higher in the observation group (84.55±6.09) than that of the control group (75.93±6.12, P<0.05). After 8 courses of treatment, the complete response rate (CRR), CD4+, CD8+, CD4+/CD8+, immunoglobulin IgG, IgA and IgM levels were significantly better in the observation group than those in the control group (P<0.05). The operative time [(43.25±6.85) min vs. (82.53±8.53) min] and intraoperative bleeding [(136.52±8.74) mL vs. (241.63±8.32) mL] were significantly decreased in the observation group than those of the control group (P<0.05). There was no significant difference in the incidence of adverse reactions between the two groups (P>0.05). Conclusion Neoadjuvant chemotherapy combined with PD-1 inhibitor in the treatment of triple negative breast cancer can improve the immune function and quality of life of patients, and ensure the safety of clinical treatment.
Key words: immune checkpoint inhibitors; chemoradiotherapy, adjuvant; triple negative breast neoplasms; quality of life; immunity, active
三阴性乳腺癌(triple negative breast cancer,TNBC)占乳腺癌总数的15%~20%。往往发病比较早,且具有很强的侵袭性,尚缺乏有效的治疗措施[1]。临床流行病学调查显示,TNBC较其他类型乳腺癌患者生存率低。程序性细胞死亡蛋白-1(PD-1)作为免疫球蛋白超家族的主要成员之一,是一种重要的免疫抑制分子。研究发现,PD-1的免疫调节在对抗肿瘤、感染、自身免疫性疾病以及促进移植器官存活等方面发挥着重要作用[2]。PD-1配体(PD-L1)也可以作为靶标,参与免疫调节。PD-1和PD-L1是重要的免疫检查点,共同启动T细胞的程序性死亡,使肿瘤细胞免疫逃逸[3]。然而,鉴于多种原因,乳腺癌患者仅有10%~30%的患者接受PD-1/PD-L1抑制剂治疗[4]。因此,如何进一步提高PD-1/PD-L1抑制剂的疗效成为国内外的研究热点。目前基于TNBC免疫治疗的联合治疗研究相对较少。本研究旨在探讨免疫治疗和化疗联合治疗能否增加单独化疗的抗肿瘤效应,同时观察两者联合对免疫指标的影响,从而指导临床治疗。
1 对象与方法
1.1 研究对象
选取2019年5月—2022年2月沧州市中心医院肿瘤外科经病理及免疫组化染色证实均为TNBC的80例女性患者作为研究对象。按照随机数字表法将其分为对照组和观察组,每组40例。所有患者均经病理活检确诊为乳腺癌,此前均未接受任何化疗、激素治疗或放疗,常规检查未见远处转移及器官损害。观察组患者年龄44~57岁,平均(50.35±3.98)岁,病程1~1.6年,平均(1.28±0.16)年。对照组年龄43~58岁,平均(50.25±3.85)岁,病程0.9~1.8年,平均(1.33±0.23)年。2组年龄(t=0.114)、病程(t=1.129)差异均无统计学意义(P>0.05),具有可比性。
纳入标准[5]:(1)均符合中国抗癌协会2008年版乳腺癌诊断标准,病理诊断为ⅡB期或Ⅲ期。(2)新辅助化疗(NAC)前麦默通针或空心针活检。(3)病理结果完整,腋窝淋巴结转移。剔除标准:(1)严重心、肝、肾等器官功能障碍,急慢性传染病及其他恶性肿瘤患者。(2)妊娠或哺乳期。(3)已有远处转移。(4)对研究药物过敏或有使用禁忌证。(5)预估生存期小于3个月。(6)临床资料不完整或不愿意签署知情同意书。本研究得到了医院伦理委员会的批准[伦理号:2021-134-02(z)],所有患者均签署知情同意书。
1.2 研究方法
1.2.1 术前治疗
对照组术前采用多柔比星脂质体+环磷酰胺+白蛋白紫杉醇(AC-T)新辅助序贯化疗,观察组在对照组基础上联合PD-1抑制剂治疗。
AC-T序贯化疗方案。AC:第1天,静脉注射盐酸多柔比星脂质体30 mg/m2,环磷酰胺600 mg/m2;21 d为1周期,连续治疗4个周期。前4个治疗周期完成后序贯T:第1天,静脉滴注白蛋白紫杉醇,每3周给药1次,每次260 mg/m2,21 d为1周期,连续治疗4个周期;序贯T治疗同期,观察组患者进行PD-1抑制剂(特瑞普利单抗240 mg)静脉滴注,21 d为1周期,共治疗4个周期。如果患者有任何不适或不良反应,应及时报告上级医师,并采取相应的治疗措施。
1.2.2 手术治疗
所有患者完成免疫治疗及新辅助化疗8个周期结束3周后,且无手术禁忌证情况下行乳腺癌改良根治术。所有手术均由同一组人员完成。
1.3 观察指标
(1)比较2组治疗前后的免疫指标。(2)利用SF-36量表评估2组患者的生活质量,满分为100分,得分与生活质量成正比。(3)临床疗效:治疗8个周期后,根据实体瘤疗效评价标准,完全缓解(complete response,CR)定义为所有病灶完全消失并维持≥3周。(4)比较2组手术时间、术中出血量及胃肠道反应、白细胞减少、肝功能障碍、静脉炎的发生率。
1.4 免疫指标检测
分别于新辅助化疗前和新辅助化疗结束后3周(手术前)采用美国贝克曼库尔特Epics XL型流式细胞仪以及配套试剂盒测定外周血T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)。使用日立008AS生化分析仪,采用免疫比浊法测定IgG、IgA、IgM。所有操作均严格按照说明书进行。
1.5 统计学方法
采用SPSS 27.0軟件处理数据。计量资料以均数±标准差(x±s)表示,组间比较采用成组t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者临床疗效比较
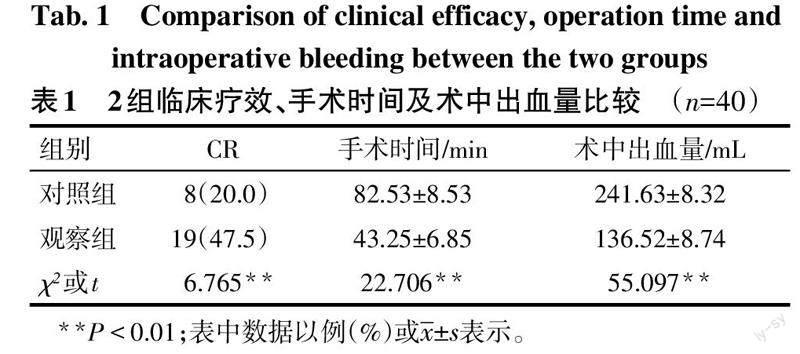
治疗8个周期后,观察组的完全缓解率(CRR)高于对照组,手术时间和术中出血量均低于对照组(P<0.01),见表1。
2.2 2组患者免疫指标比较
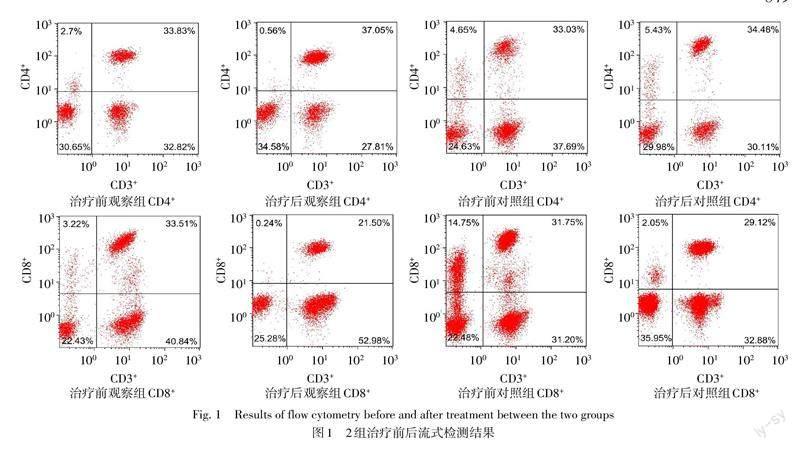
新辅助化疗前2组患者CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM水平差异无统计学意义;新辅助化疗8个周期结束后3周(手术前),观察组前述指标均优于对照组(P<0.05),见表2。流式细胞图见图1。
2.3 2组生活质量比较
治疗前,2组生活质量评分差异无统计学意义;治疗后,观察组患者生活质量优于对照组(P<0.01)。见表3。
2.4 2组不良反应发生情况比较
对照组患者术后并发胃肠道反应、白细胞减少、肝功能障碍及静脉炎;观察组无静脉炎发生。2组不良反应发生率差异无统计学意义(52.5% vs. 40.0%,P>0.05)。见表4。
3 讨论
3.1 TNBC的特点
TNBC具有恶性程度高、侵袭性强、内分泌治疗和靶向治疗效果差、易转移和复发、预后差的特点[6-7]。由于乳腺癌主要发生在乳腺的腺上皮细胞中,并且乳腺不是支持人类生命活动的主要靶器官,因此乳腺原位肿瘤对人体的影响较小[8]。乳腺肿瘤细胞一旦失去正常的特性,就会导致细胞间连接的松弛和分裂,肿瘤细胞经血液和淋巴流向全身并诱发转移,危及患者的生命安全[9-10]。
3.2 乳腺癌手术的治疗特点
目前,大多数乳腺癌患者采用保乳手术治疗,该术式既弥补了改良根治术的缺陷,保留了患者正常的乳腺组织,又最大程度地减轻了患者的心理负担[11]。相关研究表明,对于紫杉类+蒽环类+环磷酰胺治疗后符合保乳适应证的晚期乳腺癌患者,保乳手术是一种安全可行的方法[12]。对于TNBC,保乳术前新辅助化疗联合AC-T序贯化疗效果好,不良反应少。但保乳手术并不适合所有乳腺癌患者,仍有许多患者不能满足保乳手术的适应证,因而改良根治术的应用仍然广泛。乳腺癌的肿瘤细胞会通过血液循环转移到身体的各个器官。因此,单一的手术治疗不能完全杀死肿瘤细胞,术后转移率和复发率仍然较高,这也是制约手术顺利开展的主要因素。近年来,新辅助化疗已广泛应用于肿瘤的治疗,其不仅可以治疗局部晚期乳腺癌,还可用于乳腺癌手术治疗的早期干预[13]。本研究结果也显示治疗8个周期后,观察组CRR高于对照组,观察组的手术用时、术中出血量均少于对照组。因此,这种潜在治疗方法值得推广。
3.3 免疫治疗的特点
近年来,免疫治疗已成为恶性肿瘤治疗的一种新方法。结合传统化疗和放疗的综合治疗策略已成为研究热点[14]。PD-1/PD-L1作为一种免疫检查点,具有免疫抑制因子的功能,可以抑制T淋巴细胞的活化和增殖,降低免疫系统的活性,该信号通路的激活是恶性肿瘤细胞逃避免疫杀伤的重要环节之一[15]。基于此,PD-1/PD-L1抑制剂可以靶向抑制PD-1/PD-L1活性,通过单克隆抗体及其受体结合抑制其负调控作用,恢复免疫系统活性,减少肿瘤的免疫逃逸[16]。研究发现,免疫检查点通路在肿瘤逃逸机制中起负向调节作用[17]。相关研究發现乳腺癌患者外周血T淋巴细胞亚群、CD3+、CD4+、CD8+及CD4+/CD8+水平均低于正常对照组,提示患者T淋巴细胞总数减少,免疫功能减弱[18]。T淋巴细胞总数的减少可促进肿瘤的增殖和生长。可见,乳腺癌的发生、发展及预后与患者的免疫功能密切相关。研究证实,阻断PD-1/PD-L1信号通路可激活并上调CD8+T细胞的表达,提高其抗肿瘤活性,诱导肿瘤细胞表面主要组织相容性复合体分子表达,使更多肿瘤细胞暴露于免疫细胞[19]。本研究也显示,观察组采用新辅助化疗联合PD-1抑制剂治疗后CD4+、CD8+、CD4+/CD8+均有所升高,且优于对照组,表明新辅助化疗联合PD-1抑制剂治疗TNBC能够增强患者机体免疫力,抑制肿瘤细胞生长,从而缩小原发灶。此外,本研究也发现,治疗后观察组生活质量优于对照组,2组不良反应发生率无明显差异。
综上所述,TNBC采用新辅助化疗联合PD-1抑制剂治疗可以有效提高患者免疫功能,改善患者生活质量,并保证临床治疗的安全性。相比单纯新辅助化疗,联合PD-1抑制剂的抗肿瘤效应更高,为后续手术创造了条件,降低了手术难度,提高了手术效果,对TNBC的治疗有较高的临床应用价值。
参考文献
[1] YIN L,DUAN J J,BIAN X W,et al. Triple-negative breast cancer molecular subtyping and treatment progress[J]. Breast Cancer Res,2020,22(1):61. doi:10.1186/s13058-020-01296-5.
[2] KWAPISZ D. Pembrolizumab and atezolizumab in triple-negative breast cancer[J]. Cancer Immunol Immunother,2021,70(3):607-617. doi:10.1007/s00262-020-02736-z.
[3] WON K A,SPRUCK C. Triple-negative breast cancer therapy:current and future perspectives (Review)[J]. Int J Oncol,2020,57(6):1245-1261. doi:10.3892/ijo.2020.5135.
[4] LEON-FERRE R A,HIEKEN T J,BOUGHRY J C. The landmark series:neoadjuvant chemotherapy for triple-negative and HER2-positive breast cancer[J]. Ann Surg Oncol,2021,28(4):2111-2119. doi:10.1245/s10434-020-09480-9.
[5] KEENAN T E,TOLANEY S M. Role of immunotherapy in triple-negative breast cancer[J]. J Natl Compr Canc Netw,2020,18(4):479-489. doi:10.6004/jnccn.2020.7554.
[6] EMENS L A. Breast cancer immunotherapy:facts and hopes[J]. Clin Cancer Res,2018,24(3):511-520. doi:10.1158/1078-0432.CCR-16-3001.
[7] BERGIN A R T,LOI S. Triple-negative breast cancer:recent treatment advances[J]. F1000Res,2019,8:F1000 Faculty Rev-1342. doi:10.12688/f1000research.18888.1.
[8] LYONS T. Targeted therapies for triple-negative breast cancer[J]. Curr Treat Options Oncol,2019,20(11):82. doi:10.1007/s11864-019-0682-x.
[9] ZHU Y,ZHU X,TANG C,et al. Progress and challenges of immunotherapy in triple-negative breast cancer[J]. Biochim Biophys Acta Rev Cancer,2021,1876(2):188593. doi:10.1016/j.bbcan.2021.188593.
[10] MARRA A,CURIGLIANO G. Adjuvant and neoadjuvant treatment of triple-negative breast cancer with chemotherapy[J]. Cancer J,2021,27(1):41-49. doi:10.1097/PPO.0000000000000498.
[11] NEDELJKOVI? M,DAMJANOVI? A. Mechanisms of chemotherapy resistance in triple-negative breast cancer-how we can rise to the challenge[J]. Cells,2019,8(9):957. doi:10.3390/cells8090957.
[12] GARRIDO-CASTRO A C,LIN N U,POLYAK K. Insights into molecular classifications of triple-negative breast cancer:improving patient selection for treatment[J]. Cancer Discov,2019,9(2):176-198. doi:10.1158/2159-8290.CD-18-1177.
[13] TARANTINO P,GANDINI S,TRAPANI D,et al. Immunotherapy addition to neoadjuvant chemotherapy for early triple negative breast cancer:a systematic review and meta-analysis of randomized clinical trials[J]. Crit Rev Oncol Hematol,2021,159:103223. doi:10.1016/j.critrevonc.2021.103223.
[14] SPORIKOVA Z,KOUDELAKOVA V,TROJANEC R,et al. Genetic markers in triple-negative breast cancer[J]. Clin Breast Cancer,2018,18(5):e841-e850. doi:10.1016/j.clbc.2018.07.023.
[15] WAKS A G,WINER E P. Breast cancer treatment:a review[J]. JAMA,2019,321(3):288-300. doi:10.1001/jama.2018.19323.
[16] CHAUDHARY L N,WILKINSON K H,KONG A. Triple-negative breast cancer:who should receive neoadjuvant chemotherapy?[J]. Surg Oncol Clin N Am,2018,27(1),141-153. doi:10.1016/j.soc.2017.08.004.
[17] POGGIO F,BRUZZONE M,CEPPI M,et al. Platinum-based neoadjuvant chemotherapy in triple-negative breast cancer:a systematic review and meta-analysis[J]. Ann Oncol,2018,29(7):1497-1508. doi:10.1093/annonc/mdy127.
[18] EMENS L A. Immunotherapy in triple-negative breast cancer[J]. Cancer J,2021,27(1):59-66. doi:10.1097/PPO.0000000000000497.
[19] BORRI F,GRANAGLIA A. Pathology of triple negative breast cancer[J]. Semin Cancer Biol,2021,72:136-145. doi:10.1016/j.semcancer.2020.06.005.
(2022-10-08收稿 2023-02-10修回)
(本文編辑 李鹏)

