双模板分子印迹材料固相萃取-高效液相色谱法联用测定果蔬中三嗪类农药
刘建辉,巩碧钏,胡秋辉,苏安祥,徐 辉,谢旻皓,杨文建
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省食用菌保鲜与深加工工程研究中心,江苏 南京 210023)
三嗪类除草剂因其高效、广谱、廉价等作用特点,在全球范围内普遍使用,且广泛应用于果蔬等农作物的生产中[1]。然而,该类除草剂的立体化学反应稳定性高,环境持久性长,在施用过程中可迁移至水体、土壤和农作物,进而进入至人体,对人体产生致癌和内分泌干扰等不可逆的副作用,严重危害人类健康[2-3]。此外,三嗪类农药可产生多种降解产物,如脱乙基莠去津、脱异丙基莠去津和羟基化莠去津等[4],其毒性类似或更甚于原物质[5]。目前,已在土壤、地下水、饮用水、农作物、水生动物等中均能检测到三嗪类除草剂及其降解物残留[6-7]。三嗪可以吸附到水果或蔬菜的表面/表皮,并最终渗透到水果或蔬菜的果肉中[8]。
针对三嗪类除草剂极易在环境与食物中残留从而对生物体带来严重危害,许多国家都对食品中的残留量进行了限制,例如欧盟已经停止了该类除草剂在农业生产中的应用,美国环保署将其列入了优先控制的污染物名单[9]。我国最新GB 2763—2021《食品中农药最大残留限量》对蔬菜、水果、谷类、油料和油脂中三嗪类除草剂的最大残留限量为0.01~0.5 mg/kg[10]。但因其极易残留的特点,仍需建立高效的检测方法以监测其在环境与食品中的残留。然而,农作物样品基质复杂,且三嗪类农药代谢物通常以结合状态存在,因此在检测前的样品前处理过程比较繁琐。在众多已报道的前处理方法中,固相萃取技术应用最广。但通用型的固相萃取柱如C键合硅胶等非选择性的吸附溶剂,选择性和特异性差,难以用于复杂基体中微量物质的吸附萃取[11]。因此,开发一种净化富集能力强的前处理技术,对于检测复杂样品中三嗪类化合物具有重要意义。
分子印迹聚合物(molecularly imprinted polymers,MIPs)对目标分子(称为“模板”)具有结合性能高、特异性强和稳定性好等优点,特别适用于痕量分析[12]。孔光辉等[13]以莠去津为模板建立了分子印迹固相萃取方法,可萃取并检测烟叶中的三嗪类除草剂。Zhou Tianyu等[14]制备了阿特拉津MIPs,其工艺简单、成本低,并通过结合MIPs固相萃取与高效液相色谱-质谱(high performance liquid chromatograph-mass spectrometry,HPLC-MS)技术,成功吸附并检测了茶叶样品中的三嗪类化合物。但目前多数MIPs只停留在针对单一模板的印迹聚合物的制备,识别位点单一,不能对多种三嗪类目标分子产生特异性作用[15]。而使用两种或多种结构类似物作为模板,多模板分子印迹可以扩展单模板分子印迹的应用,以实现同时识别、提取和分离一种以上分析物[16-17]。
本研究团队前期制备了以灭蝇胺为虚拟模板的MIPs,提高了三嗪类农药的检测效率和精度[18]。由于三嗪类除草剂的特性官能团为三嗪环,除选取灭蝇胺外,也可联用同样结构相似的三聚氰胺作为替代的双虚拟模板分子[19]。为进一步增加识别与吸附位点,提高对三嗪类化合物的吸附效率,本研究拟联用灭蝇胺和三聚氰胺,开发双虚拟模板分子印迹聚合物,并对材料进行优化与吸附性能表征,联合应用HPLC法检测苹果、黄瓜、玉米等果蔬中的三嗪类农药残留。
1 材料与方法
1.1 材料与试剂
苹果、黄瓜、玉米等样品 江苏省南京市苏果超市;农药标准品灭蝇胺、三聚氰胺、阿特拉津、扑草净、西草净、莠灭净、吡虫啉(纯度均大于98%)以及甲基丙烯酸(methacrylic acid,MAA)、乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EGDMA)、三羟甲基丙烷三甲基丙烯酸酯(trimethylpropane trimethacrylate,TRIM)、偶氮二异丁腈(azobisisobutyronitrile,AIBN)(均为分析纯)、乙腈(色谱纯)美国Sigma公司;冰乙酸、甲醇、三氯甲烷(均为分析纯)上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Nicolet 6700傅里叶变换红外光谱仪 美国Thermo Fisher公司;DZ-3BCII真空干燥箱 上海奥析科学仪器有限公司;ZNCL-G15型智能磁力搅拌器 河南爱博特科技发展有限公司;Allegra 64R离心机 美国贝克曼库尔特公司;固相萃取装置 美国Supelco公司;SU8010扫描电镜 日本Hitachi公司;1260系列HPLC仪 美国Agilent公司;HSC-24A氮吹仪 南京科捷分析仪器有限公司。
1.3 方法
1.3.1 双模版MIPs制备及优化
称取0.6 mmol灭蝇胺、0.4 mmol三聚氰胺和4 mmol MAA,向其中加入15 mL乙腈-水溶液(3∶1,V/V)进行混合,超声30 min以使其预聚合。之后向其中加入与功能单体MAA等量的交联剂TRIM,以及30 mg AIBN再进行超声5 min,之后为排除其中氧气,置于氮吹仪中通入氮气5 min。封闭混合液后再将其置于60 ℃水浴条件下持续24 h。反应结束之后获得块状双模版分子聚合物,采用甲醇-乙酸(4∶1,V/V)溶液将研磨后的模板分子洗脱,用HPLC仪检测直至提取液中无模板分子存在。所得印迹聚合物分别用甲醇和水冲洗3 次以上,于60 ℃真空干燥。非印迹聚合物(non-imprinted polymers,NIPs)作为对照,其制样方法与MIPs相同,区别在于无须添加两种模板分子。同时,为使MIPs的吸附量达到最佳,选取不同的制孔剂(乙腈与三氯甲烷)、交联剂(EGDMA和TRIM)以测定MIPs的吸附量,并且对双模板中灭蝇胺与三聚氰胺的含量进行优化。
1.3.2 双模板分子印迹聚合物表征
1.3.21 红外光谱表征
将干燥溴化钾粉末充分研磨,用压片机压片,测定其红外光谱以调整基线。称取5 mg干燥的MIPs、NIPs和灭蝇胺、三聚氰胺标品以及溴化钾粉末,研磨均匀并压成薄片,于4000~500 cm-1范围分别扫描,以表征其红外光谱[20]。
1.3.22 扫描电镜表征
将导电胶涂抹并分散在待测试样上,并对试样再镀金处理,在扫描电镜下观察试样结构。
1.3.3 双模板分子印迹聚合物吸附性能
1.3.31 动力学吸附实验
分别称量10 mg MIPs与NIPs,溶于80 mg/L的扑草净标准溶液中并于25 ℃水浴中充分搅拌。于不同时间点(15、30、60、90、120、150、180、210、240 min)进行取样,离心后取上清液,过0.22 μm滤膜,应用HPLC检测其含量,并利用式(1)计算试样对扑草净溶液的吸附量(Q):
式中:Q为平衡状态时聚合物对目标分子的吸附量/(μ g/g);C0为标准农药溶液的初始质量浓度/(m g/L);C为标准农药溶液的平衡质量浓度/(mg/L);V为所加农药溶液的体积/mL;M为MIPs或NIPs的添加量/mg。
1.3.32 静态吸附实验及Scatchard模型拟合
准确称量双模版MIPs和非印迹聚合物NIPs各10 mg,加入1 mL不同质量浓度(25、50、75、100、125、150、175、200 mg/L)扑草净标准溶液。在25 ℃恒温环境下振荡2 h,5000 r/min离心10 min后采用HPLC方法测定上清液中目标分析物的浓度。利用式(1)计算MIPs、NIPs对扑草净溶液的吸附量。
按照式(2)绘制Scatchard标准曲线,据此得出聚合物的吸附常数Kd与最大表观吸附量Qmax。
式中:Q为聚合物对目标分子的吸附量/(μg/g);C为目标物质的平衡浓度/(mg/L);Qmax为吸附位点的最大表观结合量/(μg/g);Kd为吸附位点的解离平衡常数/(μg/L)。
1.3.33 选择性吸附实验
将10 mg MIPs分别与1 mL的扑草净、阿特拉津、莠灭净、西草净以及吡虫啉农药标准溶液(80 mg/L)混合均匀,并置于室温混合2 h,利用HPLC测定上层清液的浓度。同时作为对照,按同样方法测定MIPs对灭蝇胺和三聚氰胺的吸附能力。计算双模版MIPs的印迹因子和选择性指数以评判其特异性吸附能力[21]。
1.3.4 HPLC检测条件
待测液制备好后,HPLC仪装备C18色谱柱(250 mm×4.6 mm,5 μm),上样量为10 μL,以甲醇-水(7∶3,V/V)作为流动相,流速为0.8 mL/min,检测柱温为30 ℃。
1.3.5 MIPs固相萃取柱的制备及优化
采用干法装柱的方式,MIPs的填柱量为30 mg,装入固相萃取柱中,压实填料后制成分子印迹固相萃取柱(molecularly imprinted solid phase extraction column,MISPE)。以扑草净为例,考察不同洗脱条件下,MISPE对其吸附能力。采用6 mL乙腈-水溶液(3∶1,V/V)对所制备的萃取柱进行活化;制备4 种三嗪类农药混合标准溶液,取1 mL进行上样;以3 mL甲苯溶液进行淋洗;3 mL 5%乙酸-乙腈溶液进行洗脱。获得的溶液经氮气吹干后复溶于1 mL乙腈中。采用同样操作,以常规C18固相萃取柱作为对照。
1.3.6 方法学评价
将含有三嗪类杀虫剂的黄瓜、苹果和玉米样品切碎,分别取5 g,向其中加入20 mL乙腈并充分混匀,重复离心合并上清液。取1 mL氮气吹干,再溶于等量乙腈-水溶液,依照优化后的MISPE制备方法进行HPLC检测。
1.3.7 吸附再生性实验
采用所制备的双模板MISPE,重复检测4 种三嗪类杀虫剂,以50 μg/L乙腈溶液洗脱共20 次,其中每5 次测定其三嗪类农药的含量。
1.4 统计分析
2 结果与分析
2.1 双模板分子印迹聚合物制备条件优化
由于不同模板分子间含有固定形状的孔穴,其独特的化学性质决定模板分子的特异性吸附功能,所以在预组装阶段中,模板分子之间的配比会使最终的共聚物产生不同的结合位点与吸附活性[22]。表1表明,灭蝇胺和三聚氰胺这两种模板分子物质的量之比为3∶2时,所制备的印迹聚合物吸附量最大(2.36~2.93 mg/g)。以乙腈作为制孔剂时,其聚合物吸附量(0.71~2.93 mg/g)高于三氯甲烷(0.42~1.84 mg/g),且易研磨,因此选用乙腈作为制孔剂。交联剂可选用二元交联剂EGDMA和三元交联剂TRIM,它们分别与模板分子按物质的量比1∶20与1∶4进行交联制备印迹聚合物,比较发现选取TRIM为交联剂时MIPs的吸附量更优,这归因于其更易产生聚合度更强的交联网状结构[23]。因此,最终的制备体系选用灭蝇胺和三聚氰胺3∶2混合为双模板分子,MAA为功能单体,TRIM为交联剂,且三者的物质的量比为1∶4∶4,此条件下MIPs识别性能和吸附量最佳。

表1 聚合体系的设计和优化Table 1 Design and optimization of polymerization system
2.2 MIPs的形态结构表征
2.2.1 红外光谱分析
采用红外吸收光谱实验对MIPs、NIPs以及模板分子三聚氰胺的表面化学特征进行表征与比较,结果如图1所示。MIPs与NIPs均在1733、1455、1155 cm-1处分别含有C=O、O—H和C—O—C 3 个特征峰,证明成功进行本体聚合反应。除此之外,对于MIPs来说,在1551 cm-1处已经没有三聚氰胺的特征吸收峰,说明其中的模板分子已完全洗脱[24]。
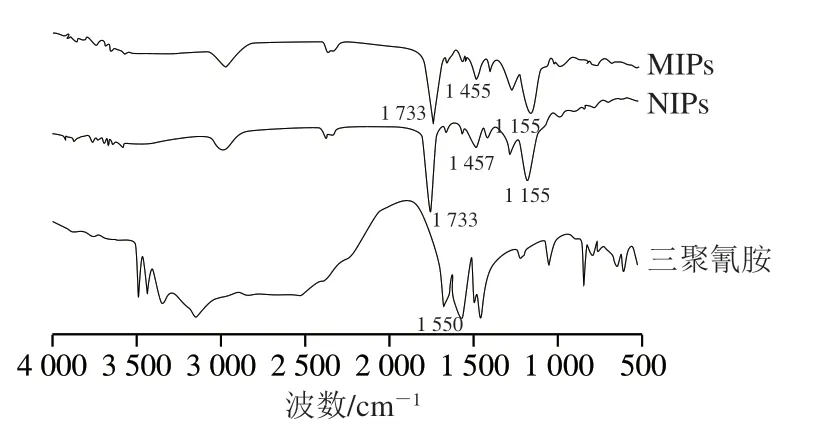
图1 MIPs、NIPs和三聚氰胺的红外光谱图Fig.1 Infrared spectra of MIPs,NIPs and melamine
2.2.2 MIPs和NIPs的扫描电镜分析
为获得聚合物的微观形貌,利用扫描电镜对MIPs(图2A)和NIPs(图2B)进行更进一步观测。结果显示,与NIPs相比,MIPs聚合物显示成微球状,其表面褶皱程度更为丰富。可认为MIPs的比表面积更大,且结合位点更多,且宏观表现上其吸附效果优于NIPs。而对于NIPs来说,其中并无模板分子印迹,因此其分子结合形态呈不规律状。

图2 MIPs(A)和NIPs(B)的扫描电镜形态(×30000)Fig.2 Scanning electron micrographs of MIPs (A) and NIPs (B) (× 30000)
2.3 三嗪类MIPs的吸附性能
2.3.1 静态吸附实验及Scatchard模型拟合分析
通常静态吸附实验可以用来判断MIPs的吸附能力,如图3所示。图3A表明,随着三嗪农药扑草净的浓度增加,MIPs和NIPs对其吸附能力都明显增强,说明两者都具有一定水平的物理吸附能力。然而在各个质量浓度下,MIPs比NIPs具有更高的吸附量。可能由于MIPs聚合物分子中产生与三嗪类农药分子结构特异性结合的孔穴,产生了额外的物理吸附与化学吸附。而对于不含特异性结合位点的NIPs来说,其吸附能力相对较差[25]。
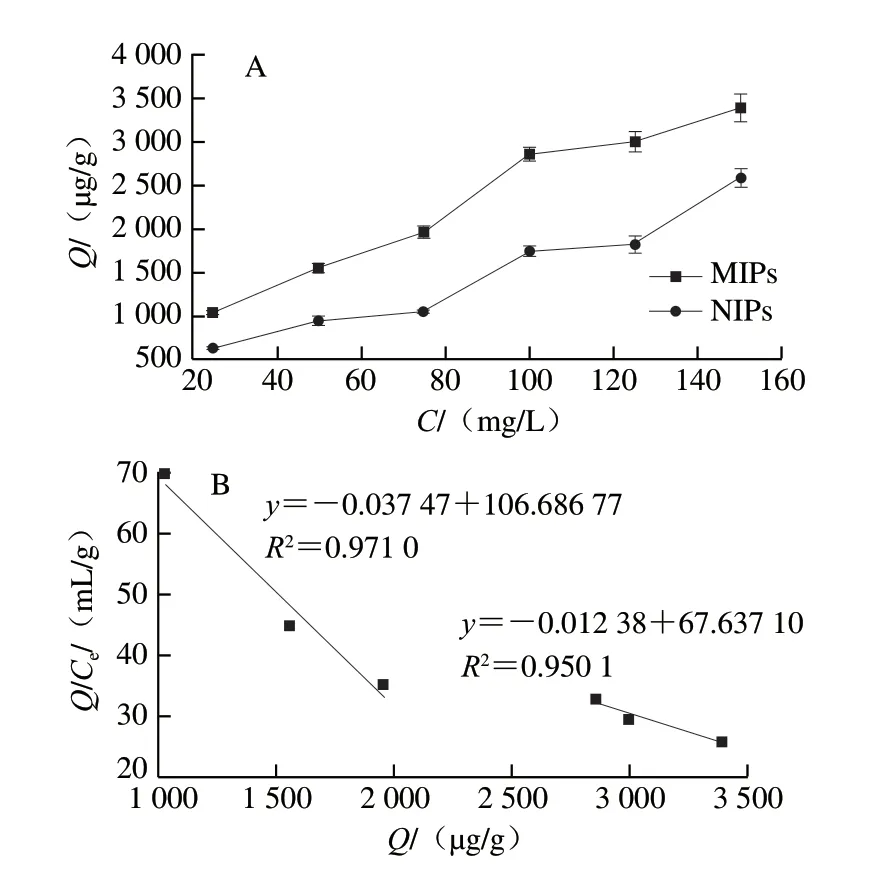
图3 MIPs和NIPs的静态吸附实验(A)及Scatchard模型(B)分析Fig.3 Static adsorption characteristics (A) and Scatchard model analysis (B) of MIPs and NIPs
图3B为聚合物的Scatchard模型拟合图,图中各点并不呈线性,但进行线性拟合后,可看成是斜率不同的两条线性直线,证实所制备的MIPs中含有两个特异性结合位点[26]。通过两个拟合线性方程的斜率和截距,计算出该聚合物的两种吸附位点的最大吸附量分别为2.85、5.46 mg/g,结合常数分别为26.688、80.775 mg/L。
2.3.2 吸附动力学分析
动态吸附及动力学模型通常用于反映吸附反应的速率及随时间变化的规律,由图4可知,在前100 min,吸附曲线斜率比较大,说明MIPs与NIPs吸附比较快速,且随着时间延长吸附量呈上升趋势。而在100 min之后,MIPs与NIPs的吸附曲线较为平缓,都逐步达到吸附平衡状态。然而,在吸附过程中,MIPs表现出比NIPs更快的吸附速度,而且在吸附平衡时其对三嗪类农药扑草净的吸附量也更高,这是由MIPs的特定孔穴所导致的特异性吸附[27]。

图4 MIPs和NIPs的吸附动力学Fig.4 Adsorption kinetics of MIPs and NIPs
2.3.3 选择性吸附实验分析
对7 种典型三嗪类农药进行选择性吸附,MIPs与其对照NIPs对农药的吸附量(Q)、印迹因子(imprinting factors,IF)和选择性指数(selectivity index,SI)如表2所示。不同种类农药的IF均大于1,说明MIP对相应农药的吸附作用是NIPs的1 倍以上。吡虫啉属于氯化烟酰类杀虫剂,由表2可知,MIPs与NIPs对其吸附量大体一致,证实MIPs对三嗪类杀虫剂呈现出更优良的选择性。此外,由于吡虫啉是含氮结构类似物,和模板分子相比具有不同的结构,无法适应聚合物中的特异性孔穴,故吸附率最低[28]。灭蝇胺和三聚氰胺双模板MIPs可以增强吸附能力,是由于两者在和交联剂发生共聚反应时产生了协同作用,优化了印迹孔穴,从而呈现出最匹配的结合状态[29]。此外,在模板分子聚合物中形成孔穴时,体积大的模板分子有助于大空隙的形成,从而更利于分子吸附进程[30]。
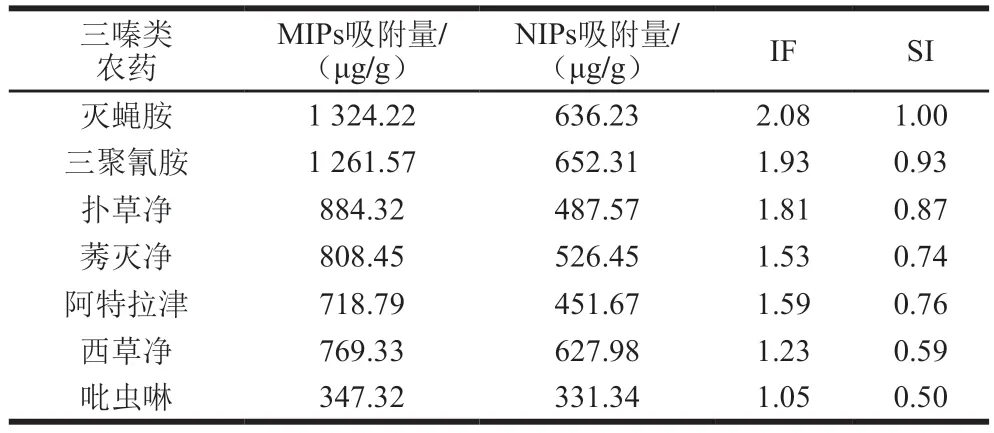
表2 聚合物对不同底物的印迹因子与选择性指数Table 2 IF and SI of polymers for different pesticide compounds
2.4 双模板分子印迹固相萃取条件的优化
为优化淋洗条件,选用甲苯、乙腈、二氯甲烷、水为淋洗液,HPLC检测后得到目标分析物的回收率,如图5所示。当乙腈和二氯甲烷作为淋洗液时,三嗪类农药的回收率相对最低。而甲苯作为淋洗剂时,回收率相对最高,淋洗损失量最少。这是由于甲苯中甲基较小,所引起的极性非常弱,而且其溶解性比较好,能够减少三嗪类农药的淋洗损失[31]。

图5 不同淋洗液对固相萃取回收率的影响Fig.5 Influence of different single eluents on the recovery of solid phase extraction
同时,洗脱液的优化也有助于分析物后续的洗脱过程,一般选用极性较强的溶剂[32]。分别选择乙腈、甲醇、乙酸-甲醇(5%、10%)、乙酸-乙腈(5%、10%)作为洗脱液,对目标分析物分别洗脱后经HPLC检测。如图6所示,选取5%乙酸-乙腈时,回收率最高,说明其洗脱效果最好。
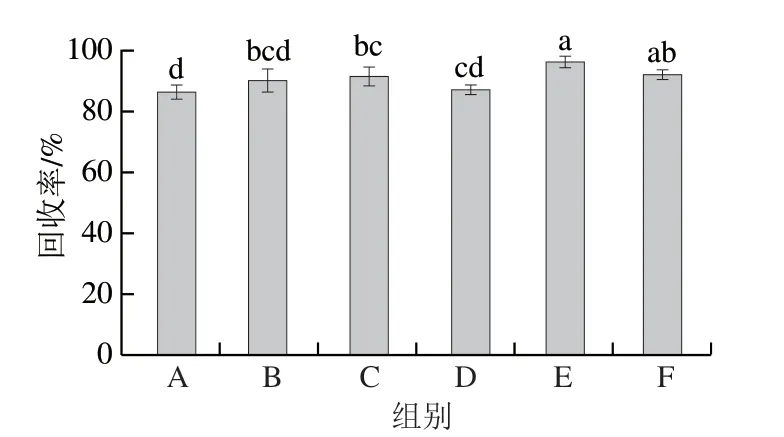
图6 不同洗脱液对固相萃取回收率的影响Fig.6 Influence of different binary eluents on the recovery of solid phase extraction
通过条件优化,确定最终MIPs的填柱量为30 mg,装入固相萃取柱后制成MISPE柱。3 mL乙腈和等体积水配比作为活化液,取1 mL上样液,以3 mL甲苯溶液为淋洗液,3 mL 5%乙酸-乙腈溶液为洗脱液,进行HPLC检测,以获得最大的回收率。
2.5 方法学评价
2.5.1 线性范围与检出限
配制含4 种三嗪类农药的混合标准溶液,按照优化的条件进行HPLC测定,所得线性方程的相关参数如表3所示。这些三嗪类农药线性方程的线性系数均大于0.99,线性范围均在0.05~1.00 µg/mL之间。阿特拉津的检出限为0.02 ng/mL,西草净为0.03 ng/mL,扑草净和莠灭净分别为0.01 ng/mL。
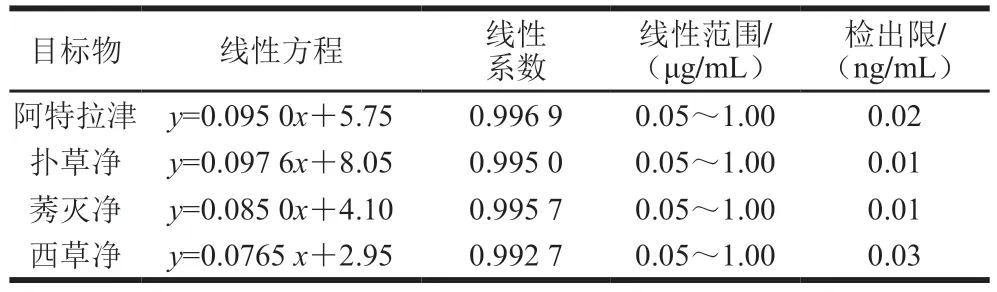
表3 4 种三嗪类农药的线性方程参数与检出限Table 3 Linear relationships and detection limits of four triazine pesticides
2.5.2 常规固相萃取与分子印迹固相萃取的检测
以黄瓜加标样品的(0.1 μg/mL)检测为例,分别对MISPE柱和C18柱的吸附能力进行检测,结果见图7。结果表明,与C18柱相比,经MISPE柱萃取过后,降低了黄瓜中色素等杂质的含量,同时也实现了对三嗪类农药的富集。
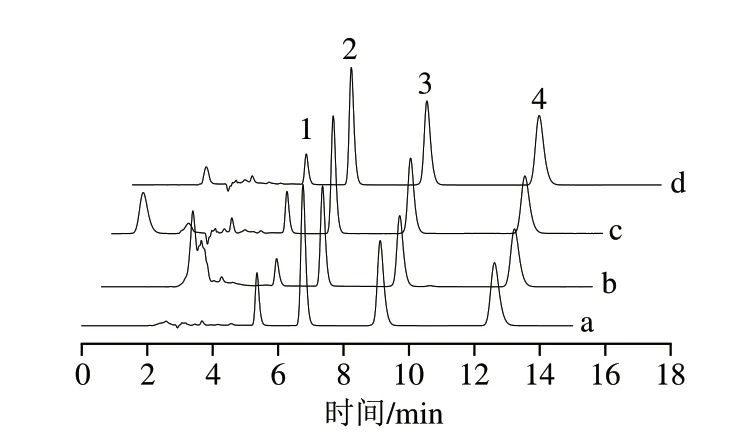
图7 加标黄瓜样品提取图Fig.7 Extracted ion chromatograms of spiked cucumber samples
2.5.3 回收率与精密度实验
为验证双模版MIPs固相萃取-HPLC联用对三嗪类杀虫剂的测定效果,分别检测3 种果蔬样品中三嗪类农药,得到平均回收率和相对标准偏差进行测定,结果见表4。在加标质量浓度为0.1、0.25、0.5 μg/mL时,黄瓜样品中阿拉特津、扑草净、莠灭净和西草净的平均回收率均在85.1%~102.3%之间,相对标准偏差在2.3%~6.8%之间。苹果样品中各分析物的平均回收率在75.2%~95.2%,相对标准偏差在2.4%~5.7%之间;玉米样品中平均回收率在85.2%~95.3%之间,相对标准偏差在2.6%~5.1%之间。由此可知,该双模版MISPE柱满足果蔬中三嗪类农药的特异性检测要求,检出限低、精密度高。

表4 回收率和精密度实验Table 4 Recoveries and precision RSD
2.5.4 重复使用实验
采用所制备的MISPE柱进行重复上样,共20 次,其中每隔5 次检测洗脱液中的阿拉特津、扑草净、莠灭净和西草净4 种三嗪类农药含量,回收率结果见表5。重复使用15 次后,回收率仍保持在80%以上,说明MISPE柱可重复性好。

表5 分子印迹固相萃取柱的重复利用率Table 5 Reusability of MISPE%
2.5.5 材料性能评价
将本检测方法与其他测定三嗪类除草剂的方法进行比较,表6显示出吸附剂类型、检测方法、检出限、回收率等方面的对比。与其他报道的方法相比,该方法制备的吸附材料具有较好的回收率和相似/更低的检出限,表明该方法具有灵敏度高、精确度好、检出限低的优点。
3 结论
以灭蝇胺和三聚氰胺为双模板分子,其物质的量之比为3∶2,且采用MAA为功能单体,TRIM为交联剂时,制备的双模版分子印迹聚合物材料MIPs的吸附性能为最优。对其吸附性能进行评价,表现出比NIPs更高的吸附量和良好的选择性,说明两种模版分子在和交联剂相互作用产生共聚反应时,产生协同作用。通过联用MIPs固相萃取-HPLC法以检测黄瓜、苹果和玉米中4 种三嗪类农药,在加标质量浓度为0.1~0.5 μg/mL时,平均回收率为83.2%~102.3%,标准标准偏差为2.3%~6.8%,且检出限较低。该方法简单、准确,明显增强了检测效率和精密度,能适用于三嗪类农药的痕量检测,在农药残留的定性定量分析中具有较好的应用前景。

