黄瓜β-酮脂酰辅酶A 合成酶基因CsKCS11 的功能初步分析
韦明月,郭孝文,邱嘉鑫,宋怡颖,柴乖强,2,段义忠,2
(1.榆林学院生命科学学院 陕西榆林 719000; 2.陕西省陕北矿区生态修复重点实验室 陕西榆林 719000)
植物表皮是植物体与其所处的环境直接接触的部位,包括角质层和蜡质层[1-2]。其中,植物表皮蜡质是覆盖在陆生植物表面的一层透明晶状体,是一种不溶于水的有机混合物,其主要成分由烷烃、脂肪酸、醛、初级醇、次级醇、酯类等组成。研究表明,植物表皮蜡质具有调节植物非气孔性水分散失、抵御病虫害等功能[3-4],因此,在植物抵抗生物、非生物胁迫中发挥着越来越重要的作用。不同植物表皮蜡质的化学成分不同,使得植物表皮蜡质晶体结构存在一定的多样性[5]。Barthlott 等[6]借助电镜对10 000 多种植物的表皮进行了扫描分析,将植物表皮蜡质晶体归纳为片状、板片状、柱状、条状、管状、颗粒状、光滑状等。拟南芥茎秆蜡质晶体为柱状[7],小麦、水稻苗期叶片蜡质形态以片状为主[8-9],番茄叶片蜡质呈现出光滑状[10];即使同一种植物的不同器官,其蜡质晶体也存在差异,如小麦旗叶正面和反面的蜡纸晶体分别呈现出片状和密集的管状[11]。
对拟南芥表皮蜡质合成途径的研究表明,拟南芥蜡质合成主要分为在质体内的从头合成、在内质网上超长链脂肪酸的合成以及在内质网中的蜡质合成[12]。其中,超长链脂肪酸的合成是在头合成形成16 碳和18 碳的脂酰CoA 的基础上,再经过碳链的延长形成各种碳链长度的脂酰CoA,此过程需要碳链延长酶(fatty acid elongase)的催化;而控制脂肪酸碳链延长的酶是一个包括多种酶的复合体,至少需要4 种酶参与脂肪酸碳链延长反应,共同完成超长链脂肪酸的合成[13]。其中,β-酮脂酰辅酶A 合成酶(KCS)是脂肪酸碳链延长酶复合体催化反应中第一步反应的酶,也是整个超长链脂肪酸延长合成中的限速酶,因此,鉴定并研究KCS 的功能对植物表皮蜡质合成与调控机制的解析具有重要意义[14-15]。
KCS 主要存在于植物体中,其种类和数量在不同物种间存在较大差异。模式植物拟南芥和水稻中分别有21 个和34 个KCS基因[16-17]。目前对KCS基因家族的研究主要集中在拟南芥上,如FAE1是首个从拟南芥中克隆出的KCS基因,该基因主要在种子中表达,催化C20 和C22 脂肪酸的生物合成[18];CER6/CUT1 参与链长大于24 个碳以上的脂肪酸合成,并促进茎和花粉的表皮蜡质积累[19]。此外,在其他植物如甘蓝型油菜、小麦、水稻和紫花苜蓿中都已经克隆了KCS相关基因[20]。
黄瓜为主要的蔬菜作物,其叶片以及果实表皮具有较厚的蜡质,但当前对于黄瓜表皮蜡质合成相关研究的报道还较少。王世峰[21]研究了CsCER10在黄瓜中的表达模式,并利用RNAi 技术解析了其在蜡质合成中的功能。王文娇[22]从黄瓜中分离克隆了CsCER1和CsWAX2,并利用转基因等方法,阐明了黄瓜中CsCER1和CsWAX2基因表达量异常影响了黄瓜表皮蜡质中的烷烃含量。此后,黄瓜蜡质合成相关基因CsCER4、CsCER7也相继被克隆出来[23-24]。Zhang 等[25]在黄瓜中鉴定了1 个AP2/ERF型转录因子CsWIN1,研究表明,CsWIN1通过调控CsCER1、CsCER1-1、CsCER4等的表达促进蜡质的积累。最近,Zhai 等[26]通过图位克隆首次明确了调控黄瓜果实亮度的关键基因D,该基因编码一种C2H2类型锌指蛋白转录因子,并通过一系列生理试验及转录组分析发现,D基因通过调控黄瓜果实表皮角质层的发育来影响果实亮度。此外,Yang 等[27]也通过图位克隆的方法获得了调控黄瓜亮度的主效基因CsZFP6,发现该基因能通过与CsMAH1、CsCER1等共表达,参与黄瓜果皮蜡质的合成。
笔者的研究拟通过分析黄瓜转录数据库,鉴定黄瓜β-酮脂酰辅酶A 合成酶KCS,克隆黄瓜CsKCS11基因,并利用生物信息学分析、转基因功能验证和干旱胁迫下的表达分析等方法解析CsKCS11的生物功能,以期为黄瓜遗传育种和品种改良提供理论依据。
1 材料与方法
1.1 材料
黄瓜品种全兴优冠F1是抗病耐高温材料,由山东宁阳金兴种业有限公司培育,种植在榆林市榆林学院西区种植园区玻璃日光温室,生育期内水肥管理同温室其他植物。待黄瓜幼苗生长6~8 周时,取黄瓜幼嫩叶片样品,置于液氮中保存备用。黄瓜表皮蜡质合成基因CsKCS11转化载体 pCX‐SN-CsKCS11由榆林学院植物资源化利用及生态修复课题组构建,详见图1。试验于2020 年7 月至2022 年3 月在榆林学院植物分子遗传育种实验室进行。

图1 植物过表达载体pCXSN-CsKCS11Fig.1 The construction of pCXSN-CsKCS11 overexpression vector
1.2 方法
1.2.1 黄瓜叶片总RNA 的提取和cDNA 的合成从温室中取黄瓜叶片用无菌锡箔纸包裹住叶片置于液氮中,在液氮超低温环境中保存,提取RNA时,在研钵中加入液氮,将黄瓜叶片研磨至粉末状,利用多糖多酚RNA 试剂盒(全式金)提取RNA,提
XcmIXcmI取过程严格按照说明书进行。RNA 的完整性通过1%的琼脂糖凝胶电泳检测。同时使用反转录试剂盒完成cDNA 第一链的合成,并于-20℃保存。
1.2.2 黄瓜CsKCS11基因的克隆 根据实验室前期构建的黄瓜叶片和果实转录组数据库,通过植物蜡质合成通路及注释分析,从中发现了在黄瓜叶片及果皮中表达量均较高的一条KCS序列,并依据开放阅读框,设计特异引物F1:CATCGCAAT‐GGGAAATGACGGAG 和 R1: GATCTTG‐GCACCCCAAATTAGAGA。以稀释15 倍的cDNA为模板,扩增CsKCS11基因,扩增体系为50 μL:2×Pfu Mix buffer 25 μL,dNTP 4 μL,引物F、R 各2 μL,cDNA 0.5 μL,ddH2O 16.5 μL。PCR 反应程序为:95 ℃60 s;95 ℃50 s,53 ℃40 s,72 ℃60 s,35个循环;72 ℃5 min。产物经1.2%的琼脂糖凝胶电泳后回收目标基因片段。将目标基因片段末端加A 后,连接到EZ-T 载体,并转化DH5α 感受态细胞,在含有氨苄青霉素(100 mg·L-1)的LB 固体培养基上筛选出阳性克隆,通过菌落PCR 鉴定阳性克隆[28]。最后挑选出至少3 个阳性克隆,送至上海生物工程有限公司测序,筛选出正确的CsKCS11基因序列。
1.2.3 黄瓜CsKCS11基因的生物信息学分析 分别 通 过ProtScale analysis(https://web.expasy.org/)、NPSA- Prabi (https://npsa- prabi.ibcp.fr/) 、SWISS- MODEL(http://swissmodel.expasy.org/inter‐active)在线分析软件对CsKCS11 蛋白的亲疏水性、二级结构和三级结构进行预测。同时分别运用DNAMAN 和MEGA7.0 分析CsKCS11 蛋白的保守结构域和物种亲缘关系。
1.2.4 植物遗传表达载体的构建和农杆菌介导的遗传转化 利用高保真酶从测序成功的质粒上扩增CsKCS11目标片段,并对该片段末端进行加A处理;同时,使用XcmI 对pCXSN进行单酶切,回收大片段载体,将pCXSN与末端加过A 的CsKCS11进行连接,连接产物转化Top10 感受态细胞,并在LB 固体培养基(含有卡那霉素100 mg·L-1)上培养出菌落,对单克隆进行PCR 筛选鉴定[29-30]。挑选至少3 个阳性单克隆,送至上海生物工程有限公司测序。测序验证成功后,提取pCXSN-CsKCS11质粒,并借助农杆菌GV3101 采用浸花法转化拟南芥[31]。在1/2MS 培养基(潮霉素质量浓度为50 mg·L-1)上对T1和T2代转化单株的拟南芥种子进行筛选、鉴定,获得转CsKCS11的T3代纯合株系,最后进行干旱胁迫处理,处理方法如下[32]:将T3代种子播于营养基质中,放于光照培养箱中(14 h(L)/10 h(D)光周期,光照度8000 lx,温度22 ℃,相对湿度50%~55%)生长约4 周,再进行控水15 d 处理,待大多数叶片萎蔫并开始变黄时,进行复水处理10 d。最后统计转基因株系和对照的成活率。每个处理3 次重复,每个重复选用32 株植株。
1.2.5 黄瓜CsKCS11在干旱胁迫下的表达分析选取约108 粒饱满的黄瓜种子,用0.55%的NaClO溶液消毒,在玻璃温室中播种于花盆内,正常浇水。待黄瓜苗长至5 叶期时,将黄瓜苗从基质中轻轻挖出,小心冲洗掉根上的基质,进行逆境胁迫处理[33-34]。干旱处理:取108 株幼苗,每4 株为1 个重复,用漂浮板固定好,将其漂浮在含有10%的PEG 6000 溶液中处理96 h。处理完成后,剪取叶片,转入无RNAase 的离心管中,液氮速冻。每个处理设3 次重复。样品RNA 的抽提按照国产君诺德RNA提取试剂盒进行,提取出黄瓜叶片总RNA 后,使用反转录试剂盒合成cDNA,-20 ℃保存备用。
选取黄瓜CsACTIN为内参基因(表1),以相应的cDNA 为模板,选用TaKaRa 的SYBR®Premix ExTaqTMII 试剂盒,采用CFX96TM Real-Time PCR Detection System 进行qRT-PCR 扩增,并进行表达量分析,分析方法参考所用仪器说明[32]。每个处理设3 次重复。数据分析按照2-ΔΔCt法计算[35]。
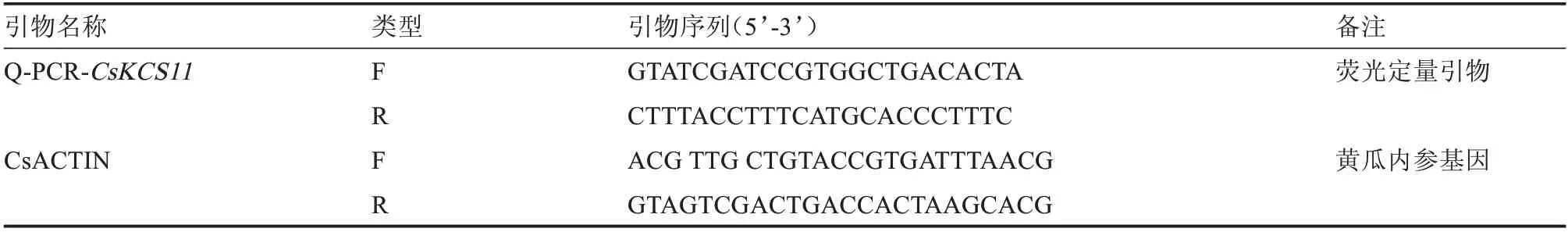
表1 基因表达分析所使用的引物Table 1 List of primers used for qRT-PCR
1.3 数据处理
数据采用Excel 2016 和SPSS 22.0 软件进行统计学分析,采用SigmaPlot 12.5 完成作图。
2 结果与分析
2.1 黄瓜KCS相关基因的鉴定
利用课题组前期建立的黄瓜果实与叶片转录组测序数据,通过通路和表达分析,鉴定出黄瓜CsKCS相关序列39 个(图2),其中目标序列Cs‐Gy1G019580.1 在黄瓜果实和叶片中均有较高的表达水平,因此选其作为目标基因,命名为CsKCS11,并进行后续的克隆与功能分析。
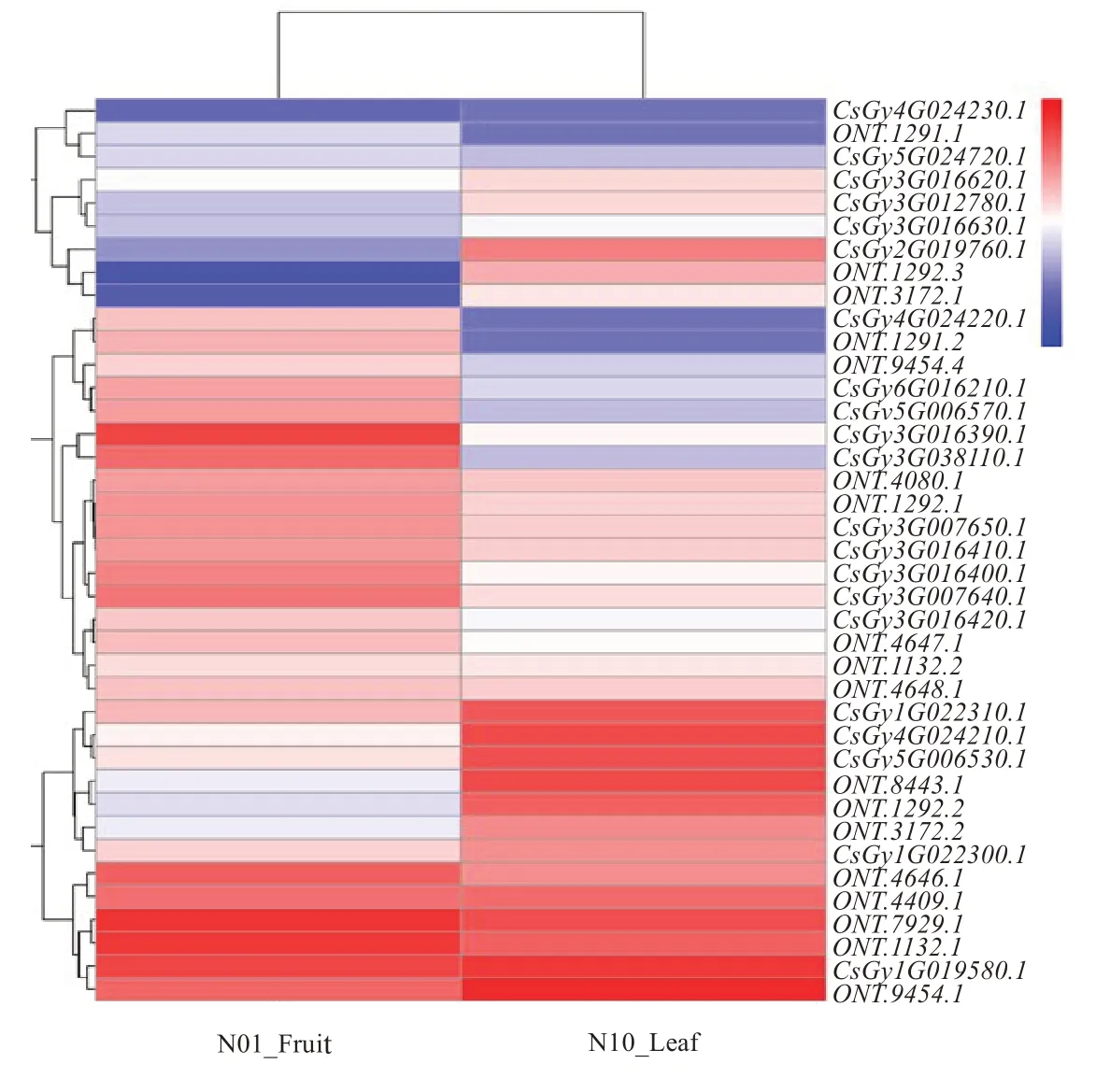
图2 黄瓜CsKCS 相关基因的热图分析Fig.2 Heat map analysis of CsKCS-related genes in cucumber
2.2 黄瓜CsKCS11基因的克隆
提取黄瓜叶片总RNA(图3-A),并反转录成cDNA,以稀释15 倍的cDNA 为模板,进行PCR 扩增,获得了一条长度约为1500 bp 的特异条带(图3-B)。将产物回收后,连接测序载体、转化DH5α细胞,经过筛选获得阳性单克隆(图3-C),选取阳性克隆经测序验证后,将目标序列提交到NCBI 数据库中(登录号为:OL660537),同时将该基因命名为CsKCS11,其开放阅读框(ORF)大小为1542 bp,编码513 个氨基酸。
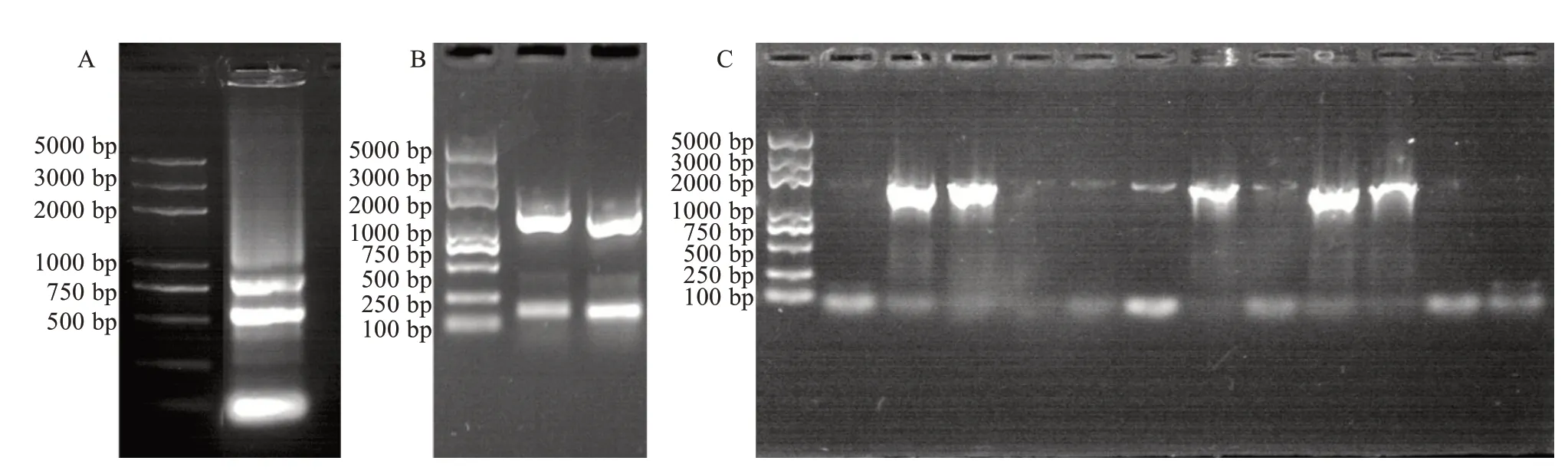
图3 黄瓜CsKCS11 的克隆Fig.3 CsKCS11 Cloning of cucumber
2.3 黄瓜CsKCS11的生物信息学分析
通过在线分析数据库ProtScale analysis 对基因编码蛋白的一级结构以及物理性质进行了分析,预测出黄瓜CsKCS11编码513 个氨基酸,其中亮氨酸数量最高,占总氨基酸含量的12.3%,蛋白分子质量为57.76 kDa,理论等电点为9.26。由此可知,该序列编码蛋白CsKCS11 为碱性蛋白。CsKCS11编码的氨基酸化学分子式为C2609H4125N85O734S29,原子总数为7582 个。对CsKCS11 蛋白质二级、三级结构进行预测表明,CsKCS11 蛋白主要由44.64%的α-螺旋、35.48%无规则卷曲、4.68%的β-转角和15.20%的延伸链组成(图4-A~B)。对CsKCS11 蛋白质的亲疏水性进行预测(图4-C),该蛋白质亲疏水性平均值(Gravy)为-0.083,说明黄瓜CsKCS11 蛋白属于亲水性蛋白。
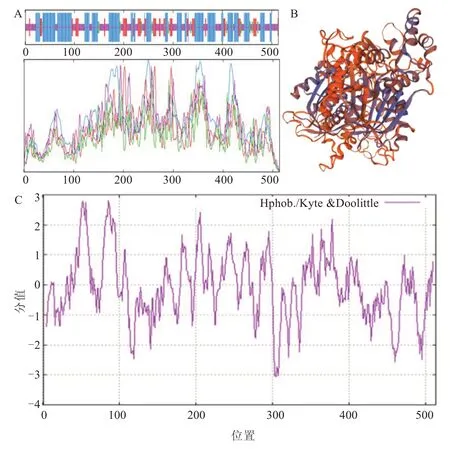
图4 黄瓜CsKCS11 蛋白的结构分析Fig.4 Protein structural analysis of CsKCS11 in cucumber
利用DNAMAN 软件将黄瓜CsKCS11 氨基酸序列与NCBI 中已登录的冬瓜(Benincasa hispi‐da)、苹果(Malus domestica)、拟南芥(Arabidop‐sis thaliana)、甜瓜(Cucumis melo)、南瓜(Cucurbi‐ta moschata)和笋瓜(Cucurbita maxima)等植物氨基酸序列进行多重序列比对。结果表明,不同物种中KCS 蛋白在保守区域具有高度的同源性,同源性高达91.14%(图5-A)。同时,通过MEGA 7.0 软件构建了不同植物KCS11 蛋白的系统发育树,发现不同植物的KCS11 蛋白主要分为4 个分支,其中月季、苹果和欧李的KCS11 聚为第一类;柑橘和榴莲的KCS11 聚为第二类;枣树的KCS11 单独聚为第三类;黄瓜的KCS11 与冬瓜、甜瓜、南瓜、笋瓜和苦瓜的KCS11 聚为第四类,且黄瓜与冬瓜的KCS11 的亲缘关系最近(图5-B)。
2.4 黄瓜CsKCS11在拟南芥中的表达分析
为了进一步研究CsKCS11的生物功能,构建了CsKCS11过表达载体pCXSN-CsKCS11,并将基因CsKCS11转入模式植物拟南芥中,同时结合荧光定量PCR 检测,最终获得转CsKCS11基因拟南芥株系。在T3代选择1 个转基因株系Line1,进行干旱胁迫处理,并鉴定其表型,结果表明,转CsKCS11基因拟南芥株系在干旱15 d 并复水10 d后,其成活率极显著高于野生型(图6-A~C),初步证明了CsKCS11在拟南芥中具备抵御干旱胁迫的能力。
2.5 黄瓜CsKCS11在干旱胁迫下的表达分析
为了研究CsKCS11在干旱胁迫下的表达模式,用10% PEG6000 干旱模拟处理黄瓜幼苗96 h。分别在0、1、2、4、6、12、24、48、96 h 采集干旱胁迫处理后的黄瓜叶片提取出RNA,反转录成cDNA 后应用荧光定量PCR 检测CsKCS11在黄瓜中的表达量。荧光定量PCR 结果表明,CsKCS11能够被干旱胁迫诱导表达,诱导表达程度存在一定差异(图7),随着干旱胁迫时间的延长,其表达量呈现出先升后降的趋势,在干旱胁迫12 h 时表达量达到最高值,并且显著高于其他处理。
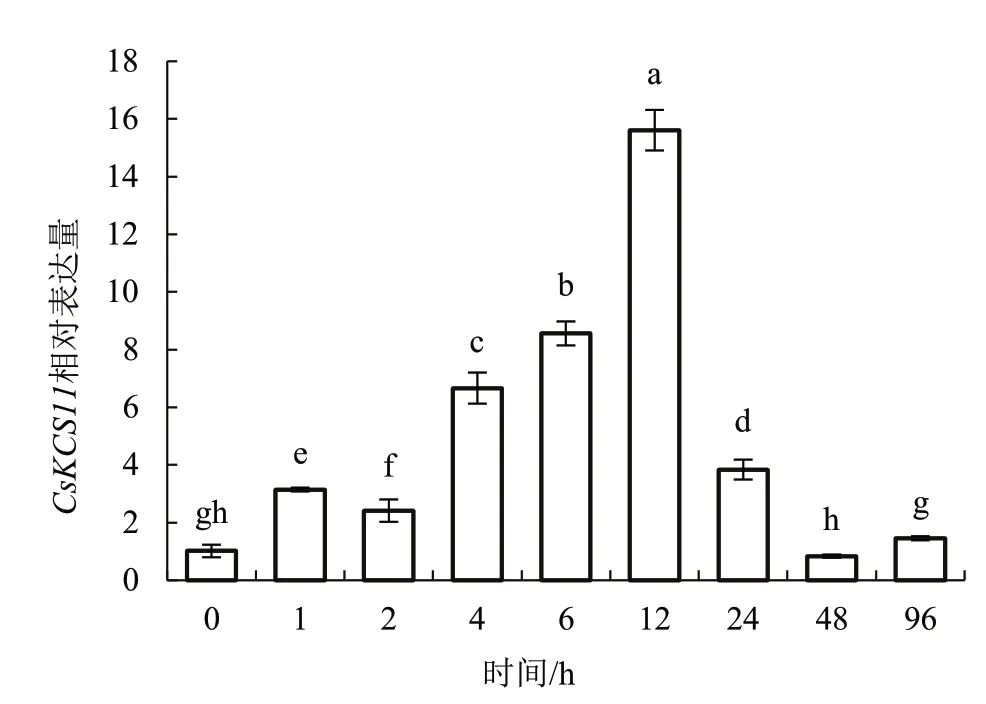
图7 CsKCS11 在黄瓜苗期干旱胁迫下的表达分析Fig.7 CsKCS11 expression analysis under drought stress in seedling of cucumber
3 讨论与结论
随着全球气候的逐年变化,干旱、高温、低温、高盐等生物胁迫也随之频繁发生,这些极端环境造成的渗透胁迫直接影响着植物生长发育和产量[36]。黄瓜为主要的设施蔬菜作物,在我国的年种植面积超过6000 万hm2,而我国一半以上的地区属于干旱半干旱地区,严重缺水直接影响着蔬菜的产量和品质,因此培育抗旱黄瓜新品种已经成为一项迫切的工作[37]。黄瓜叶片和果实表皮含有大量的蜡质晶体,其中果皮表皮蜡质的主要成分有超长链烷烃、脂肪酸、脂肪醛、次级醇和酯类化合物等,并以超长链烷烃含量最高。同时,笔者在本试验前期发现(结果未发表),黄瓜果皮蜡质总含量随着果实发育进程呈现出逐渐增高的趋势。因此本试验前期通过分析黄瓜果实和成熟叶片的转录组数据,根据蜡质合成通路信息和基因注释结果,鉴定了39 个β-酮脂酰辅酶A 合成酶KCS 相关基因,并根据热图分析发现序列CsGy1G019580.1 在黄瓜果实2 个不同的发育阶段均具有较高的表达量,结合该序列的功能注释信息,将其命名为CsKCS11。同源比对和系统发育分析结果表明,黄瓜CsKCS11与其他物种的KCS11具有相似的结构,可能都参与超长链脂肪酸的生物合成。这与Yang 等[38]在柑橘表皮中发现的KCS11的研究结果相似。
植物的抗逆性是基因与外界环境相互作用的结果,为了提高植物的抗旱性,科学家们选择将抗旱相关的基因转入植物中,获得过量表达的转基因株系,最终应用于生产实践[39]。转基因植物之所以能表现出较强的抗逆特性,是因为当植物受到生物或非生物胁迫时,这些应激反应基因会迅速表达,应激相关蛋白随后与下游的靶蛋白相互作用,以减缓植物体内活性氧的积累,维持细胞内的稳态,最终增强植物对不利环境的耐受性[40]。柴乖强[4]研究表明,在干旱胁迫条件下,小麦叶片表皮蜡质含量显著增高,并且蜡质含量越高植株的抗旱能力也越强。因此,如何提高植物表皮蜡质含量已经成为当前研究的热点之一。其中,在植物表皮蜡质合成基因的应用方面,已经有许多基因被克隆出来,并且通过转基因过表达、转基因敲除或编辑技术,一部分基因的生物学功能已经明晰。为了研究黄瓜CsKCS11的功能,笔者克隆了CsKCS11基因并将其连接到pCXSN 表达载体上,成功构建了pCX‐SN-CsKCS11过表达载体,同时利用农杆菌浸花法将CsKCS11转入拟南芥中,通过后代筛选,成功获得了T3代转CsKCS11拟南芥纯合株系,并对转基因T3代植株进行了干旱胁迫处理,结果发现转CsKCS11的拟南芥植株具备了较强的抗旱能力,初步验证了CsKCS11的生物学功能。这与Chai 等[30]在番茄中过表达小麦蜡质合成基因TaFAR6和Ta‐FAR8的结果相同,进一步说明了在干旱胁迫下,植物表皮蜡质的增加能增强植物对干旱胁迫的抵御能力。然而,黄瓜CsKCS11基因调控表皮蜡质合成进而参与植物抵抗干旱胁迫的机制还有待深入研究。
植物体内一些蜡质合成相关基因对外界不同胁迫会作出迅速响应。在本试验中,笔者对黄瓜CsKCS11在干旱胁迫下的表达量进行了分析,结果表明CsKCS11能对持续干旱胁迫作出响应,这与Li 等[41]的结论相似,而与Cheng 等[42]研究的结论不同,这可能与研究的植物类型以及植物的生长环境有关。综上所述,笔者从黄瓜中克隆出一个CsKCS11基因,为进一步研究黄瓜抗旱特性,并且从分子水平上验证其生物学功能和抗旱新品种培育提供了新的思路。此外,本试验中获得了转CsKCS11拟南芥植株,CsKCS11是否通过调控蜡质的合成途径而提高拟南芥的抗旱能力,还有待进一步通过测定表皮蜡质含量进行研究。
笔者从黄瓜中克隆了CsKCS11基因,并结合干旱胁迫下的表达分析和遗传转化等方法,研究了该基因的生物学功能,结果表明,黄瓜CsKCS11转基因拟南芥后代植株具有抵御干旱胁迫的功能,为进一步阐明黄瓜CsKCS11参与蜡质合成的机制提供了研究基础。

