anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子的构建及其治疗哮喘小鼠的应用
汪蓉蓉, 张天宝, 曹旭妮
(华东理工大学生物工程学院, 生物反应器工程国家重点实验室, 上海 200237)
支气管哮喘是一种呼吸系统疾病,主要表现为呼吸困难、胸闷和咳嗽[1]。该疾病的主要特征有气道高反应性(AHR)、气道炎症和气道重塑[1-2]。气道重塑是指由于炎症引起的气道内壁结构的改变,包括上皮纤维化,黏液腺肥大,以及肌成纤维细胞和平滑肌增生[3-6]。目前已有研究表明表皮生长因子受体(EGFR)信号通路异常能引起气道过度增殖、黏液过度分泌以及肺纤维化[7-9]。此外,在过敏性哮喘中,白介素-4 受体(IL-4R)信号通路激活后,能够引起慢性炎症和组织重塑[10]。因此,同时靶向EGFR和IL-4R 的双靶向生物化合物可能为哮喘患者提供一种有效的治疗方式。
蛋白纳米粒子与合成聚合物相比,具有生物相容性、生物降解性和低毒性等优点[11-12]。铁蛋白重链亚基(FTH1)广泛存在于生物体内,是由24 个亚基组成的直径为12 nm 的中空纳米粒子,并且有3 个不同的界面:内部、外部和亚基间相互作用的表面。目前有不少文献报道可以将功能活性肽修饰到FTH1 的这些界面处,使其实现蛋白的功能化,从而实现肿瘤的靶向成像和治疗[13-17],但鲜有关于以铁蛋白为基础的双靶向纳米粒子构建和其在哮喘及其他临床疾病治疗方面的报道。
本实验早期研究表明将抗EGFR 的单链抗体(anti-EGFR scFv)修饰到FTH1 的N 端构建的纳米粒子对于哮喘小鼠具有一定的治疗效果[18-19]。在此基础上,本文进一步通过基因工程的方法,分别将anti-EGFR scFv 和AP1(能与IL-4R特异性结合的多肽[10])修饰到不同的FTH1 的N 端,以构建anti-EGFR scFv-FTH1/AP1-FTH1 双靶向纳米粒子。通过对构建的纳米粒子进行一系列表征,说明这种体外混合复性技术能有效实现铁蛋白纳米粒子的双功能化。同时,通过评价该纳米粒子用于鸡卵白蛋白(OVA)激发的哮喘模型小鼠的治疗效果,进一步为双靶点治疗哮喘提供一种蛋白类纳米粒子的构建思路。这些研究工作有助于解决以铁蛋白为基础的双靶向纳米粒子的构建问题,也为今后应用于哮喘的治疗提供了一定的实验基础。
1 实验部分
1.1 原料和试剂
1.1.1 菌株与质粒 大肠杆菌 (Escherichia coli,E.coli) DH5α、E.coli.BL21(DE3)均购自天根生化科技(北京)有限公司。anti-EGFR scFv-FTH1/pET-28a(+)等质粒均为实验室保存。
1.1.2 试剂 胰蛋白胨(Tryptone)、酵母提取物(Yeast extract)均购自英国OXOID 公司;硫酸卡那霉素(KANA),考马斯亮蓝(R-250),三羟甲基氨基甲烷(Tris),甘氨酸(Gly),丙烯酰胺,甲叉双丙烯酰胺,异丙基硫代半乳糖(IPTG),二硫苏糖醇(DTT),四甲基乙二胺(EDTA),聚乙二醇(PEG),十二烷基磺酸钠(SDS),过硫胺酸铵,曲拉通(TritonX-100),琼脂糖均购自上海捷瑞生物工程有限公司;氯化钠,甘油,尿素,氢氧化钠均购自上海凌峰化学试剂有限公司;T4 连接酶(T4 Ligase)购自宝日生物技术(Takara 北京)有限公司;KOD-Plus 突变试剂盒购自东洋纺(上海)生物科技有限公司;PAGE 胶原蛋白微量回收试剂盒购自生工生物工程(上海)股份有限公司;OVA购自Sigma-Aldrich 公司;乙酰甲胆碱(Methacholine)购自国药集团化学试剂有限公司;苏木精伊红染料(HE),糖原染色液(PAS)均购自上海碧云天生物技术有限公司;其余试剂均购自上海泰坦科技股份有限公司。以上试剂皆为分析纯。
1.1.3 仪器 分析天平(德国Mettler Toledo EL104 型);电热恒温水槽(上海精宏实验设备有限公司DK-8D 型);纯水仪(德国Millipore Academic 型);恒温振荡器(太仓市科教器材厂HZ-9210K 型);电泳仪(北京市六一仪器厂DYY-6C 型电泳仪);凝胶成像仪(上海复日科技有限公司FR-980 生物电泳图像分析系统);PCR 扩增仪(美国Bio-rad MJ MiniTM梯度PCR 仪);离心机(德国Sigma 3K15 型);超声波细胞粉碎机(宁波新芝生物科技股份有限公司JY92-IIN 型);隔水式恒温培养箱(上海精宏实验设备有限公司GNP-9050 型);多功能酶标仪(美国伯腾Biotek Synergy H1 型);超净工作台(苏州净化设备有限公司SW-CJ-1FD 型);压缩式雾化器(欧姆龙(大连)有限公司NE-C28 型);小动物肺功能-气道阻力和肺顺应性系统(美国Buxco RC system 型);石蜡切片机及石蜡展片机(德国Leica RM2235 型);透射电子显微镜(TEM,日本电子JEM-1400 型)。
1.1.4 实验动物 SPF 级BALB/c 雌性小鼠(4~6 周龄),购自上海斯莱克实验动物有限责任公司。动物实验均严格按照规定开展(《上海市实验动物护理与使用委员会指南》,许可证号SCXK-2017-0005 和SYXK-2017-0008),并确保动物得到合乎伦理和人道的对待。
1.2 anti-EGFR scFv-FTH1 融合蛋白的表达与纯化
实验室已保存有pET-anti-EGFR scFv-FTH1 转化的E.coli.BL21(DE3)细胞接种于LB 培养基中(含KANA 50 ng/μL)。过夜活化后,用IPTG 诱导目标蛋白的表达;对收集的沉淀部分进行反复洗涤,再进行变性可获得纯度较高的anti-EGFR scFv-FTH1蛋白变性溶液。具体实验步骤见文献[18]。
1.3 AP1-FTH1 融合基因的构建
通过查阅文献[10]得到AP1 多肽的序列为NRKRLDRNGGPE-C。为将AP1 连接到FTH1 的N 端,根据FTH1 质粒序列设计了一对反向引物,直接将AP1 的基因序列连到FTH1 上,所用引物有AP1-FTH1(primer 1):5’-ACCATTACGATCCAGACGTTTACGG CCCATGGTATATCTCCTTCT-3’和AP1-FTH1(primer 2):5’-GGTCCGGAAGGTGGTGGTAGCGGTGAATTC ATGACGACCGCGTC-3’。
经反向PCR、DpnI 对模板质粒 DNA 进行消化及T4 DNA Ligase 连接酶连接目的基因和载体后,将自身环化产物转化于E.coil.DH5α 感受态细胞。随后,以PCR 引物5’-GACCACCATTACGATCCAGAC GT-3’和5’-ATGTAATTCAGCTCCGCCATCGC-3’进行菌落 PCR,筛选目标质粒。测序正确后保存目标质粒。
1.4 AP1-FTH1 融合蛋白的表达与纯化
pET-AP1-FTH1 转化E.coli.BL21(DE3)感受态细胞过夜培养后,无菌条件下用枪头挑取平板上的单菌落,加入到含有50 μg/mL 硫酸卡那霉素的无菌LB液体培养基中,并于200 r/min、37 ℃恒温摇床中过夜培养。经过夜培养后,次日对该菌进行扩培,于200 r/min、37 ℃恒温摇床进行扩大培养,一段时间后测定菌液的OD 值,当菌液的OD 值达到0.4~0.6 时,向培养瓶中加入IPTG(终浓度为10 mmol/L),将培养瓶置于200 r/min、37 ℃恒温摇床中,诱导表达3 h。随后以8 000 r/min、20 min 的条件进行离心,收集沉淀,加入缓冲液 A(50 mmol/L Tris-OH,50 mmol/L NaCl,pH 7.9,0.22 μm 滤膜过滤),使菌液重悬。超声波破碎仪破碎细胞(工作条件:功率300 W,工作1 s,间歇1 s,重复66 次),以8 000 r/min、15 min 的条件进行离心,分别收集上清和沉淀,得到的沉淀即AP1-FTH1 包涵体。将破碎后的AP1-FTH1 包涵体收集,向管中每次加入1 mL 缓冲液 B(50 mmol/L Tris-OH,50 mmol/L NaCl,1 mmol/L EDTA,1% TritonX-100,pH 7.9,0.22 μm 滤膜过滤),并用1 mL 枪头蘸取缓冲液 B 对少量包涵体进行研磨洗涤,直至所有的包涵体全部重悬于溶液中,振荡洗涤后将该溶液以8 000 r/min 的转速离心15 min,将收集得到的包涵体重复以上洗涤过程,最终使用SDS-PAGE 检验得到的包涵体的纯度。
1.5 anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子的制备
分别向纯度较高的anti-EGFR scFv-FTH1 和AP1-FTH1 包涵体中加入变性液缓冲液 C(8 mmol/L Urea, 50 mmol/L Tris-OH,10 mmol/L DTT,1 mmol/L EDTA,pH 7.9,0.22 μm 滤膜过滤),使包涵体变性,并分别将装有变性蛋白的离心管置于28 ℃恒温摇床中过夜,次日取出后,利用0.22 μm 过滤器对离心管中的溶液进行过滤,除去其中的杂质,最后过滤后的溶液即为变性蛋白。随后将AP1-FTH1 和anti-EGFR scFv-FTH1 这两种变性蛋白以6∶4 的物质的量之比进行混合,得到蛋白总质量为5 mg,用缓冲液 C 将混合后的蛋白稀释至体积为50 mL,并装入透析袋中;置于1 L 的复性缓冲液中进行透析,透析液始终处于4 ℃条件下,每12 h 更换一次下一浓度的复性缓冲液,每次更换的复性缓冲液配方及步骤如下:
步骤1:50 mmol/L Tris-OH 溶液, 50 mmol/L NaCl, 0.5 mmol/L EDTA, 0.1%(质量分数,下同)PEG,10%(质量分数,下同)甘油, 6 mol/L 尿素, 0.5 mmol/L CuSO4, pH 7.9;步骤2:50 mmol/L Tris-OH, 50 mmol/L NaCl, 0.5 mmol/L EDTA, 0.1%PEG, 10% 甘油, 4 mol/L尿素, 0.5 mmol/L CuSO4, pH 7.9;步骤3:50 mmol/L Tris-OH, 50 mmol/L NaCl, 0.5 mmol/L EDTA,0.1%PEG, 10% 甘油, 3 mol/L Urea, 0.5 mmol/L CuSO4,pH 7.9;步骤4:50 mmol/L Tris-OH, 50 mmol/L NaCl,0.5 mmol/L EDTA, 0.1%PEG, 10% 甘油, 2 mol/L 尿素,0.5 mmol/L CuSO4, pH 7.9;步骤5:50 mmol/L Tris-OH, 50 mmol/L NaCl, 0.5 mmol/L EDTA, 0.1%PEG,10% 甘油, 1 mol/L 尿素, 0.5 mmol/L CuSO4, pH 7.9;步骤 6:50 mmol/L Tris-OH, 50 mmol/L NaCl, 0.5 mmol/L EDTA, 0.1%PEG, 10% 甘油, pH 7.9;步骤7:50 mmol/L Tris-OH, 50 mmol/L NaCl, 10% 甘油, pH 7.9;步骤8:10 mmol/L PBS, 10% 甘油, pH 7.2。
以上复性结束后,吸出透析袋中的蛋白溶液,用0.22 μm 过滤器将蛋白过滤至干净的离心管中以除去团聚蛋白,过滤得到的蛋白溶液即为目标蛋白纳米粒子。并用截流分子量为50 kDa 的超滤管对复性后的蛋白溶液于2 500g的离心条件进行超滤浓缩,最后用考马斯亮蓝测定复性蛋白浓度,计算复性得率,并利用凝胶电泳分析复性蛋白的蛋白纯度及折叠情况。
1.6 anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子的表征
1.6.1 纳米粒子的折叠组装及组分分析 采用Native-PAGE 对非变性生物大分子进行电泳分离纯化,Native-PAGE 电泳结束后,用手术刀将目标蛋白条带切割下来,将含目标蛋白的凝胶放入EP 管中,反复研磨成细小的凝胶碎片后,采用PAGE 胶蛋白微量回收试剂盒回收凝胶中目的蛋白,并对目的蛋白进行SDS-PAGE 电泳,进一步考察目的蛋白纳米粒子的亚基组成情况。
1.6.2 TEM 检测 取0.5 mg/mL 的蛋白样品与1 g/L 磷钼酸以体积比1∶1 进行混合,滴于铜网上,将样品吸附于铜片20 min 后用TEM 观察蛋白纳米粒子复性折叠后是否具有中空笼状的结构,并使用软件Image J 2.1 对纳米粒子的粒径进行分析计算。
1.7 哮喘小鼠模型的建立及治疗效果分析
1.7.1 OVA 哮喘小鼠模型的建立 致敏阶段选用OVA 初始质量浓度为20 μg/mL,溶剂为1×PBS 的溶液,与等体积的免疫铝剂Al(OH)3混合后溶液最终质量浓度为10 μg/mL,分别在第0,7,14 d 对每只小鼠进行腹腔注射给药,每组小鼠有6 只,每只给药剂量为2 μg。致敏阶段结束后,自第21 d 开始至第27 d,连续7 d,每天将小鼠置于雾化箱内进行30 min 的雾化激发,雾化使用的OVA 质量浓度为10 mg/mL,雾化激发期间分别于第22,24,26 d 对小鼠进行给药治疗,并于雾化前1 h 对小鼠进行腹腔给药,给药的纳米粒子为anti-EGFR scFv-FTH1/AP1-FTH1 (0.75 nmol),对照组注射anti-EGFR scFv-FTH1/FTH1 蛋白纳米粒子(0.75 nmol)和地塞米松(DXM,2.55 × 10-6mol/kg),阴性对照组小鼠注射等剂量的PBS。
1.7.2 小鼠组织石蜡包埋及切片 第28 d 解剖小鼠取出两片肺叶,并立即用φ=75%酒精清洗肺叶表面,然后将肺叶浸泡于40 g/L 多聚甲醛(PFA)溶液里,固定肺组织24 h后进行石蜡包埋及组织切片,具体过程为:PFA 固定结束后,通过逐步提高酒精浓度进行脱水,组织在每个梯度酒精(φ分别为70%,85%,95%,100%)中脱水1 h 后,置于无水酒精与二甲苯的混合溶液(体积比1∶1)中浸泡1 h,然后转移至二甲苯中浸泡1 h;将预先在65 ℃的恒温箱内融化好的石蜡与二甲苯配制成体积比为1∶1 的混合溶液,然后将经二甲苯浸泡后的组织置于其中。浸蜡2 h 后,再将组织放入65 ℃的恒温箱内的蜡液中浸蜡3 h,此步骤重复2 次。浸蜡结束后,用镊子将组织材料块夹入装有蜡液的包埋盒中,并置于4 ℃冰箱中,冷却后切片。
1.7.3 HE(小鼠肺组织苏木素伊红染料)染色 将制备好的切片在60 ℃烘2 h 后,对其进行切片脱蜡与水化。步骤如下:二甲苯5 min 2 次,100%乙醇5 min 2 次,95%乙醇3 min 2 次,85%乙醇3 min 1 次,80%乙醇3 min 1 次,75%乙醇3 min 1 次,放入蒸馏水中3 min。切片脱蜡后水平放置于桌面,在切片上面的肺组织附近滴加几滴苏木素染色液,至完全覆盖肺组织,染色5 min 后快速弃去染液,使用酸性乙醇分化几秒钟,再用水冲刷,之后再滴加几滴伊红染液,染色1 min 后快速弃去,再用水清洗。切片随后再依次浸入80%乙醇5 min 1 次、85%乙醇5 min 1 次,95%乙醇10 min 1 次,100%乙醇10 min 2 次,二甲苯10 min 2 次进行脱水、透明。最后,倒去载玻片上透明剂,并用滤纸吸干,立即盖上盖玻片进行封片备用。HE 染色情况可通过显微镜进行观察和拍照,并对肺组织的炎细胞浸润情况按照0~3 进行打分,打分标准参考文献[20]。
1.7.4 PAS(小鼠肺组织糖原染料)染色 将脱蜡、水化的切片水平放置于桌面,在切片上面的肺组织附近滴加几滴过碘酸反应液,反应6 min 后快速弃去反应液,水洗后用滤纸除去水分,在切片上面的肺组织附近滴加几滴雪芙反应液,至完全覆盖肺组织,在暗处反应15 min 后马上用自来水清洗15 min,吸干水分,滴加几滴苏木素染核1.5 min,弃去染液后使用酸性乙醇分化几秒,再用水冲洗至能观察到组织显蓝色为止。之后进行切片脱水、透明、封片,实验操作同1.7.3 节。最后在显微镜下对着色情况拍照分析,并使用软件Image J 对组织中黏液所占的面积比例进行计算[21]。
1.7.5 小鼠肺部呼吸道阻抗情况检测 小鼠末次给药后24 h,依次根据小鼠体重计算出每只小鼠所需给的麻醉药剂量(戊巴比妥钠:90 mg/kg),待小鼠完全昏迷后,将小鼠四肢及牙齿固定于桌面,解剖小鼠颈部,暴露出气管,钝性分离气管周围肌肉组织后,手术线从气管底部穿过,用剪刀将其气管从一侧剪一个小口,进行气管插管并固定,再将小鼠放入密闭的体描箱中;打开肺功能仪器的呼吸机,频率为每分钟120 次,使小鼠正常呼吸;记录呼吸道压力、流速和潮气量等数值,等各项数值稳定后,使用激发剂乙酰甲胆碱激发气道高反应性,此时收集3 min 的数据,记录呼吸道压力变动,测定肺阻力(RL)等肺功能参数。激发剂质量浓度按0、6.25、12.5、25、50 mg/mL顺序依次呈梯度上升。
2 结果与讨论
2.1 anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子的制备与表征
anti-EGFR scFv-FTH1/pET-28a(+)质粒为实验室已保存质粒,主要以包涵体的形式进行表达[18]。AP1-FTH1/pET-28a(+)重组质粒图谱如图1(a)所示,它是采用点突变技术将AP1 短肽基因插入FTH1基因的5’端。图1(b)是采用反向PCR 获得的AP1-FTH1 基因的电泳图。该产物进行纯化、环化后转化到E.coli.DH5α,最后通过测序确认成功构建目标质粒。AP1-FTH1 蛋白亚基的表达则是将AP1-FTH1/pET-28a(+)质粒转化到E.coli.BL21(DE3)中进行诱导表达。SDS-PAGE 的结果显示了AP1-FTH1的蛋白表达情况,如图2 所示。在25.0~35.0 kDa存在一条明显的主带,与所预计的AP1-FTH1 大小相符合,说明AP1-FTH1 成功诱导表达。同时,进一步分析破碎细胞的上清未见该条带,但是由破碎细胞的沉淀部分可以明显地观察到该条带,说明AP1-FTH1 主要以包涵体的形式进行表达。
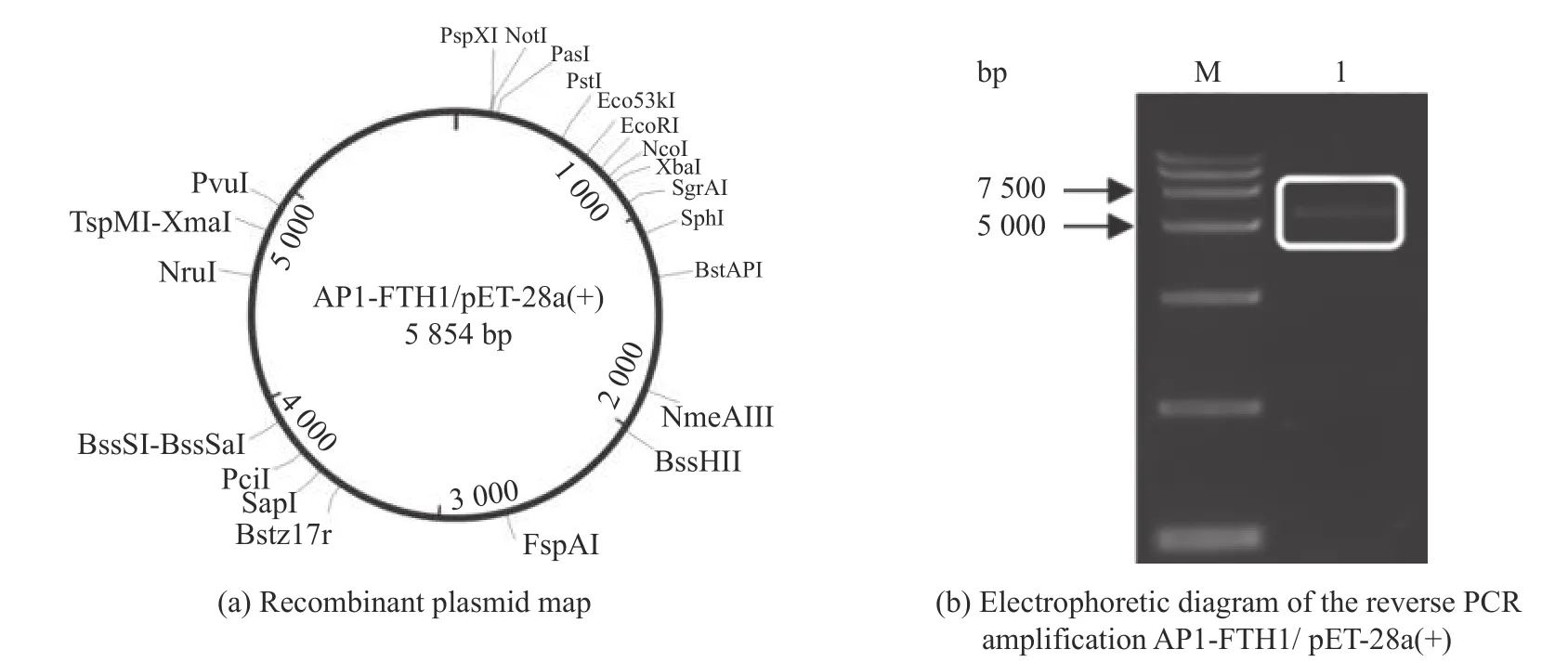
图1 AP1-FTH1/pET-28a(+)的构建及AP1-FTH1 蛋白的表达Fig.1 Construction of AP1-FTH1/pET-28a(+) and the expression of AP1-FTH1

图2 SDS-PAGE 分析AP1-FTH1 在E.coli. BL21(DE3)中的诱导表达Fig.2 Induced expression of AP1-FTH1 in E.coli. BL21(DE3)using SDS-PAGE analysis
本文再回收的纯度较高的anti-EGFR scFv-FTH1 蛋白和AP-FTH1 蛋白,变性后经体外的混合复性制备得到了anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子,图3(a)示出的泳道2~3 为该纳米粒子的Native-PAGE 凝胶电泳图。由图3(a)可见与泳道1 的去铁铁蛋白(APO,440 kDa)相似,在APO 略高的位置上可见唯一一条明显的蛋白条带,说明两种变性蛋白亚基经复性后正确折叠并组装成分子量比较大的蛋白纳米粒子,它与商品化的APO 相似,都是具有特殊结构的多聚体。实验中还发现AP1-FTH1 亚基也能在复性过程中折叠组装成类似的纳米粒子(如图3(b)泳道1),但anti-EGFR scFv-FTH1 亚基不能折叠组装成纳米粒子(如图3(b)泳道3)[18]。

图3 电泳分析anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子组装及组成Fig.3 Electrophoretic analysis of assembly and composition of anti-EGFR scFv-FTH1/AP1-FTH1 nanoparticles
为进一步说明anti-EGFR scFv-FTH1/AP1-FTH1蛋白纳米粒子是由上述两种蛋白亚基相互作用形成的稳定纳米粒子结构,本文采用SDS-PAGE 进一步分析了割胶纯化后的蛋白纳米粒子的组成,结果如图3(c)所示。 将纯化后的anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子(泳道3~4)与亚基蛋白(泳道5~6)进行对比,可以观察到该蛋白纳米粒子含有两条条带,且位置一致,它们的分子量大小也分别与anti-EGFR scFv-FTH1 蛋白和AP1-FTH1蛋白相一致。这说明经过割胶回收纯化后的单条带anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子是由上述这2 种蛋白亚基组成。同样地,割胶纯化的AP1-FTH1(泳道1~2)在SDS-PAGE 上仅呈现一条蛋白条带,位置与AP1-FTH1 蛋白(泳道5)一致。这说明所构建的anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子非anti-EGFR scFv-FTH1 蛋白与AP1-FTH1 蛋白的物理混合。
2.2 TEM 检测
为进一步确认所制备的蛋白纳米粒子具有铁蛋白特征的中空结构,采用磷钨酸对anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子负染后再进行透射电镜的拍摄,结果如图4 所示。可见anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子具有铁蛋白结构特征,为内部中空的笼状结构;随后进一步统计计算纳米粒子的粒径平均尺寸为(13.2 ± 1.3)nm,分布较为狭窄。

图4 anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子的TEM结果Fig.4 TEM analysis of anti-EGFR scFv-FTH1/AP1-FTH1 nanoparticles
2.3 anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子对哮喘小鼠治疗效果的评价
本实验室早期的研究结果表明以EGFR 为单靶点的铁蛋白纳米粒子对治疗哮喘具有较好的效果[18]。本文进一步考察了以EGFR 和IL-4R 为靶点的治疗效果,通过建立OVA 诱导的哮喘小鼠模型,并以抑制气道炎性浸润、减少气道黏液的分泌,以及降低气道高反应的效果评价双靶向纳米粒子的治疗效果。
2.3.1 HE 染色评价纳米粒子对OVA 哮喘模型小鼠气道炎性浸润的调控 气道炎性浸润的程度是通过肺组织的HE 染色来实现的。对比图5(a)和5(b),可明显地观察到OVA 诱导的哮喘小鼠模型在气道的周围炎性浸润十分严重,说明该动物模型构建成功。进一步对比发现,阳性药物地塞米松、单靶向anti-EGFR scFv-FTH1/FTH1 纳米粒子及双靶向anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子均对炎性浸润有非常好的抑制效果(如图5(c)、5(d)和5(e)所示)。

图5 HE 染色分析不同纳米粒子对OVA 诱导的哮喘小鼠的炎性浸润的影响(n=6)Fig.5 Effect of different nanoparticles on inflammatory infiltration in OVA-induced asthmatic mice (n=6) using HE staining analysis
图6 所示为各实验组HE 染色后的炎性细胞浸润评分结果。这一结果与之前报道的anti-EGFR scFv-FTH1/FTH1纳米粒子对哮喘小鼠的炎性症状有明显的抑制效果相一致[18]。再对比anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子与anti-EGFR scFv-FTH1/FTH1 纳米粒子对哮喘小鼠的炎性浸润的抑制作用,虽然无明显差异,但均能达到阳性药物的治疗效果,即无明显的炎性浸润可被观察到。

图6 HE 染色后肺部炎性细胞浸润评分结果Fig.6 Lung inflammation score of each group after HE staining
2.3.2 PAS 染色评价纳米粒子对哮喘OVA 模型气道黏液分泌的调控 哮喘早期发病中常见气道上皮细胞黏液化生进而引起呼吸困难。本研究对肺部组织进行PAS 染色观察气道杯状细胞增生和黏液的分泌情况,这种染色技术能有效帮助观察气道的上皮细胞组织形态,还可以将分泌的黏液染色呈现红色以帮助判断气道黏液的分泌情况。如图7 和图8 所示,对比非造模对照小鼠,OVA 诱导建立的哮喘小鼠,其气道不仅显示了高度的炎性浸润,同时可观察到气道内杯状细胞的增生以及黏液分泌明显增多的情况(如图7(b)中的箭头所示),且其黏液所占比例远高于非造模对照小鼠(P<0.001)(如图8 所示)。之前报道的anti-EGFR scFv-FTH1/FTH1 纳米粒子能有效抑制杯状细胞的增生以及黏液的过度分泌[18],如图7(d)所示未见明显的杯状细胞的增生以及黏液分泌。同时,通过对比图7(c)和7(d),可以进一步发现anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子与anti-EGFR scFv-FTH1/FTH1 纳米粒子对抑制气道高黏液分泌具有相当的治疗效果;对比阳性药物地塞米松治疗组,anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子对哮喘小鼠的杯状细胞增生以及黏液的过度分泌也具有非常好的抑制作用,亦未见明显的杯状细胞增生以及黏液分泌。这些实验说明双靶向的纳米粒子能有效缓解小鼠的气道杯状细胞增生以及高黏液分泌的哮喘症状。
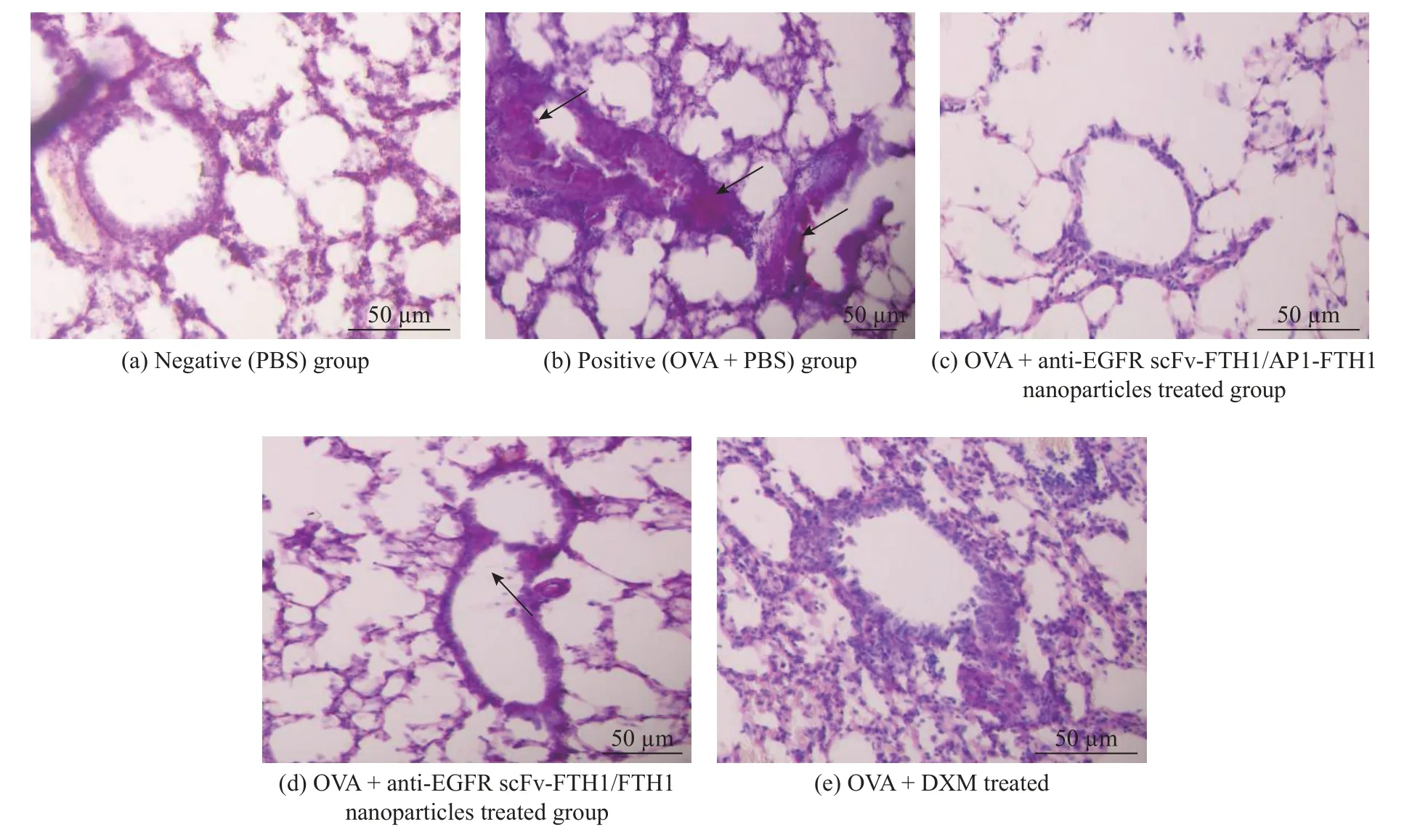
图7 PAS 染色分析不同纳米粒子抑制OVA 诱导哮喘小鼠模型的杯状细胞增生及气道黏液分泌的情况 (n=6)Fig.7 Different nanoparticles inhibiting goblet cell hyperplasia and airway mucus secretion in OVA-induced asthma mouse model (n=6) using PAS straining analysis

图8 PAS 染色后阳性面积率(阳性染色面积与上皮面积之比)显示气道黏液分泌情况Fig.8 Positive area rate (Ratio of positively stained area to epithelial area) showed airway mucus secretion after PAS staining
2.3.3 小鼠肺功能实验评价纳米粒子对哮喘小鼠气道高反应性的抑制 气道高反应性指气道对各种刺激因子出现过强或过早的收缩反应。如果这种刺激在正常人呈无反应状态或反应程度较轻,而对于哮喘患者却会引起明显的支气管狭窄,表现为受外界刺激气道就会收缩引起咳嗽、喘息、呼吸困难。因此,通常它是哮喘疾病的重要病理指标之一。通过研究我们发现,OVA 诱导的哮喘小鼠动物模型可观察到这种气道高反应性。如图9 所示,哮喘小鼠阳性组(OVA+PBS)在乙酰甲胆碱的刺激下气道阻力明显增高。观察当乙酰甲胆碱刺激药物的质量浓度达到50 mg/mL 时的治疗情况,哮喘小鼠经anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子治疗后,气道阻力明显降低,与阳性治疗组(OVA+DXM)相当(P> 0.05),并且anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子治疗效果明显好于anti-EGFR scFv-FTH1/FTH1纳米粒子(P<0.05),说明双靶向的anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子在缓解哮喘小鼠的气道高反应方面有明显治疗效果,且优于单靶向纳米粒子。

图9 不同纳米粒子对 OVA 诱导哮喘小鼠的气道高反应性的影响Fig.9 Effects of different nanoparticles on airway hyperresponsiveness in OVA-induced asthmatic mice
3 讨 论
如前所述,哮喘是一种由多种细胞,包括多种炎性细胞、上皮细胞、平滑肌细胞等及其细胞组分参与的以慢性炎症为特征的异质性疾病,这种慢性炎症与上皮细胞异常增生、气道黏液高分泌、气道高反应性等密切相关。随着病程的发展,还可产生气道不可逆性缩窄和气道重塑问题。根据免疫反应引起的气道炎症来看,可以分为Th2 型炎症型哮喘和非Th2 型哮喘。其中,Th2 型炎症型哮喘的特征是Th2 型细胞因子,如白细胞介素(IL)-4、IL-5 和IL-13 表达上调,导致气道炎症。早期的治疗以控制炎症为主,大量的研究表明抑制IL-4 和IL-13 的受体IL-4R 能有效控制哮喘患者的炎症,目前已有该靶点的单抗药物进入临床研究[22]。另一方面,EGFR 也参与哮喘的发生和发展,特别作为促生长因子,该信号通路的异常能引起气道上皮细胞异常增生、黏液过度分泌、平滑肌细胞的异常增生等,也会导致气道狭窄、气道重塑的问题[7-9]。此外,研究表明抑制EGFR 对控制气道炎症也有着积极的作用[18]。由此可见,在哮喘疾病的发生和发展过程中,考虑针对不同细胞、不同的作用靶点及机制进行综合治疗,将会获得更好的治疗效果。为此,本研究构建了anti-EGFR scFv-FTH1/AP1-FTH1 蛋白纳米粒子并分别作用于EGFR 和IL-4R 两个靶点,结果表明在控制气道高反应性方面其效果优于单靶向的anti-EGFR scFv-FTH1/FTH1 蛋白纳米粒子。今后,我们还将进一步研究双靶点治疗的协同作用效果和机制。
4 结束语
(1)采用“混合复性技术”成功制备了anti-EGFR scFv-FTH1/AP1-FTH1 双靶向纳米粒子。割胶回收实验结果显示该纳米颗粒含有anti-EGFR scFv-FTH1和AP1-FTH1 2 种亚基。TEM 结果表明这些纳米粒子具有小尺寸((13.2 ± 1.3)nm)和窄尺寸分布的中空笼状结构。
(2)anti-EGFR scFv-FTH1/AP1-FTH1 纳米粒子对于治疗OVA造模哮喘小鼠有较好的疗效。HE 染色结果表明该纳米粒子能有效减少支气管气道周围炎性细胞浸润;糖原PAS 染色结果表明该纳米粒子能显著降低肺组织黏液分泌与杯状细胞的增生;气道高反应性结果表明该纳米粒子能缓解哮喘小鼠的气道高反应性且治疗效果优于单靶向纳米粒子anti-EGFR scFv-FTH1/FTH1。
(3)本文为构建以EGFR和IL-4R 为靶点的双靶向纳米粒子治疗哮喘提供了研究基础,为地塞米松治疗失败的晚期哮喘患者提供新的治疗手段。

