煅烧硫酸铝铵复盐低温合成α-Al2O3:葡萄糖和预压的影响
张 鹏, 李 蔚, 陶宏磊
(华东理工大学材料科学与工程学院, 上海 200237)
氧化铝陶瓷具有优异的物理化学性能,被广泛应用于机械、能源、医疗、航空等诸多领域[1-3]。制备性能优良的氧化铝陶瓷需要性能优良(纯度高、粒径细、烧结活性高等)的氧化铝粉体。目前,工业中已有许多制备高纯α-Al2O3粉体的技术[4-8]。这些制备工艺如无机铝盐热解法[7]、高能球磨法[8]等需要煅烧前驱体。然而,由于在相变过程中实现晶格转变需要巨大的能量[9], 因而煅烧温度通常相对较高,得到的α-Al2O3晶粒往往过粗,烧结活性较低。此外,较高温度的煅烧会消耗更多的能量[10],近年来许多研究人员采取了各种措施来降低α-Al2O3的合成温度。Morinaga 等[11]以AACH(碳酸铝铵)为原料,研究了不同煅烧气氛对氧化铝相变的影响,并在1 150 ℃、真空条件下得到了60 nm 的α-Al2O3。孙小曼等[12]通过掺杂MgO 来降低α-Al2O3的合成温度,仅0.5%(质量分数) MgO 就可将α-Al2O3的合成温度降低至1 050 ℃。Li 等[13]使用溶胶-凝胶法,在900 ℃下通过煅烧添加有质量分数为5%α-Al2O3晶种的Al(OH)3干凝胶获得了纳米α-Al2O3。Billik 等[14]通过高能球磨工艺有效降低了α-Al2O3的合成温度,并发现在高能球磨后,聚氯化铝(PACl)可在1 000 ℃下完全转化为α-Al2O3。近年来,还有一些研究结果[15-17]表明,将前驱体与某些有机物混合而后煅烧,可以有效降低α-Al2O3的合成温度。例如,Yan 等[16]使用异丙醇铝作为原料,通过溶胶-凝胶法制备α-Al2O3。他们在前体中加入了质量分数为3.5%的晶种、30%的葡萄糖和5%的聚乙烯吡咯烷酮,最后在1 000 ℃下获得粒径小于50 nm的α-Al2O3粉末。
在工业中,由于成本低和工艺简单等优势,NH4Al(SO4)2·12H2O 通常被作为合成高纯度α-Al2O3的原料,但煅烧温度较高,一般在1 100-1 300 ℃以上[18-20], 这种方式得到的α-Al2O3粉末的晶粒比较大,不便于后期应用。因此,降低煅烧温度非常重要。
1 实验部分
1.1 原料和试剂
十二水合硫酸铝铵(NH4Al(SO4)2·12H2O,熔点94.5 ℃),纯度99.9%,南通特乃博高新材料有限公司;葡萄糖(D-葡萄糖一水合物,熔点83 ℃),分析纯,国药集团化学试剂有限公司。
1.2 测试与表征
使用X 射线衍射仪(XRD,德国布鲁克(北京)科技有限公司,Bruker D8 Advance 型)在 40 kV 和40 mA 下产生的CuKα辐射分析粉末样品,扫描范围10°~80°,扫描速度8(°)/min。
通过表面积和孔径分析仪(美国Quantachrome仪器公司,N42-26e 型)测试粉末的比表面积。 取试样约100 mg,100 ℃干燥6 h,氮气吸附、脱附过程约8 h。使用Brunauer -Emmett-Teller (BET)方法计算比表面积(SBET)。
1.3 实验步骤
不同前驱体样品的配方组成见表1。将1.3 g 前驱体混合粉末放入内径为16 mm 的模具中,将部分前驱体压制成圆片,在25 MPa 压力下保压10 s。然后将粉末和片状前驱体分别放入炉中并在不同温度下煅烧4 h。最后,对得到的粉末进行表征。

表1 不同样品的配方组成Table 1 Proportion of different samples
2 结果与讨论
图1 所示为样品A0 在不同温度下煅烧4 h 后的XRD 图谱。样品在300 ℃煅烧4 h 后,结晶水已完全去除,转变为NH4Al(SO4)2;当煅烧温度升高至500 ℃时,样品转变为Al2(SO4)3;当温度升高至800 ℃时,Al2(SO4)3完全分解为γ-Al2O3;α-Al2O3的衍射峰在1 100 ℃开始出现,当温度升高至1 125 ℃时变得明显,而γ-Al2O3直到温度升高至1 150 ℃才消失,此时样品完全转变为α-Al2O3。

图1 样品A0 在不同温度下煅烧4 h 后的XRD 图谱Fig.1 XRD pattern of sample A0 after calcination at different temperatures for 4 h
图2 所示是样品A2 和A4 在不同温度下煅烧4 h后的XRD 图谱。对比图1 和图2 可以看出,加入葡萄糖后整个相变过程发生了明显变化。不加葡萄糖时(图1),相变按照NH4Al(SO4)2·12H2O→NH4Al(SO4)2→Al2(SO4)3→γ-Al2O3→α-Al2O3这一传统路线进行;添加质量分数为30%的葡萄糖时(图2(a)),相变路线变为NH4Al(SO4)2·12H2O→NH4Al(SO4)2→Al2(SO4)3→无定形→γ-Al2O3→α-Al2O3,样品在500 ℃煅烧后基本转变成非晶相,仅剩少量Al2(SO4)3;在750 ℃煅烧后转变为γ-Al2O3;经过850 ℃煅烧后可以探测到α-Al2O3;最终在950 ℃煅烧后得到单相α-Al2O3。当添加质量分数为75%的葡萄糖时(图2(b)),相变路线改变为NH4Al(SO4)2·12H2O→无定形→γ-Al2O3和γ-Al2O3→α-Al2O3。样品在150 ℃的低温下煅烧后完全转化为无定形相,结合图3,在500 ℃后形成了无定形氧化铝;在700 ℃煅烧后,样品中出现了γ-Al2O3和α-Al2O3的衍射峰;经过900 ℃煅烧,样品转化为单相α-Al2O3。与无葡萄糖添加的样品相比,添加质量分数为30%或75%的葡萄糖样品其合成温度分别降低了200 ℃和250 ℃。
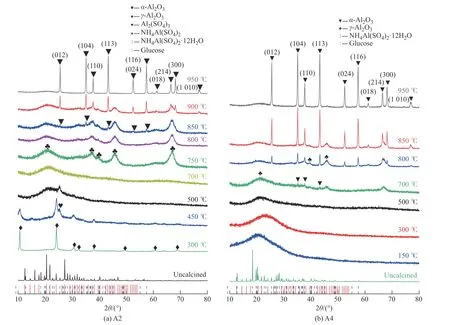
图2 A2 和A4 样品在不同温度下煅烧4 h 后的XRD 图谱Fig.2 XRD patterns of sample A2 and A4 after calcination at different temperatures for 4 h
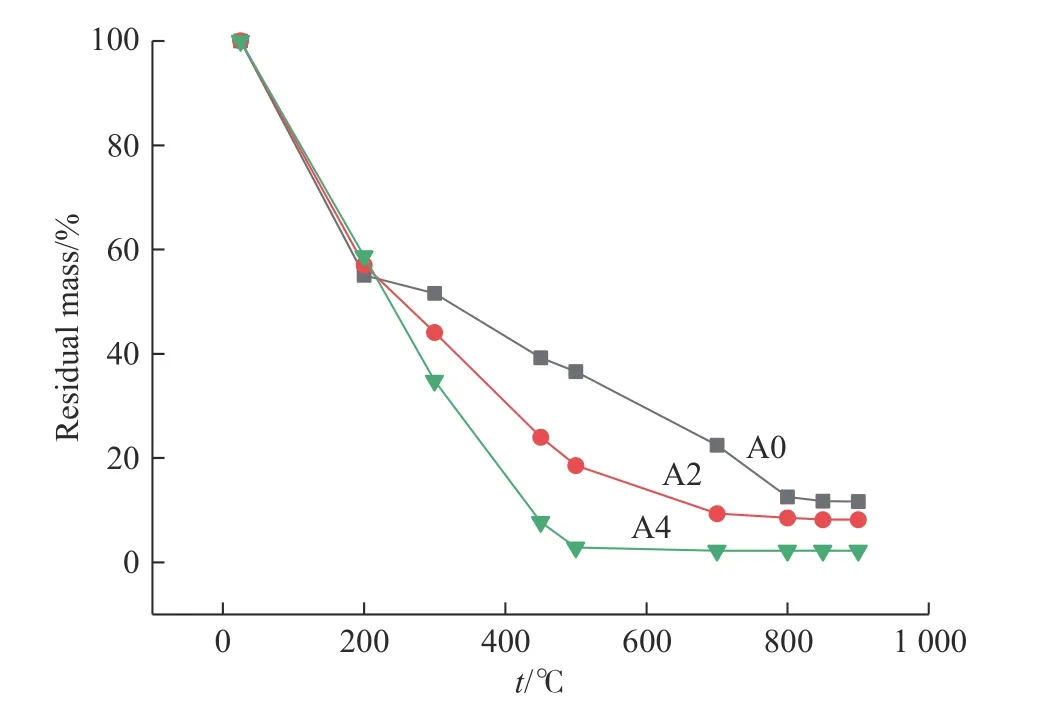
图3 A0、A2 和A4 样品在不同温度下煅烧4 h 后的热重曲线Fig.3 Thermogravimetric curves of sample A0, A2 and A4 after calcination at different temperatures for 4 h
葡萄糖可以降低α-Al2O3合成温度的原因可以从两个方面来解释。一是葡萄糖可以促进NH4Al(SO4)2·12H2O 的热分解。众所周知,前驱体NH4Al(SO4)2·12H2O 的热分解是一个吸热过程。根据任岳荣等[21]给出的热力学计算方程, 1 mol NH4Al(SO4)2·12H2O 完全分解所需的能量约为1 295 kJ(脱去结晶水需要714 kJ 能量,氨分解需要210 kJ 能量,硫酸根分解需要371 kJ 能量)。另一方面,葡萄糖的氧化分解是一个放热过程,1 mol 葡萄糖完全分解会释放2 790 kJ 能量[22]。在10 g添加有质量分数为30%葡萄糖的样品中,NH4Al(SO4)2·12H2O完全分解需要20 kJ 能量,葡萄糖完全分解可以释放的能量为42 kJ,后者是前者的两倍多,这对Al2O3的低温形成有较为明显的促进作用。在10 g 添加有质量分数为75%葡萄糖的样品中,上述的吸热值和放热值分别为7 kJ 和106 kJ,所以这使得Al2O3的合成温度进一步降低。图3 所示是A0、A2 和A4 样品在不同温度下煅烧4 h 后的热重曲线,可以看出,在t≤500 ℃时,3 种样品的热重曲线有着类似的下降趋势,然而,当温度不断升高时,这3 个曲线出现了很大的不同。A0 样品的曲线向右下方延伸直至800 ℃时变平,说明A0 样品在约800 ℃时分解基本完成。对于A2和A4 样品,分解完成的温度分别为700 ℃和500 ℃。这些结果与图1 和图2 所示的相变过程基本一致,说明葡萄糖的加入确实可以促进前驱体的分解,而且添加的葡萄糖含量越高,前驱体的分解越快。同时,葡萄糖的低温度分解在前驱体中会留下气孔,有利于SO3的逸出,这同样有利于前驱体分解。
葡萄糖的另一个作用是使NH4Al(SO4)2·12H2O均匀分散。首先,NH4Al(SO4)2·12H2O 在机械研磨阶段会被葡萄糖初步分散成小颗粒。然后,葡萄糖在83 ℃时会熔化,NH4Al(SO4)2·12H2O 在加热到高于100 ℃时也会液化,所以在加热过程中葡萄糖分散会进一步加强,并且在液化过程中NH4Al(SO4)2·12H2O的晶体结构可以被破坏成为非晶态。从图2(b) 中也可以看出,样品在低于150 ℃的温度下处于完全无定形状态,当前躯体分散均匀且呈无定形时,其活性也会变得更高,更容易分解。
为了进一步分析葡萄糖含量对粉体合成的影响,对A0 和A2 样品在800 ℃下煅烧4 h 后得到的γ-Al2O3进行BET比表面积计算和XRD 慢扫描测试(图4)。计算结果表明,当样品的葡萄糖质量分数从0 增加至30%时,其比表面积值从30.2 m2/g 显著提高至120.3 m2/g,表明了葡萄糖的造孔作用。我们认为这与NH4Al(SO4)2·12H2O的分散性显著改善和非晶相的形成有关。且有研究[23]表明,BET 比表面积越大,γ-Al2O3的活性越高,后期向α-Al2O3的转化就越有利。从图4 中可以看出,添加了葡萄糖的样品中出现了一些α-Al2O3的弱衍射峰,这些α-Al2O3可以作为后期相变的晶种,有利于其余γ-Al2O3向α-Al2O3的转化。

图4 A0 和A2 样品在800 ℃煅烧4 h 后的XRD 慢扫描图谱Fig.4 Slow scanning XRD patterns of sample A0 and A2 after calcination at 800 ℃ for 4 h
图5 所示为A1、A3 和A5 样品在不同温度下煅烧4 h后的XRD 图谱。可以看出,预压处理后相变过程没有发生改变,但是相变进程有不同程度的加速。纯NH4Al(SO4)2·12H2O 粉末经预压(A1)后在1 125 ℃下基本可以转变为α-Al2O3相,比未经预压的粉末(A0)低25 ℃左右,对含葡萄糖样品的促进作用更为明显。A3 样品在500 ℃完全转变为非晶相(图5(b)),然后在800 ℃出现α-Al2O3的衍射峰,最后在900 ℃完全转变为α-Al2O3。对于A5 样品,尽管α-Al2O3的衍射峰初次出现是在700 ℃,与A4相似,但其峰强度明显高于A4,最终在850 ℃得到纯α-Al2O3。与未预压的样品(A2、A4)相比,预压后的样品(A3、A5)合成α-Al2O3的温度可降低50 ℃左右。

图5 A1、A3 和A5 样品在不同温度下煅烧4 h 后的XRD 图谱Fig.5 XRD patterns of sample A1, A3 and A5 after calcination at different temperatures for 4 h
预压对相变过程的影响可以合理地归因于样品中团聚的破坏,Yen 等[24]在其研究中也表明了类似的结论,通过对样品施加压力,可以破坏样品的团聚体,从而增强样品中颗粒排列的均匀性。此外,由于NH4Al(SO4)2·12H2O 和葡萄糖质地相对较软,在高压下可能会发生塑性流动。这两种作用都有助于前驱体的均匀混合和低温相变,目前相关研究仍在进行中。
表2 示出了由A0、A3 和A5 样品得到的α-Al2O3粉末的BET 比表面积。随着葡萄糖含量的增加,α-Al2O3的SBET值迅速增加。特别是A5 样品在850 ℃煅烧后得到的α-Al2O3的SBET达到24.5 m2/g。图6所示为A5 样品在850 ℃煅烧4 h 后的形貌。可以看出样品较松散,粒径分布均匀(平均粒径约为110 nm)。

图6 A5 样品在850 ℃煅烧4 h 后的SEM 图片Fig.6 SEM image of sample A5 calcined at 850 ℃ for 4 h

表2 不同配方样品制备得到的α-Al2O3 的SBETTable 2 SBET of α-Al2O3 prepared by samples with different formulations
3 结 论
(1)葡萄糖的加入和预压处理可有效降低NH4Al(SO4)2·12H2O煅烧合成α-Al2O3粉体的温度。
(2)添加质量分数30%和75%葡萄糖的样品,其合成α-Al2O3粉体的温度分别为950 ℃和900 ℃,比未加入葡萄糖样品的合成温度分别低了200 ℃和250 ℃。与未预压的样品(A0、A2 和A4)相比,预压可使α-Al2O3的合成温度进一步降低。25 MPa 下,样品A1、A3 和A5 合成α-Al2O3粉体的温度分别比A0、A2 和A4 降低了25、50、50 ℃。
(3)葡萄糖降低α-Al2O3合成温度的原因主要有两点:葡萄糖的氧化分解热会加速NH4Al(SO4)2·12H2O的热分解;使NH4Al(SO4)2·12H2O分散均匀以及无定形化。预压处理促进合成可能与团聚的破坏和粉末分散的进一步均质化有关。

