子痫前期并发胎儿生长受限临床特征及母婴结局分析
戴小燕 朱琳飞 于威威
(厦门大学附属妇女儿童医院 厦门市妇幼保健院,福建 厦门 361003)
子痫前期(preeclampsia,PE)是妊娠期特有疾病,属于妊娠期高血压疾病的一种,存在多因素、多机制、多通路发病综合征性质[1],可增加早产、胎盘早剥、胎儿生长受限、死胎等风险[2],是导致孕产妇及围生儿病死率升高的主要原因之一[1,3]。胎儿生长受限(fetal growth restriction,FGR)是指受母体、胎儿、胎盘等病理因素影响,胎儿生长未达到其应有的遗传潜能,多表现为胎儿超声估测体质量或腹围低于相应胎龄第10百分位[4]。相关研究表面,子痫前期的发生与胎盘子宫螺旋动脉重铸障碍有关,子痫前期患者的螺旋动脉呈漏斗状,且仅限于蜕膜处的分支而未及基层的动脉干或放射动脉,使得胎盘血流灌注减少,胎盘功能减退,导致胎儿宫内生长受限,并引发一系列的全身病例变化[5]。然而,FGR是否与子痫前期的严重程度有关,是否与母婴不良结局有关,尚存在争议。本研究对740例子痫前期患者是否并发FGR的临床体征及母婴结局进行分析,旨在发现二者的相关性,为临床诊治提供依据。
1 资料与方法
1.1 一般资料 回顾性收集2020年1月至2022年12月在厦门市妇幼保健院产科住院分娩的单胎子痫前期患者共740例。根据是否并发FGR分为两组,并发FGR为观察组(85例),其中年龄:<35岁66例、≥35岁19例,平均年龄(31.21±4.55)岁;受教育程度:≤12年48例、>12年37例;孕次:1次36例、2次26例、3次13例、≥4次10例;产次:0次60例、1次22例、2次3例、≥3次0例;入院类型:门诊55例、急诊30例;辅助生殖助孕3例。未并发FGR为对照组(655例),其中年龄:<35岁489例、≥35岁166例,平均年龄(31.71±4.59)岁;受教育程度:≤12年269例、>12年386例;孕次:1次311例、2次169例、3次88例、≥4次87例;产次:0次430例、1次188例、2次32例、≥3次5例;入院类型:门诊432例、急诊223例;辅助生殖助孕59例。患者对研究内容知情同意并签署知情同意书,本研究已获得我院伦理委员会的批准。
1.2 纳入标准 纳入标准:①资料完整。②符合PF[6]及FGR[4]的诊断标准。排除标准:①合并慢性肾炎。②1型糖尿病。③慢性高血压病史。④有精神病史。
1.3 观察指标 ①发生率:子痫前期并发FGR的发生率。②妊娠结局:分娩孕周、不同孕周构成比、死胎率、剖宫产率、住院天数。③孕产妇并发症及合并症:HELLP综合征、胎盘早剥、羊水过少、胎儿宫内窘迫、胸腔积液、免疫系统疾病、胎盘位置异常、甲状腺功能疾病、胎儿脐血流异常、胎膜早破、肺水肿、肥胖、血小板减少、糖尿病、胆汁酸淤积症及贫血。④新生儿并发症:新生儿肺炎、视网膜病、围生期脑损伤、湿肺、新生儿贫血的发生率。两组蛛网膜下腔出血、新生儿呼吸窘迫、肺透明膜病。
1.4 统计学方法 应用SPSS 25.0软件进行统计学分析。对结果中的各项数据进行基本统计描述,计量资料采用t检验,计数资料以采用χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 子痫前期并发FGR的发生率 本研究中,单胎子痫前期患者共740例,其中并发FGR发生率为11.49%(85/740)。早发型子痫前期(<34周)47例,并发FGR发生率为65.96(31/47),晚发型子痫前期(孕周≥34周)693例,并发FGR发生了为7.79%(54/693),二者比较差异有统计学意义(P<0.05)。
2.2 两组妊娠结局比较 观察组的死胎率明显高于对照组。观察组活产分娩孕周明显小于对照组(P<0.05),观察组死胎分娩孕周与对照组无明显差异(P>0.05)。观察组剖宫产率、住院天数及ICU转诊率均明显高于对照组(P<0.05)。见表1。活产分娩者,两组不同分娩孕周的构成比各不相同,观察组主要于34~36+6周分娩,对照组主要于孕足月后分娩(P<0.05)。对于死胎者,两组不同分娩孕周的构成比无明显差异,两组都主要于孕28~33+6周前分娩。见表2。
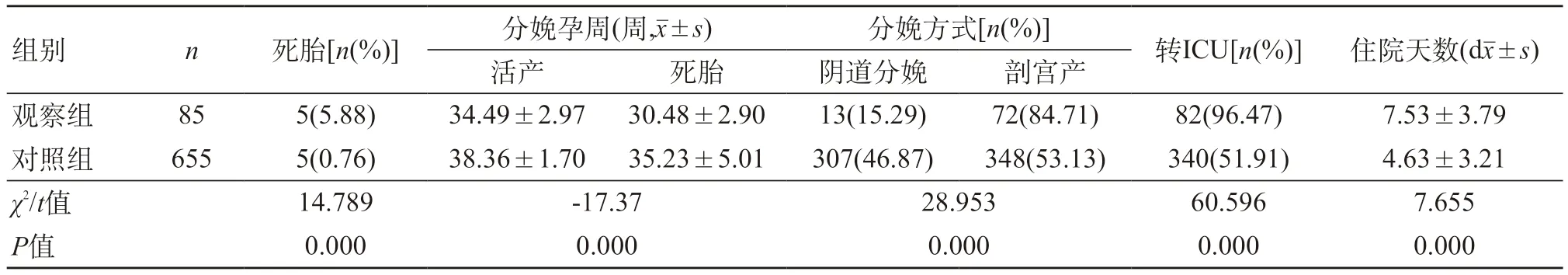
表1 对比两组患者的妊娠结局
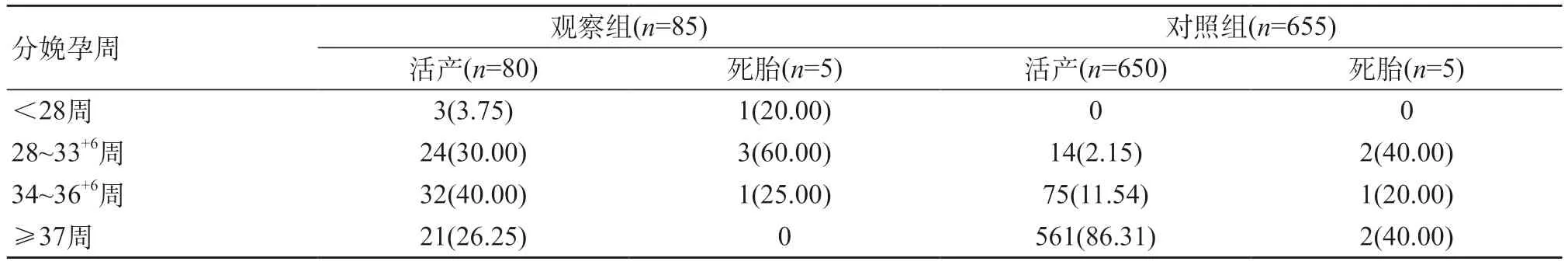
表2 对比两组患者分娩孕周的构成比[n(%)]
2.3 两组妊娠并发症及合并症比较 观察组HELLP综合征、胎盘早剥、羊水过少、胎儿宫内窘迫、胸腔积液、免疫系统疾病、胎盘位置异常、甲状腺功能疾病、胎儿脐血流异常的发生率明显高于对照组,差异均具有统计学意义(P<0.05)。观察组胎膜早破的发生率明显低于对照组,差异均具有统计学意义(P<0.05)。见表3。

表3 对比两组患者妊娠并发症及合并症情况[n(%)]
2.4 两组新生儿一般情况及结局比较 对两组患者活产新生儿一般情况进行比较发现,差异具有统计学意义(P<0.05)。对照组无小于28周分娩的新生儿。见表4。观察组新生儿肺炎、视网膜病、围生期脑损伤、湿肺、新生儿贫血的发生率明显高于对照组(P<0.05)。两组蛛网膜下腔出血、新生儿呼吸窘迫、肺透明膜病的发病率比较差异均无统计学意义(P>0.05)。见表5。
表4 对比两组患者新生儿一般情况()

表4 对比两组患者新生儿一般情况()

表5 对比两组患者新生儿并发症情况[n(%)]
3 讨论
3.1 子痫前期并发FGR的发病率 妊娠期高血压疾病严重威胁母儿健康和安全,是产科常见的并发症,也是孕产妇死亡的重要原因之一,尤其子痫前期-子痫是导致孕产妇及围生儿病死率升高的主要原因之一[1]。国外报道子痫前期的发病率约为5%[5],我国的子痫前期发病率约4.5%[7]。FGR病因十分复杂,目前主要为母体因素、胎儿因素及胎盘因素,一般与遗传、环境、妊娠并发症及合并等因素有关[8]。2019年美国妇产科医师学会颁布的妊娠期高血压疾病指南中,未将FGR作为评判重度子痫前期的指标,但2020年颁布的《妊娠期高血压疾病诊治指南(2020)》中,仍将FGR作为重度子痫前期的指标之一[1]。本研究统计了我院近3年子痫前期并发FGR的发生率为11.49%,其中早发型及晚发型子痫前期并发FGR的发生率分别为65.96%和7.79%(P<0.05),早发型子痫前期并发FGR的发生率明显高于晚发型,差异有统计学意义。这与《妊娠期高血压疾病诊治指南(2015)》[9]中指出的早发型子痫前期并发FGR的发生率达21.7%~61.9%基本相符。
3.2 子痫前期并发FGR的终止妊娠孕周 本研究显示,FGR与早发型子痫前期的关系更为密切,FGR可能是导致分娩孕周缩短的主要因素。这与吴海莲[10]等研究发现相一致。近年来研究[10-12]表明,重度子痫前期并发FGR的病情较为严重,多数患者药物治疗效果欠佳,现代研究多认为子痫前期为妊娠期特有疾病,适时终止妊娠可减少对母儿的损害,故子痫前期并发FGR时,终止妊娠的孕周明显提前。
3.3 子痫前期并发FGR的母儿结局 本研究显示,子痫前期并发FGR即观察组的母儿不良结局的风险升高。在母体并发症及合并症方面,观察组的HELLP综合征、胎盘早剥、羊水过少、胎儿宫内窘迫、胸腔积液、免疫系统疾病、胎盘位置异常、甲状腺功能疾病、胎儿脐血流异常的发生率明显高于对照组,差异有统计学意义,两组肺水肿、肥胖、血小板减少、糖尿病、胆汁酸淤积症及贫血的发病率比较差异均无统计学意义;在新生儿不良结局方面,观察组新生儿肺炎、视网膜病、围生期脑损伤、湿肺、新生儿贫血的发生率明显高于对照组。两组蛛网膜下腔出血、新生儿呼吸窘迫、肺透明膜病的发病率比较差异均无统计学意义。近年来许多临床研究认为,子痫前期若并发FGR,其母婴的不良结局明显上升[13-14]。子痫前期并发FGR被认为与高血压全身小血管痉挛、血管表皮受损、血管重铸障碍、胎盘浅着床、胎盘血流低灌注及低氧有关,由此可致氧化反应激进,影响营养物质运送,从而形成FGR,导致不良结局的发生。本研究还发现,观察组剖宫产率明显高于对照组,这可能与因胎盘早剥、羊水过少、胎儿宫内窘迫而手术终止妊娠的比例增高有关。同时高剖宫产率也增加患者住院天数。
本研究发现,观察组死胎发生率明显高于对照组。观察组不同孕周阶段的新生儿平均出生体质量、平均身长及平均头位均低于对照组,且两组间的差异随着孕周的增长越来越明显。子痫前期患者的基本病理生理改变是全身小动脉痉挛,异常滋养细胞侵入子宫螺旋动脉过浅、子宫动脉重铸障碍等导致胎盘血流灌注减少,胎盘缺血缺氧,胎盘功能减退,导致胎儿宫内生长受限[5],若损害严重,则导致胎儿缺氧、死胎发生。
综上所述,我们认为,子痫前期与FGR的发生密切相关,子痫前期患者一旦并发FGR,其发生严重并发症及合并症的风险明显上升,新生儿并发症的发生率也明显升高。因此,临床工作人员要更加关注此类患者,提高对子痫前期的早起识别能力,早期干预,控制病情,改善母儿的不良结局。

