海洋细菌对稀土元素铈的富集矿化过程研究
姜明玉,曹文瑞,萨仁高娃,常凤鸣
1. 中国科学院海洋研究所海洋地质与环境重点实验室,青岛 266071
2. 中国科学院海洋大科学研究中心,青岛 266071
3. 崂山实验室海洋地质过程与环境功能实验室,青岛 266237
稀土元素对新型电子设备和新能源技术的发展至关重要,也是很多国家改造传统产业,发展高新技术和国防尖端技术不可或缺的战略资源。我国是稀土原材料的主要加工地(约85%),同时也是世界最大的稀土氧化物消费国[1]。当前,受全球绿色能源转型的推动,未来清洁能源技术相关的需求可能会进一步增长。由于这样巨大的需求前景和潜在的供应链风险,近年来很多国家开始寻求新的稀土矿产资源[2]。日本学者Kato 等在2011 年报道了在南太平洋东部和北太平洋中部广泛分布着具有高稀土含量的深海沉积物,其中深海泥中总稀土含量可高达1 000~2 230 μg/g,其稀土含量与我国华南离子吸附型矿床相当或更高[3],这一报道引发了国内外学者对深海富稀土沉积物研究的热情。
在自然界,稀土矿物被发现存在于内生和表生或次生矿床中。内生矿床指在地壳中通过岩浆-热液过程形成的矿床[4],而表生或次生矿床则通过风化和沉积过程在地表形成[5];前者主要包括碳酸岩、碱性岩和热液型矿床,后者主要为离子吸附型、砂矿和海底沉积型矿床[6-7]。有学者研究发现,我国华南离子吸附型稀土矿床中稀土元素的富集主要受铁氧化物-黏土矿物复合体的共同约束[8]。而对于海底沉积物型的稀土矿物的形成过程,近些年的研究也取得了一些进展[9-11]。印度洋海盆的沉积物中有非常高的稀土含量, 稀土元素的组成和太平洋接近,其来源主要受到陆源物质和火山物质影响,推测稀土元素可能是吸附在其他物质沉积后再向磷灰石富集[12-13]。东太平洋CC 区多个富稀土站位沉积物均以沸石黏土为主,西太平洋深海底泥中稀土元素的主要赋存矿物为磷酸盐矿物,包括磷灰石、独居石和磷钇矿等[14-15]。然而随着研究的深入,研究者发现在各种矿物的形成过程中也包含了微生物驱动的生物矿化的过程,矿物-微生物相互作用在环境变化、元素生物地球化学循环和矿床形成中起着重要作用[16]。微生物广泛分布于各种海洋地质环境中,它们参与了从地球表面到地下深部岩石圈中很多的地质地球化学过程[17]。研究发现海洋微生物是海底沉积作用和成矿作用的主要参与者和作用者,微生物不仅能催化成矿元素富集、沉淀直接成矿,而且还可以改变介质的酸碱条件促使成矿元素沉淀聚集而间接成矿[18-20]。深海矿物的形成也包含了微生物(生物矿化)驱动的生物过程。例如在富稀土的大洋多金属结核中发现的颗石藻化石以及生物膜的印记[21],还有研究发现海洋细菌在产生氧化表面的沉积物中起关键作用[22]。
海洋沉积物中微生物多样性的分析提示了微生物参与了海洋地质环境的形成过程[23-26]。海洋微生物在稀土矿产资源形成过程中发挥的作用以及稀土元素的海洋微生物成矿过程尚不明确。为了探讨这些问题,我们选取了从深海沉积物中成功分离培养的几种细菌,开展了海洋细菌对稀土元素富集和矿化过程的研究,期待能为大洋中稀土矿产资源的生物成因过程提供一些理论依据,具有十分重要的学术意义和实际意义。
1 材料与方法
通过收集整理前期已经成功从沉积物样品(东海大陆架CW126/冲绳海槽CW27)中分离纯化的200 余株单克隆菌落,通过比较微生物的分布规律、数量及种类,初步筛选出3 种海洋细菌进行实验室稀土元素铈(Ce)的吸附富集模拟实验。沉积物样品的采样站位图如图1 所示。从冲绳海槽表层沉积物(表层4 cm, 水深1 193 m)中分离培养出Paenisporosarcinasp. CW27-A08(芽孢八叠球菌),从东海大陆架表层沉积物(表层1 cm, 水深81.13 m)中分离培养出Jeotgalibacillussp. CW126-A03(咸海鲜芽孢杆菌)和Sulfitobactersp. CW126-B11(亚硫酸杆菌)。菌株CW27-A08 为革兰氏阳性菌, 呈椭圆或杆状, 大小约1.0~2.0 μm, 菌株16s RNA 基因序列为GenBank No.KP307800。菌株CW126-A03 为革兰氏阳性菌,呈椭圆或杆状,大小约1.5~2.0 μm,菌株16s RNA 基因序列为GenBank No.MT845653。菌株CW126-B11 为革兰氏阴性菌,呈杆状,大小约0.5~1.5 μm,菌株16s RNA 基因序列为GenBank No.KP307833。将冻存于-80 ℃冰箱中的菌种活化后接种到2216E 液体培养基中, 在25 ℃摇床120 r/min 下培养1 天后备用。2216E 培养基组成为:过滤后的天然海水,5 g/L 蛋白胨,1 g/L 酵母提取物,混合后pH 调节至7.25。

图1 沉积物样品采样站位图Fig.1 Map of sediment sampling stations
实验室模拟不同海洋细菌对稀土元素Ce 的吸附富集实验,实验中设置不同浓度Ce 的反应体系,反应温度为4 ℃,反应时间0~2 个月。反应过程中在不同的时间点间隔取样, 测定反应体系中稀土Ce 离子浓度的变化和pH 值的变化,并通过扫描电镜(SEM-scanning electron microscope)和透射电镜(TEM-transmission electron microscope)及能谱仪(EDS-energy dispersive spectrometer)观察不同反应时间细菌表面稀土元素Ce 形态的变化情况。反应体系采用人工海水(24.32 g/L NaCl, 10.98 g/L MgCl2·6H2O, 4.06 g/L Na2SO4, 0.20 g/L NaHCO3, 0.027 g/L H3BO3, 0.10 g/L KBr, 0.69 g/L KCl, 1.14 g/L CaCl2),pH 为7.8。实验实施过程中测定反应体系中细菌密度的方法为:将已知体积的菌液离心后(6 000 rpm),去掉上清液,放入冰箱冷冻后进行低压冷冻干燥,称量菌体的干重。反应中所用的溶液和实验器材都经过灭菌处理,实验在无菌操作台中进行。
采用电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS, Thermo Fisher 公司, ICAPQC)测定反应体系中的稀土元素Ce 和P 的离子浓度。在不同反应时间点取样,离心后吸取上清液,并用0.22 μm 聚四氟乙烯滤膜过滤后制成测试样品,测定元素浓度。运用扫描电镜(SEM,Hitachi, S-4800 型)分析测定模拟实验中细菌表面形态的变化。取反应液4 000 r/min 离心10 min 后去除上清液, 用超纯水反复清洗菌液3 遍后, 吸取少量菌液滴到硅片上, 烘干后固定于电镜样品台上,进行扫描电镜观察, 工作电压15 kV。采用透射电镜(TEM,荷兰飞利浦公司, CM12/STEM)考察相互作用过程中微生物表面形成的矿物形态。取反应液在4 000 r/min离心10 min 后去除上清液, 用超纯水反复清洗菌液3 遍, 重悬后吸取少量菌液滴到铜网上, 待干燥后进行观察。工作电压为120 kV,点分辨率0.34 nm,配备电子衍射分析系统和能谱分析系统。
2 结果与讨论
2.1 不同海洋细菌对稀土元素Ce 的吸附富集过程
已经成功分离培养并筛选出的成矿微生物菌株CW126-A03(标记为A03)、菌株CW27-A08(标记A08)、菌株CW126-B11(标记为B11)的SEM 图展示了3 种海洋细菌的形貌特征(图2)。3 种海洋细菌均呈现椭圆状或杆状,大小约0.5~2.0 μm。通过观察三种细菌接种后的生长周期,均在12~24 h处于对数生长期,此时细胞数量迅速增长,代谢活动旺盛,适宜进行接种实验。在24 h 后,生长速率逐渐降低,细菌生长进入稳定期。
在设定4℃人工海水的环境下,分别考察了3 种不同海洋细菌对Ce 的吸附富集过程。利用ICP-MS 测定不同反应时间下(0~2 个月)元素Ce、P 浓度的变化,并检测反应过程中pH 值的变化,分析海洋细菌吸附稀土元素的化学动力学过程。图3显示了不同海洋细菌对稀土元素Ce 吸附的时间曲线,其中Ce 的初始浓度均为1.4 μg/g,反应体系中菌株CW126-A03、菌株CW27-A08、菌株CW126-B11的细菌干密度分别为0.26 、0.12、0.10 g/L。Ce 的吸附率为反应溶液中Ce 离子浓度降低值占Ce 初始浓度值的百分比数。随着反应时间的增长,溶液中Ce 浓度相对于初始Ce 浓度的降低,反映了稀土Ce 被海洋细菌吸附富集的过程。结果显示3 种不同的海洋细菌对稀土元素都有富集作用,反应体系中稀土元素的浓度随着反应时间的增长而逐渐降低,稀土元素Ce 的累计吸附率随时间增长而逐渐增大。从吸附曲线上可以看出,海洋细菌对Ce 初期的吸附速率较快,3 种细菌初始的吸附率均达到60%以上,并在反应2 周后达到95%以上。菌株CW126-B11 相对于CW126-A03 和CW27-A08 对稀土Ce 有较快的吸附效率。

图3 不同海洋细菌对Ce 的时间吸附曲线Fig.3 Curves of time-dependent adsorption of Ce by different marine bacteria
图4 显示了3 种不同海洋细菌吸附富集稀土Ce 的过程中反应体系中P 元素浓度的变化趋势大概相似。随着反应时间的增长体系中P 的浓度都呈现先快速降低,随后保持低浓度一段时间,然后再升高的一个过程。说明海洋细菌在吸附富集稀土Ce 的过程中,大致可以分为3 个阶段。在起初的24 h 内,带正电荷Ce3+被快速地吸附在细胞表面,与细胞表面带负电荷的官能团(尤其以磷酸盐官能团为主)形成络合物,从而消耗了初始溶液中细菌代谢产生的P[27]。随着稀土Ce 被细菌富集完成,溶液中的P 浓度被消耗从而保持在低浓度状态。然而随着反应时间的增长,溶液中细菌的活性减弱,细胞壁可能会破裂,从而导致P 从细胞中逐渐被释放出来,因而反应体系中的P 浓度又会增高。反应初期溶液中P 浓度的降低和Ce 的迅速被吸附相对应,表明海洋细菌对稀土Ce 有一个快速细胞表面吸附的过程。这个现象与之前发现的真菌和细菌对稀土的吸附过程相似[28]。研究发现不同海洋细菌的反应体系中,反应过程中pH 的变化范围相似(在7.3~7.8 之间)(图5),反应初期稍有波动,后期相对较稳定。

图4 反应过程中P 浓度随时间的变化规律Fig.4 Variation of P concentration with time during the reaction
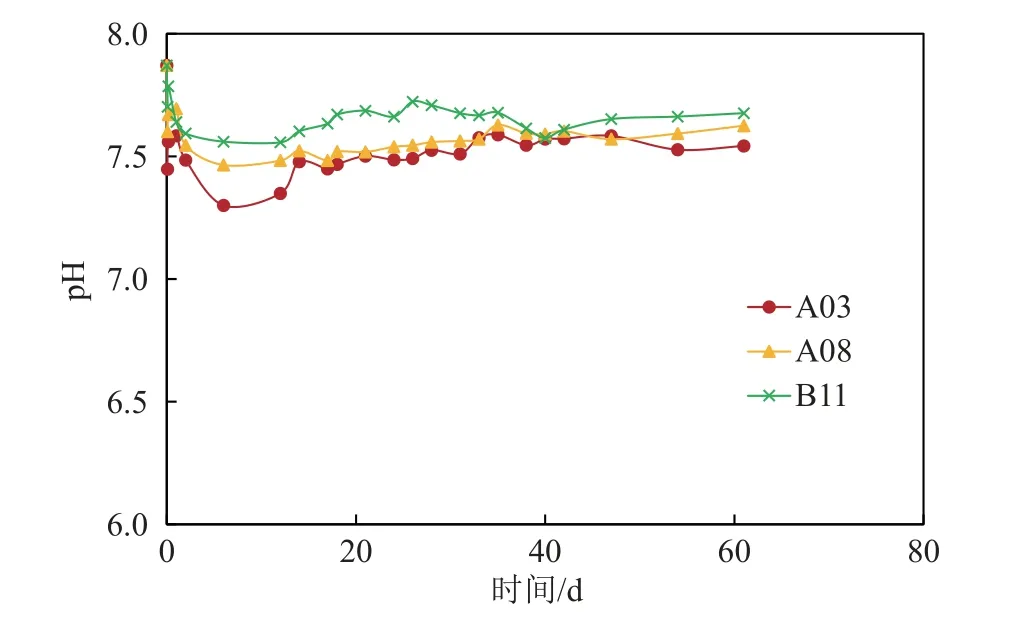
图5 反应过程中pH 的变化Fig.5 The change of pH during the reaction
2.2 海洋细菌对稀土元素Ce 吸附富集的影响因素
图3 展示了不同的海洋细菌对稀土元素的吸附速率也有所不同,在相同Ce 初始浓度的反应体系中,菌密度较低的革兰氏阴性菌CW126-B11 依然比菌密度高的革兰氏阳性菌CW126-A03 和CW27-A08 吸附富集稀土Ce 的效率稍高,初步推断这与微生物自身的组成结构及细胞表面的结构特征有关[29]。此外,通过研究同种海洋细菌CW126-A03 对稀土元素Ce 在不同初始浓度条件下的吸附过程,来进一步考察海洋细菌吸附富集Ce 的影响因素。实验中设置了3 个反应体系,分别为Ce 初始浓度为0.14 ug/g 时CW126-A03 菌干密度为0.36 g/L;Ce 初始浓度为1.4 μg/g 时细菌干密度为0.26 g/L;Ce 初始浓度为14 μg/g 时细菌干密度为0.36 g/L。图6 显示了CW126-A03 对Ce 在7 天内的短期吸附过程,细菌密度较大反应体系中(0.14 μg/g 和14 μg/g)对稀土Ce 的吸附速率较快。在相同菌密度条件下,稀土Ce 初始浓度较低的体系(0.14 μg/g)中细菌的吸附速率在前4 天相对稍快一些。
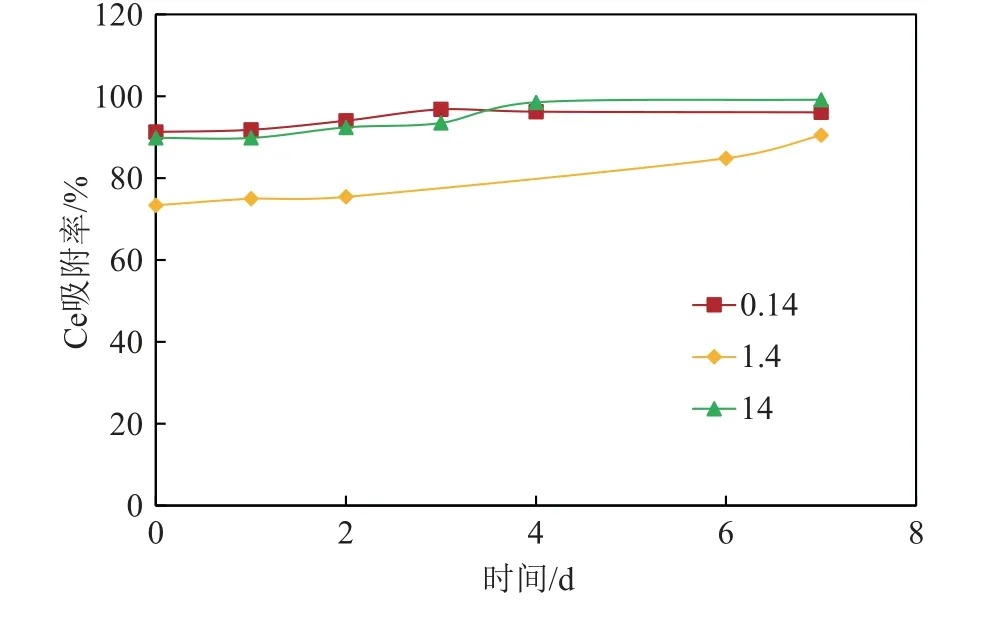
图6 Jeotgalibacillus sp. CW126-A03 对Ce 的短期吸附过程Fig.6 Process of short-term adsorption of Ce by Jeotgalibacillus sp. CW126-A03
图7 显示了CW126-A03 对Ce 在45 天内的相对较长期吸附过程,3 种不同体系中反应初期14 天内的吸附速率各有不同,随着反应时间增长,14 天后海洋细菌对稀土Ce 的富集率都达到98%以上。这些实验结果表明海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,在相同的元素浓度条件下,菌密度越高短期的吸附速率越快。而随着吸附富集时间的增长,细菌活性降低及代谢产物的增加,可能会诱导稀土元素完成更多的富集和沉淀。综上所述,细菌种类以及细菌密度与被吸附元素浓度的比例关系,是影响海洋细菌富集稀土元素的主要影响因素。前期有研究表明,不同微生物细胞壁的结构特征不同,细胞表面的吸附位点(官能团)数量也不同,因而对金属阳离子的吸附能力也有差异[30-32]。

图7 Jeotgalibacillus sp. CW126-A03 对Ce 的长期吸附过程Fig.7 Process of long-term adsorption of Ce by Jeotgalibacillus sp. CW126-A03
结果显示3 种细菌对Ce 均有吸附富集作用,在几个不同的反应体系中,海洋细菌对稀土Ce 有一个快速细胞表面吸附的过程,都表现出在初期10 h 内稀土元素的富集速率明显大于后期阶段,能完成90%以上的富集。3 种不同体系中反应初期14 天内的吸附速率各有不同,随着反应时间增长,14 天后海洋细菌对稀土Ce 的富集率都达到98%以上。海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,即主要受金属/生物量比率的影响[33]。另外不同的海洋细菌细胞壁结构不同,对稀土元素的吸附力也有所不同。
2.3 稀土元素Ce 富集成矿过程中细菌表面的矿物形态分析
实验中在不同时间间隔取样并收集吸附后的微生物样品,利用SEM 和TEM-EDS 分析手段测定稀土元素Ce 富集成矿过程中Ce 形态的变化和所生成的稀土矿物的组成,从而进一步分析讨论海洋细菌对稀土矿化的过程和作用机理。图8 显示了菌株CW126-A03 富集稀土Ce 七天后的SEM 图像,反应体系中稀土Ce 的初始浓度为1.4 μg/g,细菌干密度为0.26 g/L。SEM 图中展示了在细菌表面及周围有大量的沉积颗粒物,颗粒物的大小约几百纳米,有的聚集在一起形成较大的颗粒物,暗示菌株CW126-A03 对稀土Ce 有富集成矿的作用。菌株CW126-A03 和CW126-B11 富集稀土Ce 3 天后的TEM 图像(图9)更清晰地展示了细胞表面富集沉积颗粒的形态,两种海洋细菌表面均聚集了大小不同的微小颗粒物,大小约为50~200 nm,这些颗粒物在细胞表面分布不均匀。有研究报道,不同细菌细胞壁表面总官能团位点密度不同,因而对金属阳离子的吸附和络合能力也不同[30],从而导致不同海洋细菌对稀土元素的吸附富集能力也不同。

图8 Jeotgalibacillus sp. CW126-A03 富集稀土Ce 的SEM 图像Fig.8 SEM image of Jeotgalibacillus sp. CW126-A03 enriched in Ce

图9 Jeotgalibacillus sp. CW126-A03 和Sulfitobacter sp. CW126-B11 富集稀土Ce 的TEM 图像Fig.9 TEM image of Jeotgalibacillus sp. CW126-A03 and Sulfitobacter sp. CW126-B11 enriched in Ce
图10 中显示了菌株CW126-B11 富集稀土Ce的TEM-EDS 图像,通过EDS 进一步解析了细菌表面生成的沉积物颗粒组成,细菌吸附反应3 天后在细胞表面形成的颗粒物中含有明显的Ce、P、Si 以及其他组成细胞的基本元素成分,并对细胞表面含Ce 的矿物颗粒(白色圆圈内)进行了电子衍射光谱的分析,显示矿物颗粒呈现无定形态的非晶相结构。这些数据显示在长时间的吸附过程中海洋细菌表面形成了含稀土元素Ce 的磷酸盐或硅酸盐沉淀颗粒,生物吸附导致了稀土元素从反应溶液中的提取并矿化,与前面溶液中Ce 浓度变化的数据(图3、7)相吻合。研究结果表明海洋细菌在稀土的矿化过程中起着重要作用,稀土元素先快速吸附在细胞表面,随着吸附时间增长,被吸附的Ce 逐渐富集生成含稀土的矿物颗粒(直径50~200 nm)。
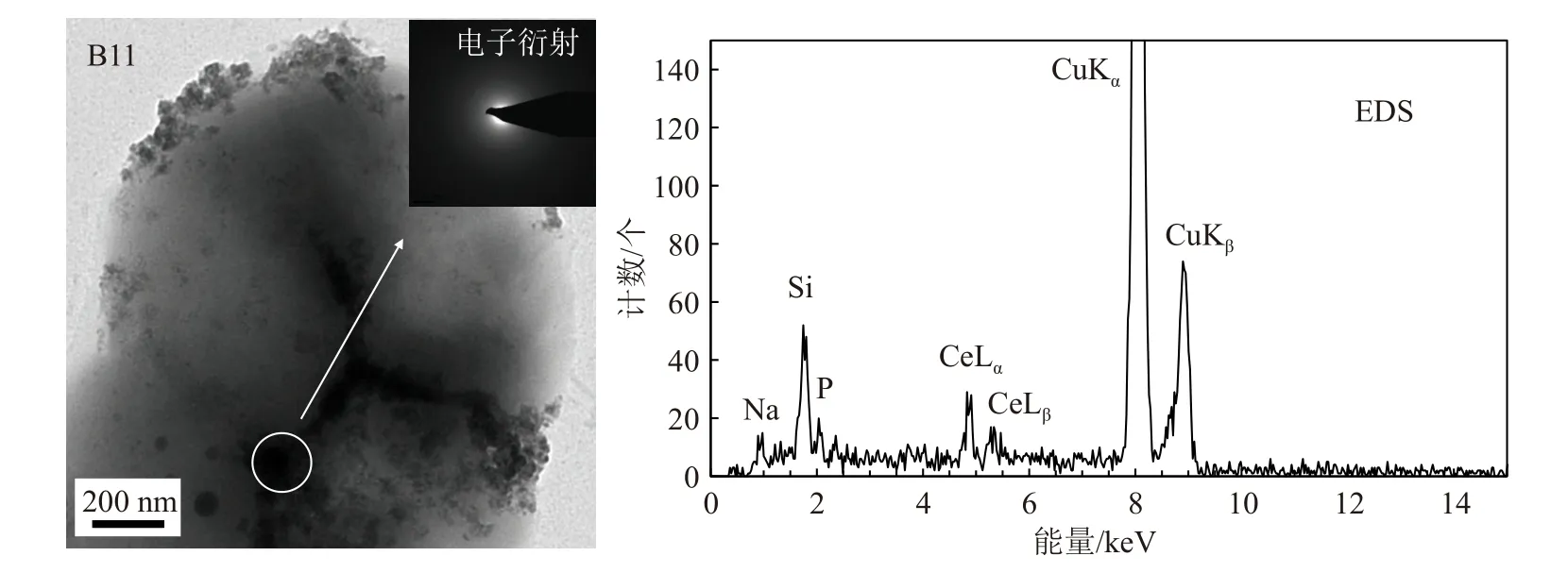
图10 Sulfitobacter sp. CW126-B11 富集稀土Ce 的TEM-EDS 图像Fig.10 TEM-EDS image of Sulfitobacter sp. CW126-B11 enriched in Ce
研究发现稀土元素可以在细胞表面被矿化形成含稀土Ce 的磷酸盐或硅酸盐非晶相结构的矿物颗粒。综合实验结果表明稀土元素Ce 首先被吸附在细胞表面形成成核点,随后被吸附的稀土离子与细胞内部释放出来的P 等元素反应,在细菌表面形成含有稀土元素Ce 的矿物颗粒。说明海洋细菌在稀土的矿化过程中起着重要作用,稀土元素先快速吸附在细胞表面,随着吸附时间增长,逐渐被富集生成含稀土的矿物颗粒(直径50~200 nm),这些矿物颗粒大小可能随富集时间的增长而增大,甚至从细胞表面脱落下来,从而进一步讨论了海洋细菌对稀土元素富集矿化过程和作用机理。
3 结论
(1)三种不同海洋细菌菌株CW126-A03、菌株CW27-A08、菌株CW126-B11 对稀土Ce 均有吸附富集作用。海洋细菌吸附富集稀土元素的效率主要与细菌密度和稀土元素浓度有关,即主要受金属元素/生物量比率的影响[33]。另外不同的海洋细菌细胞壁结构不同,对稀土元素的吸附力也有所不同。
(2)利用SEM、TEM-EDS 分析测定稀土元素富集成矿过程中稀土元素Ce 形态的变化和所生成的稀土矿物的结构,研究发现稀土元素Ce 首先被吸附在细胞表面形成成核点,随后被吸附的稀土离子与细胞内部释放出来的P 等元素反应,在细胞表面被矿化形成含稀土Ce 的磷酸盐或硅酸盐非晶相结构的矿物颗粒。
(3)通过初步开展海洋细菌对稀土元素富集和矿化过程的研究,进一步讨论了海洋微生物成矿的过程和作用机理,期待能为大洋中稀土矿产资源的生物成因过程提供一些理论依据。同时也因实验条件有限,实验室不能完全模拟海底环境,模拟实验中还存在一些不足之处,期待本研究能为后面的研究提供一些借鉴。

