基于Wnt/β-catenin信号通路的复方补肾活血颗粒对骨髓间充质干细胞成骨、成脂分化的影响
乔明珠 ,吕浩 ,胡芷苜 ,梁龙 ,江渟
1.安徽中医药大学研究生院,安徽 合肥 230031; 2.安徽中医药大学第一附属医院,安徽 合肥 230031
骨质疏松症(osteoporosis,OP)是以骨量减少、骨组织微小结构发生变化为主要特征的骨代谢疾病之一,容易引起骨脆性增加、骨折风险升高[1]。骨髓间充质干细胞(BMSCs)是一类能在机体内自行更新并分化为中胚层细胞、具有多向分化潜能的成体干细胞[2]。BMSCs的增殖能力减弱会引起成骨细胞活力下降和成骨分化能力受到抑制[3]。研究表明,骨-脂间平衡与BMSCs分化为成骨细胞或成脂细胞有重大联系,OP是骨-脂间平衡被破坏导致的代谢性疾病,其特征为骨髓内脂肪细胞过度积累而成骨细胞比例降低,骨量减少[4]。BMSCs促进骨修复主要是通过增强成骨分化,抑制成脂分化。因此,调控BMSCs分化对于代谢性骨病的治疗至关重要。Wnt/β-catenin信号通路是BMSCs分化的经典途径[5],主要由细胞外分泌蛋白Wnt家族细胞膜上的跨膜受体、胞质内的降解复合体和β-连环蛋白(β-catenin)等组成。成骨分化过程中的Runt相关转录因子2(RUNX2)和脂肪形成过程中的过氧化物酶体增殖物激活受体(PPAR)γ被认为是BMSCs分化的重要调节因子[6],激活Wnt/β-catenin信号通路在促进BMSCs骨形成相关基因RUNX2和成骨细胞特异性转录因子Osterix(Osx)表达的同时,可以抑制其分化为脂肪细胞,具有促成骨和抗成脂活性[7-8],对维持骨量、促进成骨分化和骨代谢至关重要[9]。复方补肾活血颗粒是安徽中医药大学第一附属医院院内制剂,前期研究表明,该方能明显改善OP患者中医临床症状、视觉模拟评分和骨密度[10];体外实验发现,其含药血清具有促进BMSCs 增殖作用[11]。本研究基于Wnt/β-catenin信号通路观察复方补肾活血颗粒含药血清对BMSCs成骨、成脂分化的影响,探讨其发挥作用的可能机制。
1 实验材料
1.1 动物及细胞
SPF 级8 周龄SD 大鼠30 只,雌雄各半,体质量200~250 g,购于安徽医科大学实验中心,动物许可证号SCXK(皖)2017-001。饲养于安徽中医药大学实验动物中心标准动物房,动物实验经安徽中医药大学实验动物伦理委员会审批。骨髓液取自安徽中医药大学第一附属医院骨伤科手术患者(排除近5年内患有糖尿病、严重肾功能不全、甲亢、甲减、血液疾病、恶性肿瘤等进而影响骨代谢者),用于分离培养BMSCs。临床试验经安徽中医药大学第一附属医院医学伦理委员会审批。
1.2 药物及制备
复方补肾活血颗粒(首乌藤25 g,白芍20 g,淫羊藿20 g,黄芪18 g,川牛膝15 g,牡蛎10 g),饮片由安徽中医药大学第一附属医院中药房提供。饮片加8倍量水浸泡1 h,煮沸30 min,过滤,再加6倍量水煎煮30 min,合并煎液,过滤,浓缩至1 mL药液含原药材2.9 g,4 ℃冰箱保存备用。
1.3 试剂与仪器
碱性磷酸酶(ALP)染色试剂盒、青霉素-链霉素溶液、茜素红染色液(上海碧云天生物,货号分别为C3206、C0222、C0140),DMEM 培养基、PBS 缓冲液(美国Hyclone 公司,货号分别为SH30243.01、AC10217621),RUNX2 抗体、Osx 抗体、CCAAT/增强子结合蛋白α(C/EBPα)抗体、PPARγ抗体、低密度脂蛋白受体相关蛋白(LRP)5抗体、β-catenin抗体(英国Abcam公司,货号分别为ab76956、ab209484、ab40764、ab178860、ab223203、ab32572),0.25%胰蛋白酶-EDTA、胎牛血清(美国Invitrogen公司,货号25200056、16000-044),反转录试剂盒(上海新贝生物,货号R202-02),BMSCs成骨、成脂诱导分化试剂盒(南京建成生物,货号分别为HUXMX-90021、HUXMX-90031),CCK-8试剂、RNA提取试剂盒(上海奕杉生物,货号分别为100-106、RN001),油红O染色液(北京索莱宝,货号G1262)。
CO2恒温培养箱(德国Eppendorf 公司,型号C170i),倒置荧光显微镜(日本OLYMPUS公司,型号CX53),全波段酶标仪(上海赛默飞公司,型号SkyHigh),梯度PCR 仪(美国ABI 公司,型号ABI VERITI),荧光定量PCR 仪(美国罗氏公司,型号LightCycler 480Ⅱ),高速冷冻离心机(德国Eppendorf公司,型号5430R),Countstar细胞计数仪(上海睿钰生物,型号IC1000),免疫印迹系统(上海天能公司,型号VE-180)。
2 实验方法
2.1 骨髓间充质干细胞分离、培养及分组
用完全培养基(含10%胎牛血清和1%青霉素-链霉素的DMEM培养基)稀释骨髓液后铺于6孔板中,置于37 ℃、5%CO2细胞培养箱中培养,48 h后更换培养基,继续培养6~8 d,将细胞进行消化传代,作为第1代BMSCs。取第3代BMSCs,以5×104个/mL接种至6孔板中,待细胞完全贴壁后,将细胞分为空白组(完全培养基)和含药血清低、中、高剂量组(低、中、高剂量组,分别为2%、5%、8%含药血清)。
2.2 含药血清制备
大鼠适应性饲养1周后,按随机数字表法分为含药血清组和空白血清组(各15只)。按人与动物体质量折算等效剂量,含药血清组以6倍等效剂量(29 g/kg)灌胃[12],灌胃体积10 mL/kg,空白血清组以等体积生理盐水灌胃,每日1次,连续7 d。末次给药前12 h大鼠禁食不禁水,称重后按60 mg/kg用1%戊巴比妥钠麻醉,腹主动脉取血,室温静置1 h,3 500 r/min 离心20 min,取血清,56 ℃灭活30 min,用0.22 μm微孔滤膜过滤除菌,15 mL离心管分装,于-20 ℃冰箱保存。
2.3 CCK-8法检测细胞活力
收集状态良好的第3~5代BMSCs,制备单细胞悬液,调整细胞密度为1×104个/mL,接种于96孔板,将细胞按“2.1”项下分组,每组3个复孔,24 h后分别更换为不同浓度含药血清继续培养,于培养12、24、36、48 h后每孔加CCK-8溶液10 μL,培养箱培养1 h,酶标仪波长450 nm处测定各孔细胞活力(OD值)。
2.4 碱性磷酸酶染色、茜素红染色
BMSCs以5×104/mL密度接种于6孔板,将细胞按“2.1”项下分组,每组3个复孔,待细胞贴壁后,更换为含相应血清的BMSCs成骨诱导分化培养基继续培养,每隔3 d更换1次培养基,诱导7 d后,PBS洗涤,加入40 g/L多聚甲醛溶液2 mL固定30 min,PBS洗涤,每孔加入ALP溶液1 mL充分反应,显微镜下观察。成骨诱导14 d后,按照上述方法固定和清洗BMSCs,加入1 mL茜素红染色液反应15 min,PBS冲洗,观察钙盐沉积。
2.5 油红O染色
BMSCs以5×104个/mL接种至6孔板中,将细胞按“2.1”项下分组,每组3个复孔,待细胞融合达到80%时,更换为含相应血清的BMSCs成脂诱导分化培养基A液培养3 d,换为含相应血清的成脂诱导分化培养基B液培养1 d,再次更换为培养基A液诱导,如此循环诱导14 d,PBS 轻柔洗涤,加入多聚甲醛溶液固定30 min,PBS冲洗2遍,每孔加入油红O溶液2 mL,室温染色30 min,显微镜下观察染色效果。
2.6 RT-PCR检测
将BMSCs 以5×104个/mL 接种于6 孔板中,按“2.1”项下分组,每组3个复孔,待细胞贴壁后,分别加入相应含药血清培养基2 mL,置于培养箱培养3、5、7 d。按照试剂盒说明书抽提细胞中的RNA,紫外分光光度计测定浓度,根据PCR扩增体系和反应条件进行扩增,利用RUNX2、Osx、C/EBPα、PPARγ引物进行PCR,以GAPDH为内参,2-ΔΔCt法计算各基因相对表达量。引物由上海新贝生物科技有限公司合成,引物序列见表1。

表1 各基因PCR引物序列
2.7 Western blot检测
将BMSCs按“2.6”项下方法处理后,PBS清洗3次,加入RIPA和PMSF混合液200 μL,裂解10 min提取总蛋白,BCA蛋白试剂盒检测蛋白浓度,12%凝胶电泳分离等量蛋白,转移到PVDF膜上,用5%脱脂牛奶封闭2 h,滴加GAPDH一抗(1∶2 000)、RUNX2一抗(1∶300)、Osx一抗(1∶1 000)、C/EBPα一抗(1∶1 000)、PPARγ一抗(1∶1 000)、LRP5一抗(1∶1 000)、β-catenin 一抗(1∶1 000),4 ℃孵育过夜,TBST洗涤3次,孵育相应二抗,利用Image J软件对条带进行分析,并计算目的蛋白相对表达量。
3 统计学方法
采用SPSS22.0统计软件进行分析。计量资料以±s表示,符合正态分布及方差齐性,多组间比较采用方差分析,两组间比较采用t检验;不满足正态分布使用非参数检验。P<0.05表示差异有统计学意义。
4 结果
4.1 骨髓间充质干细胞形态学特征
BMSCs首次换液后呈梭形或多角形分布,7 d左右可长满培养瓶。传至第3代,细胞生长速度加快,为较均一的长梭形,聚集生长,呈有方向性的鱼群状,细胞形态均匀。见图1。

图1 BMSCs形态学特征(×40)
4.2 复方补肾活血颗粒对骨髓间充质干细胞活力的影响
在一定浓度范围内,复方补肾活血颗粒可提高BMSCs细胞活力,其中以中剂量组作用最明显,36 h达到高峰,说明复方补肾活血颗粒提高细胞活力不仅与剂量有关,也与作用时间有关。见图2。
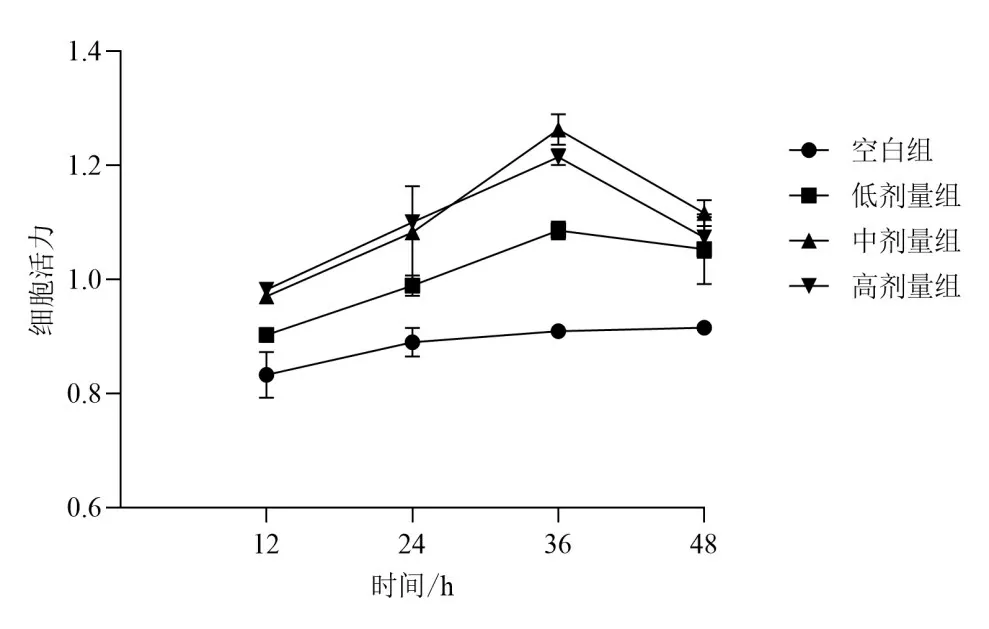
图2 各组BMSCs细胞活力比较(±s,n=3)
4.3 复方补肾活血颗粒对骨髓间充质干细胞成骨分化潜能的影响
成骨诱导分化7 d后,与空白组比较,低、中、高剂量组BMSCs ALP染色加深,其中以高剂量组颜色最深,阳性染色面积最大,显微镜下可见无规则的形态变化,局部有一定的细胞聚集,并有大量钙化结节。见图3。成骨诱导分化14 d 后,与空白组比较,低、中、高剂量组BMSCs染色加深,橘红色沉淀增多,说明矿化结节增加。见图4。

图3 各组BMSCs形态(ALP染色,×40)
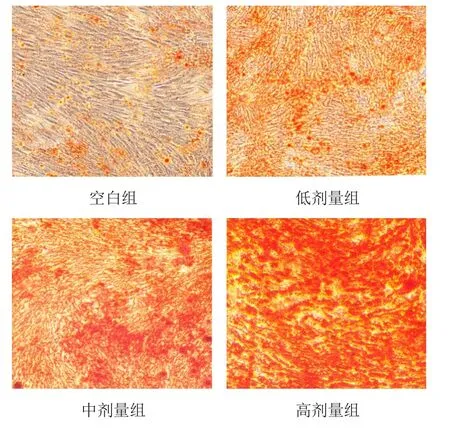
图4 各组BMSCs形态(茜素红染色,×40)
4.4 复方补肾活血颗粒对骨髓间充质干细胞成脂分化潜能的影响
成脂诱导分化14 d后,BMSCs形态呈圆形或不规则形,其油脂可被油红O染为红色。与空白组比较,低、中、高剂量组BMSCs颜色逐渐变浅,表明脂滴数量逐渐减少,其中以高剂量组脂滴减少最为明显。见图5。
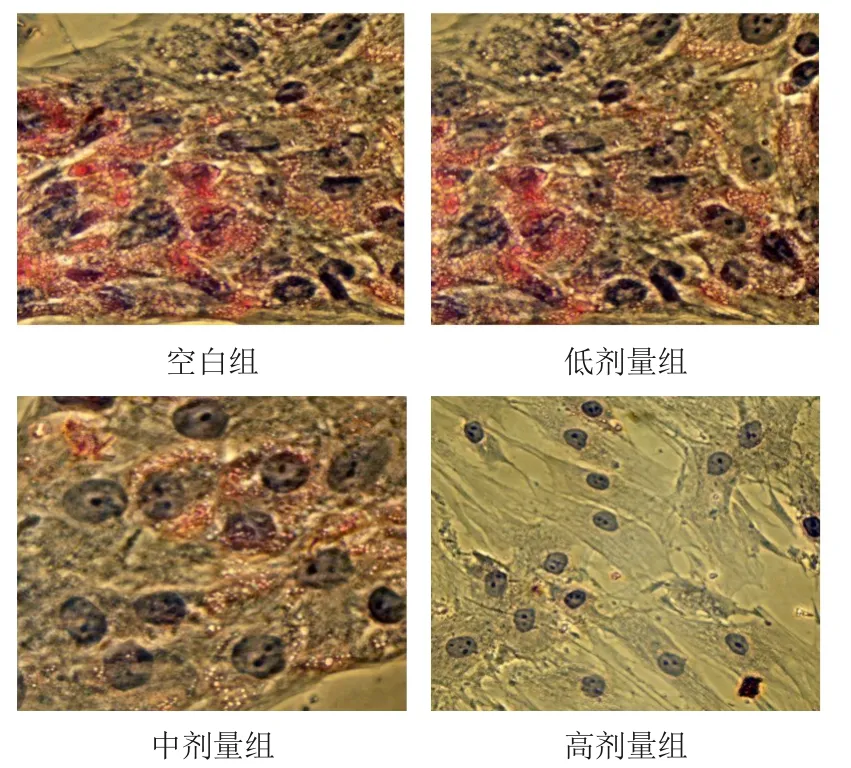
图5 各组BMSCs形态(油红O染色,×40)
4.5 复方补肾活血颗粒对骨髓间充质干细胞成骨、成脂分化相关基因表达的影响
与空白组比较,低、中、高剂量组BMSCs培养3、5、7 d后,成骨相关因子RUNX2和Osx mRNA表达升高,成脂相关因子C/EBPα和PPARγ mRNA表达降低,除3 d低剂量组Osx、RUNX2、PPARγ,3 d中剂量组Osx、RUNX2和5 d低、中剂量组RUNX2外,差异均有统计学意义(P<0.05,P<0.01,P<0.001)。见图6。

图6 各组BMSCs不同时点RUNX2、Osx、C/EBPα、PPARγ mRNA表达比较(±s)
4.6 复方补肾活血颗粒对骨髓间充质干细胞成骨、成脂分化相关蛋白表达的影响
与空白组比较,低、中、高剂量组BMSCs培养3、5、7 d 后RUNX2 和Osx 蛋白表达升高,C/EBPα 和PPARγ蛋白表达降低,其中高剂量组差异均有统计学意义(P<0.05,P<0.01,P<0.001)。见表2、表3、图7。
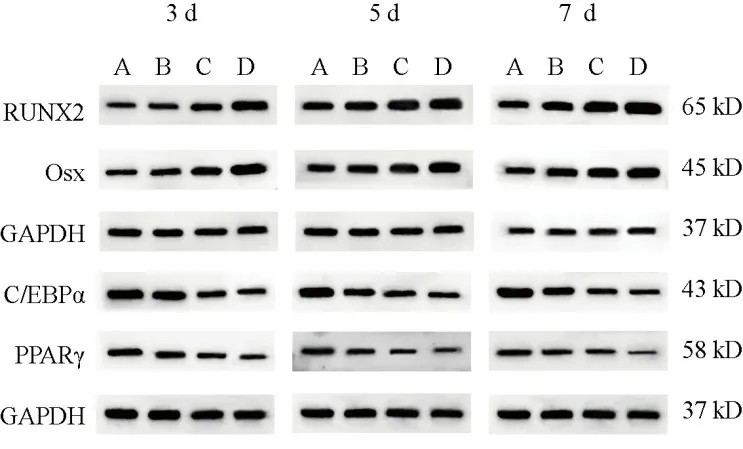
图7 各组BMSCs不同时点RUNX2、Osx、C/EBPα、PPARγ蛋白免疫印迹
表2 各组BMSCs不同时点RUNX2、Osx蛋白表达比较(±s)

表2 各组BMSCs不同时点RUNX2、Osx蛋白表达比较(±s)
注:与空白组同一时点比较,*P<0.05,**P<0.01,***P<0.001
组别空白组低剂量组中剂量组高剂量组n 3 3 3 3 3 d 5 d 7 d Osx 0.84±0.01 0.91±0.01 0.94±0.02 1.30±0.09**RUNX2 0.76±0.02 0.91±0.02 1.28±0.53 1.27±0.05 Osx 0.73±0.03 0.83±0.03**0.84±0.01**1.28±0.05***RUNX2 0.82±0.03 0.90±0.02*0.96±0.02 1.15±0.05**Osx 0.73±0.01 0.84±0.03*1.10±0.05**1.20±0.03**RUNX2 0.68±0.01 0.79±0.05*0.87±0.02*1.21±0.01**
表3 各组BMSCs不同时点C/EBPα、PPARγ蛋白表达比较(±s)
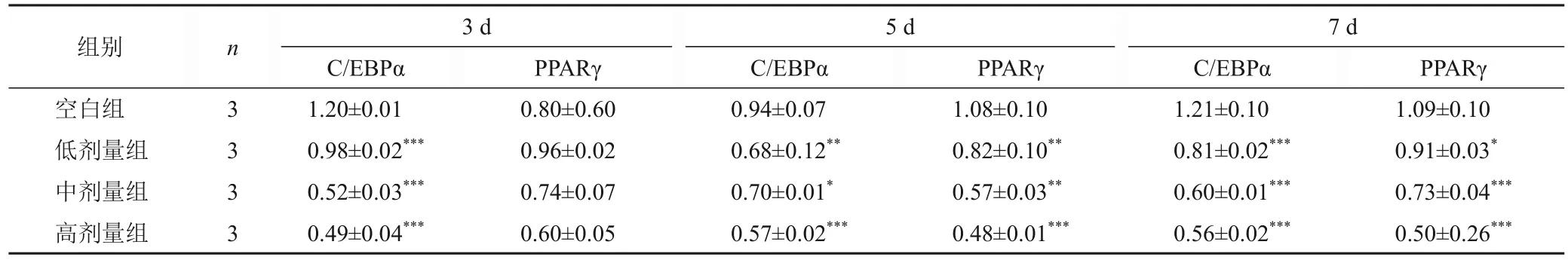
表3 各组BMSCs不同时点C/EBPα、PPARγ蛋白表达比较(±s)
注:与空白组同一时点比较,*P<0.05,**P<0.01,***P<0.001
组别空白组低剂量组中剂量组高剂量组n 3 3 3 3 3 d 5 d 7 d PPARγC/EBPαPPARγC/EBPαPPARγ 1.09±0.10 0.91±0.03*0.73±0.04***0.50±0.26***C/EBPα 1.20±0.01 0.98±0.02***0.52±0.03***0.49±0.04***0.80±0.60 0.96±0.02 0.74±0.07 0.60±0.05 0.94±0.07 0.68±0.12**0.70±0.01*0.57±0.02***1.08±0.10 0.82±0.10**0.57±0.03**0.48±0.01***1.21±0.10 0.81±0.02***0.60±0.01***0.56±0.02***
Western blot 检测培养3、7 d 后LRP5、β-catenin蛋白表达。结果显示,与空白组比较,中、高剂量组LRP5蛋白表达显著升高,各组β-catenin蛋白表达均显著升高(P<0.05,P<0.001),见图8、图9。
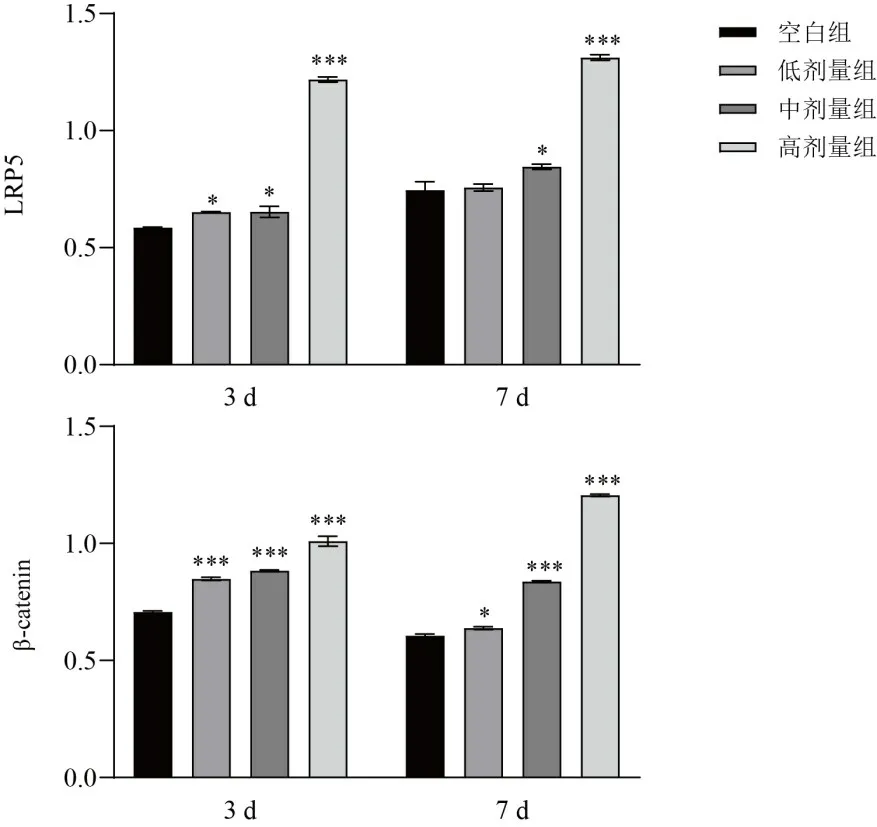
图9 各组BMSCs不同时点LRP5、β-catenin蛋白表达比较(±s)
5 讨论
OP导致的脆性骨折带来的严重并发症具有较高的致残率和病死率,在很大程度上威胁患者的生活质量和身心健康[13]。OP属中医学“骨痿”“骨枯”范畴,肾主骨、生髓,骨之强健,非骨髓之滋养不可,即“肾充则髓实”。肾的精气盛衰对骨代谢的影响极为重要,肾虚精亏为OP核心病机[14]。多项临床及实验研究显示,中药复方在治疗OP方面具有显著优势[15-16]。复方补肾活血颗粒中淫羊藿、川牛膝入肾经,具有补肾精、固筋骨作用;黄芪、牡蛎、首乌藤归肝、肾经,可补诸虚不足,具有补虚、益气、通脉功效;白芍缓急止痛。BMSCs在OP发展过程中扮演重要角色,正常状态下,成骨-成脂分化处于动态平衡状态,当代谢平衡被打破后,会造成骨代谢紊乱,进而引发OP等骨代谢疾病[17-18]。研究发现,大部分OP 患者表现为BMSCs成骨分化能力减弱、成脂分化能力增强[19-20]。促进BMSCs向成骨细胞转化,降低成脂细胞比例,对于改善骨-脂代谢,延缓OP进程具有重大意义。本研究以复方补肾活血颗粒含药血清干预体外培养的BMSCs,观察其对BMSCs增殖及成骨、成脂分化的影响,明确复方补肾活血颗粒发挥作用的机制。
ALP作为早期成骨标志物,通过水解各种类型的磷酸盐促进细胞成熟,在成骨分化过程中能够促进细胞钙化;茜素红染色对成骨分化晚期钙结节的数量具有指示作用。二者均能直接反映成骨分化程度[21]。本实验结果显示,复方补肾活血颗粒含药血清能明显促进BMSCs钙化,形成钙结节。油红O染色结果表明,复方补肾活血颗粒含药血清能显著降低BMSCs脂质沉积,抑制BMSCs成脂分化能力。促进BMSCs向成骨细胞或成脂细胞分化的关键因素是提高与特异性细胞类型有关的基因表达,启动和促进特异性细胞类型的分化[22]。RUNX2在BMSCs转化为成骨细胞的过程中起关键作用,可促进BMSCs成骨分化,抑制BMSCs成脂分化,RUNX2缺失导致BMSCs无法分化为成骨细胞[23]。Osx 是BMSCs 成骨分化的另一重要转录因子,在RUNX2下游起作用,且可被RUNX2激活[24]。PPARγ不仅在脂肪细胞分化中起重要作用,而且对成骨相关因子RUNX2有负向调节作用,对骨形成有一定抑制作用[25]。C/EBPα作为PPARγ下游,其激活后能协同PPARγ发挥作用,调控多种成脂蛋白[26]。在成脂过程中,PPARγ和C/EBPα表达升高。通过在BMSCs分化的不同时点验证复方补肾活血颗粒含药血清的作用,发现复方补肾活血颗粒含药血清能促进BMSCs分化不同阶段的RUNX2和Osx表达。此外,干预后成脂分化关键因子PPARγ和C/EBPα表达降低,进一步表明复方补肾活血颗粒含药血清促进成骨分化、抑制成脂分化的药效作用。
Wnt通路激活后,Wnt配体与LRP5/6受体结合,导致GSK-3β活性被抑制,进一步激活β-catenin,活化的β-catenin进入细胞核与核转录因子结合,形成复合体,刺激下游相关基因表达。研究表明,Wnt/β-catenin信号通路激活后促进BMSCs成骨分化,抑制成脂分化[27],其关键分子β-catenin缺失会导致BMSCs成骨分化能力减弱,从而导致OP发生[28-29]。因此,通过检测Wnt/β-catenin信号通路关键蛋白LRP5和β-catenin表达,发现复方补肾活血颗粒含药血清可显著上调LRP5和β-catenin蛋白表达,提示复方补肾活血颗粒可能通过激活Wnt/β-catenin信号通路促进BMSCs成骨分化。但考虑到中药复方药材的多样性及化学成分的复杂性,其干预疾病的途径及靶点并非单一,因此本研究结果仍需进一步探讨。

