基于OpenFDA数据库挖掘与评价巴瑞替尼上市后的不良反应
孙璇,张科,袁恒杰,李正翔
作者单位: 300052 天津市,天津医科大学总医院药剂科
类风湿性关节炎(RA)是一种常见的慢性炎症性全身自身免疫性疾病。目前病因未知,可发生于任何年龄阶段[1-3]。患者主要表现为持续关节疼痛、肿胀及僵硬等关节炎症,同时严重患者的心脏、肺、骨骼等器官均会受累,最终引起关节畸形和多种并发症,严重影响患者的身心健康和生活质量[4-5]。我国流行病学调查显示,类风湿性关节炎的患病率为0.28%,总体患病人群约500万,男女患病比率约为1∶4[6-7]。类风湿性关节炎患者需接受长期的抗炎治疗以减轻关节炎性反应,减缓病变发展和骨质的不可逆破坏,最大限度地保护关节和肌肉的功能,最终达到缓解病情的目的[8]。主要治疗药物包括非甾体类抗炎药、慢作用抗风湿药、免疫抑制剂、免疫和生物制剂及植物药等[9]。
巴瑞替尼是Janus相关激酶(JAK)抑制剂,作用于Janus相关激酶,调节细胞内磷酸化和活化信号传感器及转录激活子的活性,影响细胞的造血过程和免疫细胞功能,发挥治疗类风湿性关节炎的作用[10]。巴瑞替尼分别于2017年2月13日和2017年7月3日在欧盟和日本上市。而由于安全性事件影响,礼来制药公司补充了额外的药物安全性和有效性数据,并重新更新了使用剂量为2 mg后,2018年5月31日巴瑞替尼经美国食品药品监督管理局(FDA)批准在美国上市。2019年7月1日经中国食品药品监督管理局(CFDA)正式批准在我国上市,适应证为对一种或多种改善病情抗风湿药(DMARDs)疗效不佳或不耐受的中重度活动性RA成年患者,可与甲氨蝶呤或其他非生物改善病情抗风湿药联用[11]。由于巴瑞替尼在我国上市时间较晚,其相关的药品不良反应(ADR)等安全性研究数据及相关研究较少,因此,对巴瑞替尼ADR进行挖掘和分析有较重要的意义。FDA公共数据公开项目(OpenFDA)是FDA于2014年6月2日开发的一项面向公众的在线公共数据公开服务项目,该项目数据来源于FAERS数据库,累及收录约1 200万份ADR报告[12]。目前常用的ADR监测技术是采用特定的信号挖掘方法对FAERS数据库中目标药品的ADR数据进行挖掘及分析,既可对已知ADR进行信号强度评价、排序,又可发现新的潜在ADR,为药物临床安全使用提供依据[13]。本研究基于OpenFDA数据库,采用报告比值比(ROR)法对巴瑞替尼ADR进行信号挖掘和分析,为该药的安全使用提供依据。
1 资料与方法
1.1 数据来源与研究方法 打开OpenFDA在线数据库(https://open.fda.gov/),在APIs接口中选择Drug APIS Endpoints;点击Adverse Events,选择Explore the API with an interative chart模块。本研究以“巴瑞替尼”为目标药品,限定检索词为“baricitinib”,在Custom search parameter检索框里输入baricitinib。因巴瑞替尼在欧盟首次上市时间为2017年2月13日,故检索时间范围选择2017年2月13日—2021年12月31日。然后根据研究的不同数据需求,在View选择框中根据患者性别、年龄、呈报国家、呈报人群、严重性等不同的字段后回车检索并获得ADR事件的相关数据。同时,采用 《国际医学用语词典》中ADR术语集的首选系统器官分类(SOC)和首选术语(PT)进行相应的检索。
1.2 ADR信号检测 获得ADR数据后,对数据进行一定的处理后,采用比例失衡法中的ROR法对ADR进行信号检测。ROR是比值失衡法中一种灵敏度较高,且能消除较多偏倚的常用的ADR信号挖掘方法,使用四格表法进行计算获得ROR值,值的大小表示目标药物与ADR之间的关联性强弱[14]。当ADR报告例数≥3,且ROR的95%CI下限>1时,即生成一个可疑ADR信号[12]。
2 结 果
2.1 ADR报告构成情况 检索结果显示,2017年2月13日—2021年12月31日FDA共收到ADR事件报告6 619 958例,其中巴瑞替尼ADR报告3 265例,占全部ADR的0.05%,年度分布见图1。2017年上市第1年的ADR报告仅8例,而次年为317例,于2019年达到峰值,为1 091例。ADR主要呈报国家分布:美国1 480例占45.33%,日本377例占11.55%,德国302例占9.25%,法国206例占6.31%,英国160例占4.90%,这5个国家合计占比为77.34%。ADR报告年龄分布:涉及患者年龄的ADR报告2 391例,少于总的ADR报告数量,分析原因可能是ADR报告中遗漏患者的年龄信息。ADR的年龄分布以30岁以上人群为主,共2 324例占97.20%,其中30~65岁1 335例占55.83%,>65岁989例占41.36%;<30岁67例占2.80%。严重ADR(包括死亡、危及生命、住院、致残、先天畸形及其他严重事件)2 253例,约占总数的69.00%。

图1 巴瑞替尼ADR年度报告分布图
2.2 ADR信号及其强度 根据筛选条件,检测出ADR报告>3且ROR的95%CI下限>1的ADR风险信号40个,涉及ADR报告1 621例次。40个风险信号强度中涉及7个系统器官,包括感染及侵染类疾病、血液和淋巴系统疾病、全身性疾病及给药部位的各种反应、肝胆系统疾病、呼吸系统疾病、心脏疾病、代谢和营养类疾病,但在各系统器官中总体信号存在差异,见表1。由表可知,40个风险信号涉及的ADR大部分与说明书一致。C反应蛋白升高、血氧饱和度下降、败血症、呼吸衰竭等4个信号说明书均未收录,但这4个ADR可能与巴瑞替尼引起的感染不良反应相关,同样需要在临床使用过程中引起重视。PT结果见表2。
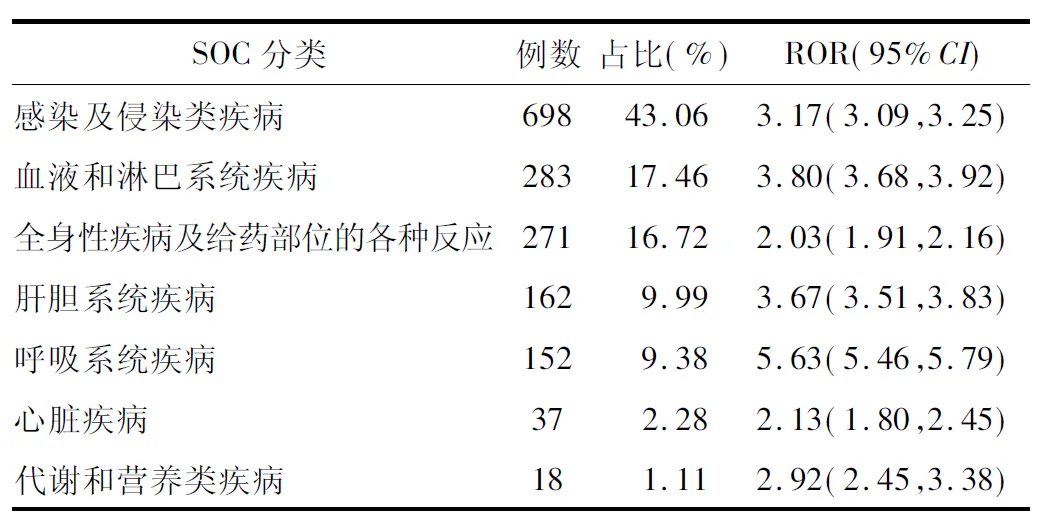
表1 各SOC分类中巴瑞替尼的总体ADR信号强度
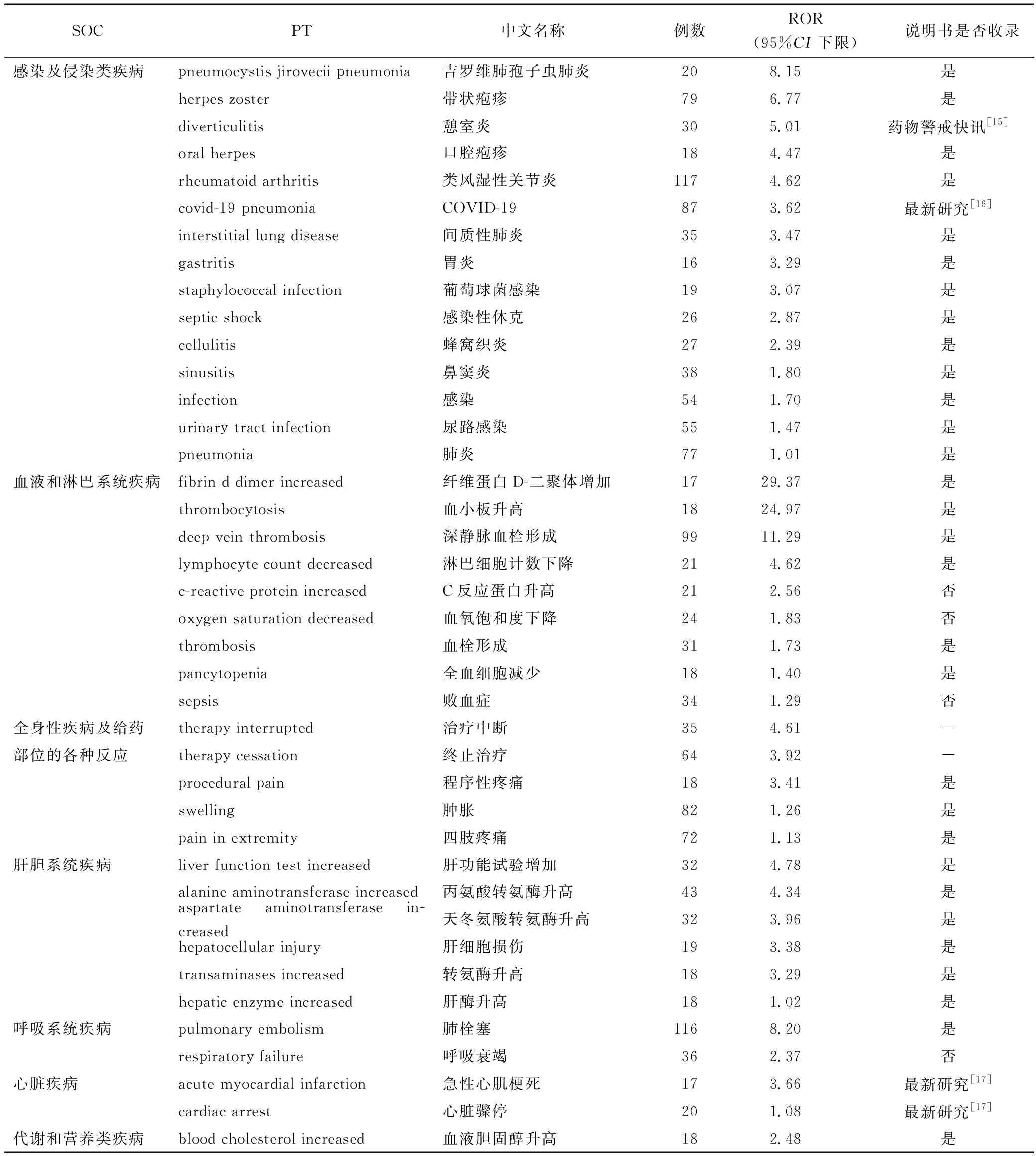
表2 各SOC分类中巴瑞替尼的具体的ADR信号检测结果
3 讨 论
3.1 ADR报告构成情况分析 在医疗过程中,对上市药品持续的不良反应监测和报告药物相关的疑似不良反应,有助于及时了解ADR发生的表现、程度,客观评估药品的安全性,并在临床决策中寻求获益与风险的平衡。同时,ADR监测还可为遴选、整顿、淘汰药品提供依据,有利于发现重大药害事件,防止不良事件的发生[16]。根据巴瑞替尼不良事件报告的年度分布分析,由于2017年2月13日和2017年7月3日巴瑞替尼先后在欧盟和日本上市,而美国上市时间推迟在2018年5月31日。因此上市第1年ADR仅8例,而2018年迅速增加,到2019年达到峰值,然后2020年略有下降。分析可能由于临床人员对药物使用过程中的不良反应的认识增多,加强了药物使用的监护和采取相应预防措施,以及由于新冠疫情影响,部分患者未能及时就医有关。而2021年ADR报告数量又恢复到1 000多例,推测主要是因为2020年11月19日美国FDA于紧急批准(紧急使用授权,EUA)礼来公司(Eli Lilly and Company)的巴瑞替尼与吉列德公司的瑞德西韦联用治疗重症新冠肺炎(COVID-19),适用于疑似或确诊的已入院治疗且需吸氧,上呼吸机或使用ECMO的成人及儿童(年龄为2岁及以上)COVID-19患者的治疗[18]。ADR来源国家数据显示,ADR主要来自欧美、日本等发达国家,而在其他发展中国家的报告非常少,主要原因一是与不同国家上市时间差异有关,二是与药品专利的可及性和药品的价格原因,这类价格昂贵的新药在一些发展中国家应用有限有关。ADR报告主要发生年龄在30岁以上人群为主,虽类风湿性关节炎可发生于任何年龄阶段,但以青壮年为主。报告中死亡、危及生命、住院、致残、先天畸形等严重ADR约占总数的69.00%,提示临床使用中相关人员应密切关注使用该药物的患者,警惕严重ADR的发生。
3.2 筛选出的ADR信号分析 综合ADR的报告例数及ADR信号强度,本研究发现巴瑞替尼的ADR主要集中在感染及侵染类疾病、血液和淋巴系统疾病、全身性疾病及给药部位的各种反应、肝胆系统疾病、呼吸系统疾病、心脏疾病、代谢和营养类疾病。通过与药品说明书对比可知,本研究挖掘得到的ADR信号结果与药品说明书收录的非常吻合。风险信号异常强烈的有纤维蛋白D-二聚体增加、血小板升高、深静脉血栓形成、肺栓塞等,这些不良反应在药品说明书中有警示区明确告知。C反应蛋白升高、血氧饱和度下降、败血症、呼吸衰竭这4个信号虽在说明书中未提及,但这些不良反应均与巴瑞替尼常见的感染性不良反应相关,为感染疾病的一些具体表现。巴瑞替尼药品说明书中警告栏中明确提示,接受该药治疗的患者有发生严重感染的风险,可能导致住院或死亡。因此使用巴瑞替尼治疗期间和治疗后的患者,应密切监测患者的感染体征或症状,包括在治疗开始前,潜伏性结核感染检测为阴性的患者中可能出现的结核。如果发生严重感染,必要时药物应减量或停用,直至感染得到控制。巴瑞替尼引起的急性心肌梗死、心脏骤停及憩室炎等ADR,虽在说明书中未提及,但在药物警戒快讯和FDA安全通报中均明确告知,巴瑞替尼可能会引起上述不良反应的发生。
3.3 本研究的不足 (1)OpenFDA目标数据库为自发呈报数据库,由于上报者既有专业医务人员,也有其他非专业人员,因而数据质量难以保证,因此不良反应挖掘得到的结果可能出现一定的偏倚;(2)本研究通过OpenFDA提供的接口获取的数据,不是ADR原始信息,因此挖掘得到的结果不能排除患者基础疾病、治疗过程及联用药物等因素的影响,也存在偏倚;(3)数据库中的ADR报告主要来自于美国、日本、欧盟等国家,中国的不良反应数据很少,得到的结果是否适用于中国人群有待研究和确定;(4)通过比例失衡法中ROR获得的ADR风险信号表示研究药物与ADR在统计学上存在联系,二者是否存在必然因果关系需大规模的临床研究进行验证。
综上所述,基于OpenFDA对上市药品不良反应数据进行挖掘与分析,可发现一些说明书未提及的风险信号,为临床安全用药提供安全保障。临床应用巴瑞替尼时,除药品说明书中已提到的不良反应外,还需密切关注其C反应蛋白升高、血氧饱和度下降、败血症及呼吸衰竭等风险,避免因此类不良反应带来的损害。
利益冲突:所有作者声明无利益冲突。

