小头鲔幼鱼不同消化器官中消化酶活性分析
王文雯,胡静,3,周胜杰,3,杨蕊,3,马振华,3,通信作者
(1. 中国水产科学研究院 南海水产研究所 热带水产研究开发中心,海南 三亚 572018;2. 三亚热带水产研究院 海南 三亚 572018;3. 海南省深远海渔业资源高效利用与加工重点实验室,海南 三亚 572018)
消化酶是消化器官中具有催化食物分解的一类酶,有着酶的所有特性,在消化酶催化作用下,多糖转变为单糖,脂肪转变为甘油和脂肪酸,蛋白质转化为氨基酸,从而获得物质和能量,对鱼类的营养消化和生长发育具有极其重要的作用[1]。消化酶活性的大小直接影响鱼类对饲料中营养物质的消化利用程度,温度则是影响鱼类生长和生理的重要环境因子。养殖水温将直接影响鱼类消化酶活性,进而影响鱼体对饲料的消化吸收。近年来,温度对各种食性鱼类消化酶活性的影响已有不少研究报道[2-5],说明了不同食性鱼类的消化道中各消化酶的分布和活性均有较大的差异。根据消化对象的不同,可以将消化酶分为脂肪酶、淀粉酶、蛋白酶等。
小头鲔(Euthynnus affinis), 属鲭科(Scombridae)、鲔属、硬骨鱼纲(Osteichthyes),身材呈纺锤型,较粗壮,尾柄细,平扁,在澳大利亚称为“东方蓝鳍金枪鱼”[1]。主要在近海中上层水域活动,分布于北半球的太平洋和大西洋海域,在中国南海、日本、越南、印度、澳大利亚等地均有捕捞。海南近海捕捞的小头鲔全长范围为23~46 cm,平均全长为33 cm,是南海近海渔业捕捞重要经济鱼类。目前,国内相关小头鲔幼鱼的研究主要集中在渔业信息及基础生物学上[6],其养殖生物学报道较少[7-8]。
本研究在小头鲔幼鱼不同消化器官产生不同消化酶的基础上,进一步探究不同消化酶在不同消化器官中酶活性的比较,以便为后续开展小头鲔人工养殖提供参考并奠定基础。
1 材料与方法
1.1 试验材料
试验所用小头鲔幼鱼是从中国水产科学研究院南海水产研究所热带水产研究开发中心陵水试验基地循环水养殖系统中获取。小头鲔幼鱼的养殖环境条件为气温(32.45±2.53)℃、水温(32.68±0.67)℃、溶解氧(7.61±0.07)mg/L。试验用的小头鲔幼鱼平均体重为(1163.13±284.60)g、平均体长为(32.38±4.71)cm。
1.2 样品采集和处理
取样前停食24 h,采用丁香酚进行麻醉致死,称重后置于带有碎冰的解剖盘内解剖,取出肝脏、胰脏,剖开肠、胃,将肠等分为前肠、中肠、后肠3 段后取适量的全鱼组织,分别放于天平上称重,随后将称重后的组织置于离心管中。以1∶9的比例用手持匀浆机在冰上匀浆。离心机于4 ℃,在3 500 xg 下离心10 min,收集上清液并放置于-80 ℃,用于酶活性分析。
本试验所有指标均使用商业试剂盒(中国南京建成生物工程研究所)测定,包括消化酶:脂肪酶、淀粉酶、蛋白酶。
1.3 酶活性测定
脂肪酶活性测定:脂肪酶采用甘油三酯乳化液水解法测定。酶活力单位定义为:在37 ℃条件下,每克组织蛋白与底物作用1 min,每消耗1 µmol底物定义为一个脂肪酶活力单位。
淀粉酶活性的测定:利用淀粉酶能水解淀粉,在底物浓度已知并且过量的情况下,加入碘液与未水解的淀粉结合生成蓝色复合物,根据蓝色的深浅可推算出水解的淀粉量,从而计算出淀粉酶的活力。酶活力单位定义为:在37 ℃条件下与底物作用30 min,水解10 mg 淀粉酶定义为一个淀粉酶活力单位。
蛋白酶测定:采用福林酚法测定蛋白酶活力。酶活力单位定义为:每毫克组织蛋白37 ℃·min分解蛋白生成1 µg 酪氨酸定义为1 个蛋白酶活力单位。
1.4 统计分析
采用SPSS 26.0 统计软件对结果进行分析。所有数据均用平均值±标准差(X±SD)表示。组间比较采用单因素方差分析和LSD 检验,P<0.05认为差异具有显著性[9-10]。
2 结果与分析
2.1 小头鲔幼鱼不同消化器官脂肪酶活性比较
试验结果如图1 所示,小头鲔幼鱼胃中的脂肪酶在所有消化器官中活性最低,且与肝脏中的脂肪酶活性呈显著性差异(P<0.05),但与前肠、中肠、后肠中的脂肪酶活性不具有显著性差异(P>0.05);肝脏中的脂肪酶是消化器官中酶活性最高、最为显著的,与胃中脂肪酶活性具有显著差异(P<0.05),与前肠、中肠、后肠中的脂肪酶活性不具有显著性差异(P>0.05);前肠、中肠和后肠中的脂肪酶活性3 组差异较小,所以不具有显著性差异,并且与胃、肝脏中的脂肪酶活性也不具有显著性差异(P>0.05)。脂肪酶在适宜温度下酶活性为:肝脏>前肠>中肠>后肠>胃,大菱鲆(Psetta maxima)[11]为肉食性鱼类,脂肪酶活性前肠>中肠>后肠,与小头鲔脂肪酶结果相似。

图1 小头鲔幼鱼不同消化器官脂肪酶活性比较
2.2 小头鲔幼鱼不同消化器官淀粉酶活性比较
试验结果如图2 所示,小头鲔幼鱼胃中的淀粉酶活性显著低于肝脏、胰脏和中肠中的淀粉酶活性,与肝脏、胰脏、中肠中的淀粉酶活性呈显著性差异(P<0.05);肝脏中淀粉酶活性显著低于胰脏中的淀粉酶活性,且显著高于胃、前肠、中肠和后肠中的淀粉酶活性,与各组间均存在显著性差异(P<0.05);胰脏淀粉酶活性显著高于胃、肝脏、前肠、中肠和后肠淀粉酶活性,与各组间存在显著性差异(P<0.05);前肠中淀粉酶活性与胃、肝脏、胰脏和后肠的淀粉酶活性呈显著性差异(P<0.05),与中肠淀粉酶活性不具有显著性差异(P>0.05);中肠淀粉酶活性与肝脏、胰脏和后肠淀粉酶活性呈显著性差异(P<0.05),与胃和后肠淀粉酶活性无显著性差异(P>0.05);后肠中的淀粉酶活性显著低于肝脏、胰脏和前肠中的淀粉酶活性,呈显著性差异(P<0.05),与胃和中肠中淀粉酶活性无显著性差异(P>0.05)。淀粉酶活性胰脏>肝脏>前肠>中肠>后肠>胃。
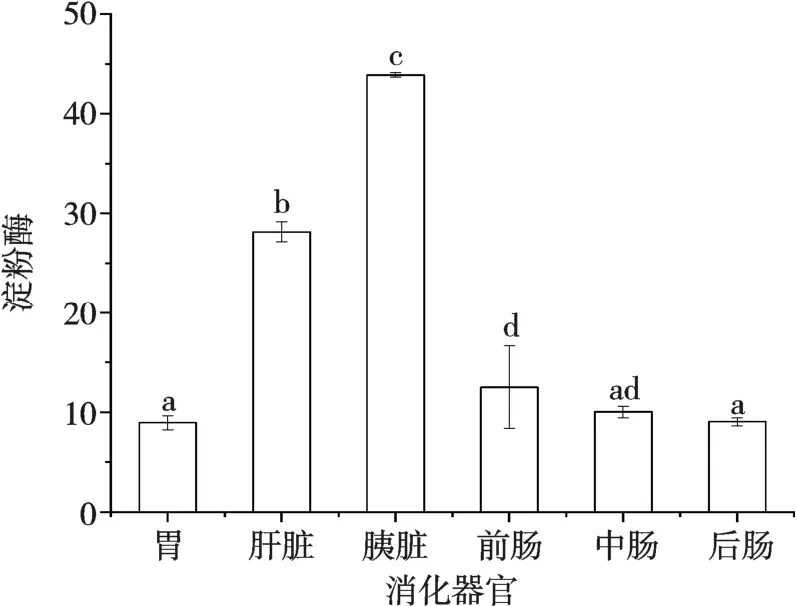
图2 小头鲔幼鱼不同消化器官淀粉酶活性比较
2.3 小头鲔幼鱼不同消化器官蛋白酶活性比较
试验结果如图3 所示,胃、肝脏和前肠中的蛋白酶活性在所有消化器官中酶活性较低,且显著低于胰脏、中肠和后肠中的蛋白酶活性,并具有显著性差异(P<0.05),但胃、肝脏和前肠中的蛋白酶活性不具有显著性差异(P>0.05);胰脏中的蛋白酶活性显著高于其余消化器官中的酶活性,并且与其他消化器官的蛋白酶活性均呈现显著性差异(P<0.05);后肠中的蛋白酶活性显著低于胰脏中的蛋白酶活性且显著高于其余消化器官中的蛋白酶活性,与所有消化器官中的蛋白酶活性均呈现显著性差异(P<0.05);后肠中的蛋白酶活性显著低于胰脏和中肠的蛋白酶活性但显著高于胃、肝脏和前肠中的蛋白酶活性,与胃、肝脏、前肠、中肠和后肠中蛋白酶活性均呈现显著性差异(P<0.05)。小头鲔幼鱼蛋白酶活性大小为:胰脏>中肠>后肠>肝脏>胃>前肠。
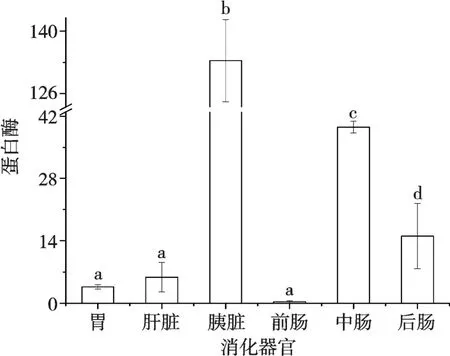
图3 小头鲔幼鱼不同消化器官蛋白酶活性的比较
3 讨论
3.1 小头鲔幼鱼不同消化器官脂肪酶活性分析
脂肪是鱼类生长繁育所必需的元素之一,但对于鱼类脂肪酶活性的测定方法目前还不够完善。鱼体内脂肪主要通过脂肪酶的催化生成各种脂肪酸、甘油三酯等,一些鲤科鱼类的肠道脂肪酶活性是由前肠至后肠酶活性逐渐减小[11],表明鱼类肠道存在脂肪酶。吴婷婷等研究发现,鳜(Siniperca chuatsi)、青鱼(Mylopharyngodon piceus)、鲤(Cyprinus carpio)、 鲢(Hypophthalmichthys molitrix)、草鱼(Anguilla japonica)和鲫鱼(Carassius auratus)等几种不同鱼类不同组织中的脂肪酶活性因鱼种类不同,酶活性也存在差异[12]。鳜、青鱼、鲤、鲢肝脏中脂肪酶活性显著低于其余消化器官中的脂肪酶活性(P<0.05),而草鱼和鲫鱼肝脏中的脂肪酶活性与其余消化器官中的脂肪酶活性不具有差异性(P>0.05)[11]。由此说明,鱼类属性不同,消化器官所分泌的脂肪酶活性也存在不同,一些鱼类中,脂肪酶主要由肠道、肝脏或者胰脏所分泌,而还有一些鱼类的脂肪酶是由肝脏、胰脏和肠道共同分泌的。目前有研究表明,不同鱼类各消化器官脂肪酶活性不同,这和鱼类的食性也有着密切的关系[13-14]。鱼类的食性一般分为肉食性、杂食性和草食性。消化器官不同,所承担的消化机能不同。研究表明,草鱼的食性与消化能力和肠道结构是相适应的,草鱼是无胃鱼类,从组织学上观察未发现胃腺,其食道与肠道直接相通,肠代替了胃的消化作用[15]。蓝鳍金枪鱼属肉食性,脂肪酶的活性也会与杂草性和草食性鱼类存在明显的差异[16]。有研究报道黄鳍金枪鱼和大菱鲆(Psetta maxima)为肉食性鱼类,其淀粉酶和脂肪酶活性在肠道中较大[14,17-18]。本试验研究的小头鲔幼鱼为肉食性且有胃鱼类。结果表明,小头鲔幼鱼脂肪酶活性在肝脏中最高,肠道中的脂肪酶活性较高,与吴婷婷等[12]的研究结果有所差异。
3.2 小头鲔幼鱼不同消化器官淀粉酶活性分析
在鱼类的生长阶段,不同生长环境和食物组成条件下的消化酶活性也存在差别,说明消化酶活性与鱼类的食性有着密切的关系。鱼类淀粉酶活性的研究是鱼类消化生理的重要内容,直接影响鱼类的增长率和增重率[19-20]。淀粉酶活性的最适温度一般在30~45 ℃之间,温度过高,酶活性会下降[21]。在本试验中,小头鲔幼鱼淀粉酶是在37 ℃水浴下完成。
有学者认为,在鱼类的胃中可以测定出淀粉酶的活性,但相对于肝脏、肠道中的淀粉酶活性相对较少[22]。有关海水和淡水鱼类肝脏淀粉酶活性以及鱼类肠道淀粉酶活性的研究较多,鱼类肝脏、胰脏等,是淀粉酶生成的主要消化器官,影响食物中淀粉的消化,也认为鱼类肠道淀粉酶活性比较明显。但淀粉酶的活性会随着鱼类消化器官不同而存在差异[12],一般草食性鱼类的消化道长,比肉食性鱼类淀粉酶活力强,小头鲔属于典型的肉食性鱼类。研究表明,尼罗罗非鱼(Tilapia nilotica)[23-24]、鳜[25]的淀粉酶主要是由散布于肝脏内的胰脏组织产生的,在肠道中被进一步激活[26]。而胰脏的出口位于肠,有些鱼类的肠道可以产生淀粉酶。吴婷婷等[12]也发现不同消化器官之间淀粉酶存在差异。鳜的肝脏、胃和肠道中均有较高的淀粉酶活性;而草鱼和鲤的肝脏中淀粉酶活性高于肠道的淀粉酶活性,且差异不显著(P>0.05)[12],鳜消化组织中的淀粉酶活性高于草食性鱼类。鱼类淀粉酶与鱼的年龄有关,并且会随着不同消化器官或同一消化器官的不同部位而有所差异。由本试验结果可见,小头鲔幼鱼消化器官淀粉酶活性最高的是胰脏,其次是肝脏,且肝脏、胰脏的淀粉酶活性显著高于肠道的淀粉酶活性,说明小头鲔幼鱼的淀粉分泌主要在肝脏和胰脏内进行,与尼罗罗非鱼和鳜的研究结果存在相似性,与吴婷婷等[12]的研究结果存在差异。
3.3 小头鲔幼鱼不同消化器官蛋白酶活性分析
在自然环境中的鱼类,环境温度的改变不仅影响消化酶活性[27-28],而且还可能影响消化酶的分泌量,从而对消化率产生影响。水温对鱼类的消化有多种影响,肠道的蠕动和由此引起的空胃率都取决于温度[29]。鱼类催化蛋白质水解的酶类种类很多,重要的有胃蛋白酶、肝脏蛋白酶、胰脏蛋白酶、肠道蛋白酶等。胃肠消化酶活性是水产动物消化生理的一项重要指标。鱼体消化器官不同,蛋白酶的活性也会存在不同,蛋白酶活性也是与食性有一定的关系,一般肉食性鱼类的消化道短,蛋白酶活力比草食性鱼类蛋白酶活力强。蛋白酶活力:肉食性鱼类>杂食性鱼类>草食性鱼类。还有研究也发现鱼类的蛋白酶活性与食性相关[30]。但就算是相同食性的鱼类,消化酶活性大小也会存在差异。就有胃的鱼类而言,几乎所有鱼类都可以分泌胃蛋白酶,它是由鱼体的胃腺分泌的。胰脏内的蛋白酶是蛋白酶中的一种,属于丝氨酸蛋白酶家族,广泛存在于鱼类的肝脏、胰脏、肠道等具有肽链内切酶活性,对由碱性氨基酸的羧基与其他氨基酸的氨基所形成的键具有高度的专一性,在蛋白消化中发挥着关键作用[31],且对鱼类食物蛋白质的消化具有重要的生理影响。有研究学者[32]认为,硬骨鱼的胰脏是分泌蛋白酶的主要器官。研究表明,鳜的胃、肝脏和肠道均可检测出蛋白酶[25]。在本试验中,胃、肝脏、胰脏、肠道均可检测出蛋白酶。鲢、鳙(Aristichthys nobilis)的肝脏和胰脏蛋白酶活性显著高于其他组织器官[33]。罗非鱼[34]、鲭(Pneumatophorus japonicus)等鱼体的肝脏和胰脏蛋白酶活性显著高于其他消化组织(P<0.05)。本试验结果表明,小头鲔幼鱼分泌蛋白酶的主要器官为胰脏,在消化器官中,胰脏中的蛋白酶活性最高,说明小头鲔幼鱼蛋白酶主要在胰脏中代谢,与罗非鱼和鲭的研究结果一致。
4 结论
本试验分析了小头鲔幼鱼不同消化器官的消化酶,得出结论:小头鲔幼鱼不同消化器官胃、肝脏、胰脏、前肠、中肠、后肠中均可检测出脂肪酶、淀粉酶和蛋白酶。肝脏对饲料中脂肪的消化起到了主要作用,胰脏主要分泌淀粉酶,且对饲料中的蛋白质起到了主要消化作用。综上所述,不同消化器官的组织结构不同,所承担的机能不同,其消化酶活性也会有所不同。

