基于网络药理学探讨复方鲜石斛颗粒防治酒精性肝病的作用机制及实验验证
赵勉,邱雨轩,胡杨,刘子涵,王培丽,陈伟伟,潘安,程建明
(1.南京中医药大学江苏省经典名方工程研究中心,江苏 南京 210023;2.南京中医药大学药学院,江苏 南京 210023;3.南京中医药大学附属医院,江苏 南京 210029)
酒精性肝病(Alcoholic liver disease,ALD)是由于长期过量饮酒导致的一种慢性肝病。酒精的长期过度摄入会干扰肝脏正常的脂质代谢,它所涉及的范围从一开始单纯的脂肪变性发展成为脂肪性肝炎,逐渐向更严重的酒精性肝炎、肝纤维化、肝硬化,甚至肝癌所演变[1-2]。2016年世界卫生组织发布报告称有300多万人因有害使用酒精而死亡,占死亡总数的二十分之一,其中约有280万病例与饮酒密切相关,这也使它成为仅次于病毒性肝病的第二大肝脏疾病[3]。临床上治疗酒精性肝病主要分为两方面:一方面是要靠患者戒酒;另一方面则需采用药物进行辅助治疗,如美他多辛、糖皮质激素和PPAR-α受体激动剂等,但这些药物并不适合长期服用,且临床干预的效果有限[4]。我国“药食同源”文化源远流长,在长期的实践中积累了丰富的理论和经验方,药食同源中药在强身健体、养生保健和抗衰益寿等方面具有独到之处[5]。采用药食两用物质治疗ALD,不仅避免了药物对人体的伤害和不良反应,还能够预防疾病的发生和发展。同时药食两用物质的安全性很高,患者的依从性较强,很多含有药食同源物质的中药复方在对ALD的防治上有显著的疗效,目前已成为ALD治疗的新方向[6]。
石斛(Dendrobiicaulis)作为我国“九大仙草”之首,是具有益胃生津,滋阴清热之效的常用贵重药材[7]。同时作为中药上品,石斛至今无不良反应报道,可见其食用安全性可靠。2018年1月11日,原国家卫生和计划生育委员会(以下简称原国家卫计委)发布了《关于就党参、铁皮石斛等9种物质作为按照传统既是食品又是中药材物质开展试生产征求意见的函》。2020年6月12日,国家卫健委办公厅印发《关于云南省开展按照传统既是食品又是中药材的物质管理试点意见的函》,同意云南省对天麻、铁皮石斛、灵芝开展食药物质试点的风险监测方案。这是我国获批铁皮石斛药食同源的首个省份[8]。复方鲜石斛颗粒源自卫生部颁布的《药品标准》中药成方制剂第十五册以及《国家中成药标准汇编内科脾胃分册》,此复方制剂是由鲜石斛、葛根、三七等药食同源中药组成,具有滋阴养胃,清热解酒,生津止渴,化瘀定痛功效。但目前其对ALD的预防治疗机制尚未明确,缺乏对潜在机制的深入研究。
由于中药复方具有整体性和多样性特点,传统药理学方法难以评估其复杂的作用机制。网络药理学的研究理念强调从系统层次和生物网络的整体角度出发,可整体系统地分析“中药成分、靶点、通路与疾病靶点”之间的相互作用关系,能将中药复方多成分、多靶点、多通路的作用关系展现出来,这与中医辨证论治的整体思想不谋而合。因此,本研究拟采用网络药理学方法对复方鲜石斛颗粒治疗ALD的分子网络机制进行分析,并通过小鼠酒精性肝损伤模型实验和分子生物学技术,对核心的潜在作用通路进行验证,以期为今后的进一步研究提供理论数据支撑,研究方案见图1。
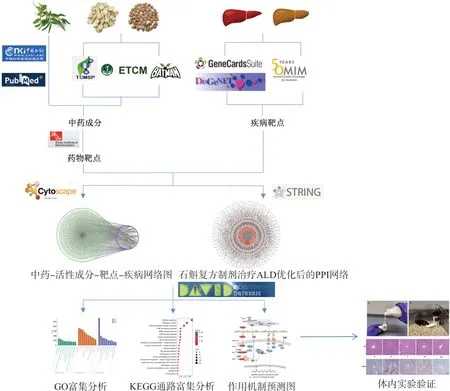
图1 研究方案示意图
1 材料
1.1 实验动物
C57BL/6J小鼠45只,8~10周龄,体质量18~20 g,购自维通利华实验动物技术有限公司,合格证号:SCXK(浙)2019-0002,饲养于独立换气动物房,环境温度(24±1)℃,湿度(55±5)%,12 h明暗交替光照,期间自由饮食。动物实验经南京中医药大学动物伦理委员会批准,并按照《实验动物饲养管理和使用指南》进行,伦理号:202207A035。
1.2 药物及主要试剂
水飞蓟宾葡甲胺购自江苏中兴药业有限公司;生理盐水购自山东格研生物技术有限公司;小鼠总胆固醇(TCHO)、甘油三酯(TG)、谷草转氨酶(AST)、谷丙转氨酶(ALT)测试盒均购自南京建成生物工程研究所;4%多聚甲醛固定液购自武汉塞维尔生物科技有限公司;OCT冰冻切片包埋剂购自美国Sakura公司;p-AKT、AKT、p-mTOR、mTOR、p-P65、P65和β-肌动蛋白(β-actin)抗体购自美国Proteintech公司。
根据《药品标准》中药成方制剂第十五册记载,按照以下流程制备复方鲜石斛颗粒样品:取鲜铁皮石斛加水煎煮2次,每次1.5 h,合并煎液,滤过,滤液浓缩至适量,放冷,加乙醇至含醇量达65%,静置,取上清液备用;葛根、三七加水煎煮3次,每次2 h,合并煎液,滤过,滤液浓缩至适量,放冷,加乙醇至含醇量达65%,静置,取上清液,沉淀用乙醇洗1次,洗液并入上清液,加入鲜石斛液,回收乙醇并浓缩至每1 g相当于生药2 g的清膏,冷冻干燥成冻干粉,保存备用。
1.3 主要实验仪器
Centrifuge 5430 R高速冷冻离心机(德国Eppendorf公司);LightCycler 96荧光定量PCR仪(瑞士Roche公司);MB-24S高通量组织研磨仪(浙江美壁仪器公司);Infinite M Nano多功能酶标仪(瑞士Tecan公司);Tanon-4200自动凝胶成像分析系统(中国Tanon公司);Mini Trans-Blot Cell垂直电泳仪(美国Bio-Rad公司)。
2 方法
2.1 网络药理学
2.1.1 复方鲜石斛颗粒活性成分与靶点的筛选 利用TCMSP(https://tcmsp-e.com/tcmspsearch.php)、ETCM(http://www.tcmip.cn)、BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)数据库及文献报道,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为阈值,对复方鲜石斛颗粒中“葛根”“三七”“铁皮石斛”的活性成分进行检索,筛选相应的有效成分。将得到的有效成分导入PubChem数据库(https://pubchem.ncbinlm.nih.gov/)中得到该成分的SMILES号或化学结构式,并导入Swiss ADME数据库(http://www.swissadme.ch/)进行药物代谢动力学(ADME)筛选,进一步筛选潜在活性较高的优效化合物。符合以下条件的成分被保留:①胃肠道吸收在药代动力学指标中显示为“高”;②DL筛选中两项及两项以上符合[9]。再通过Swiss Target Prediction数据库(http://wwwswisstargetprediction.ch/)预测化合物相应靶点选择物种为“Homo sapiens”,筛选Possibility>0.1的靶点,并进一步去重,初步得到与活性成分相对应的标准化靶点[10]。
2.1.2 ALD靶点与潜在作用靶点信息收集 利用Genecards(https://www.genecards.org/)、OMIM(https://omim.org/)、DrugBank(https:/www.drugbank.ca/)、DisGeNET(https://www.disgenet.org/)数据库,以“Alcoholic liver disease”为关键词进行检索,将获得的ALD作用靶点信息进行汇总去重整理。将“2.1.1”步骤中获得的活性成分的标准化靶点,同ALD疾病靶点上传至jvenn(https://jvenn.toulouse.inrae.fr/)绘图平台,从而获得复方鲜石斛颗粒治疗ALD的潜在作用靶点。
2.1.3 中药-活性成分-靶点-疾病网络图的构建分析 将已知的中药、活性成分与潜在作用靶点信息、疾病做成Network和Type文件导入Cytoscape软件中,使用Network Analyzer功能进行网络拓扑分析,绘制“药物-活性成分-靶点-疾病”的可视化网络图,根据度值(Degree)、中介中心度(Betweenness centrality,BC)筛选出复方鲜石斛颗粒核心活性成分[11-13]。
2.1.4 蛋白互作网络(PPI)的构建 将复方鲜石斛颗粒治疗ALD的潜在作用靶点导入String数据库中,设置蛋白物种为“Homo sapiens”,最小相互作用阈值选择highest confidence(0.9),隐藏与网络无连接的蛋白,其余设置均为默认,从而构建PPI。将获得的PPI数据选择Exports中TSV文件格式保存下载,将下载的数据导入Cytoscape软件,使用软件的Network Analyzer功能对PPI网络进行拓扑分析,得到各靶点的Degree值与BC值,再对网络图进行可视化处理,使得其中各节点的大小和颜色深浅反映数值的大小变化,方便筛选出关键靶点。
2.1.5 基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析 将潜在作用靶点导入DAVID(https://david.ncifcrf.gov/)数据库,设定基因物种为人源基因,对潜在作用靶点进行GO和KEGG富集分析,从而分析复方鲜石斛颗粒治疗ALD的生物学过程和相关信号通路。
2.2 实验验证
2.2.1 实验动物分组、给药以及急性肝损伤模型的建立 适应性饲养小鼠1周左右,随机分为4组,即空白对照组K(10 g体质量注射生理盐水0.1 mL),模型组M(10 g体质量注射生理盐水0.1 mL),阳性对照组P(水飞蓟宾葡甲胺加水配制成5 mg·mL-1溶液,50 mg·kg-1·d-1给药),给药组高剂量D-H、低剂量D-L(复方鲜石斛颗粒,400、100 mg·kg-1·d-1),每组10只。实验过程如下:实验开始前5 d让所有小鼠进食Lieber-DeCarli液体控制饮食(F1259SP;Bio-Serv,Flemington,NJ),第6天起,空白组小鼠用F1259SP液体饮食饲养,其余组改用含乙醇的F1258SP液体饮食喂养10 d。每组对应药物从实验第1天起灌胃,15 d给药结束,禁食12 h,处死,取肝组织和血液。将小鼠肝脏用4%多聚甲醛固定,剩余肝组织置于-80 ℃冰箱保存;血液室温静置2~3 h后,3 500 r·min-1离心10 min,收集血清置于-80 ℃冰箱保存。
2.2.2 行为状况观察 每天观察各组小鼠精神状态行为是否异常,毛发是否脱落,记录每日小鼠体质量,观察体质量波动是否在一个正常区间。
2.2.3 小鼠肝组织切片染色 光学显微镜下观察各组小鼠肝脏病理组织学变化并拍照,评估组织变化。
2.2.4 小鼠血清中ALT、AST水平及肝组织中TG、TCHO水平测定 按照小鼠ALT、AST试剂盒说明书方法,检测血清中ALT、AST水平;参照小鼠TG、TCHO试剂盒说明书操作步骤,准确称取小鼠肝组织20 mg,加入200 μL的无水乙醇于冰上匀浆,以10 000 r·min-1离心10min,取上清,测定肝组织中TG和TCHO的含量水平。
2.2.5 小鼠肝组织中IL-1β、CXCL10、Srebp-1c、CPT1 mRNA表达水平测定 切取每个小鼠约等质量的肝组织,加入预冷的RNA裂解液,进行匀浆后加入氯仿,静置5 min后离心,取上清加异丙醇,静置30 min。以12 000 r·min-1,4 ℃条件下离心10 min,倒上清得白色沉淀。加入75%乙醇进行洗脱,静置5 min后以12 000 r·min-1,4 ℃条件下离心5 min,弃掉乙醇,白色沉淀干燥后加DEPC水使其溶解,测定RNA浓度。根据浓度配置样品,进行逆转录,转录完再加DEPC水进行一定比例稀释,振荡后于4°冰箱保存。将样品进行点板,板每格加4 μL样品、6 μL引物∶荧光素酶=1∶5的混合物,之后放入qPCR仪检测,引物信息见表1,引物由上海生工生物技术有限公司合成。
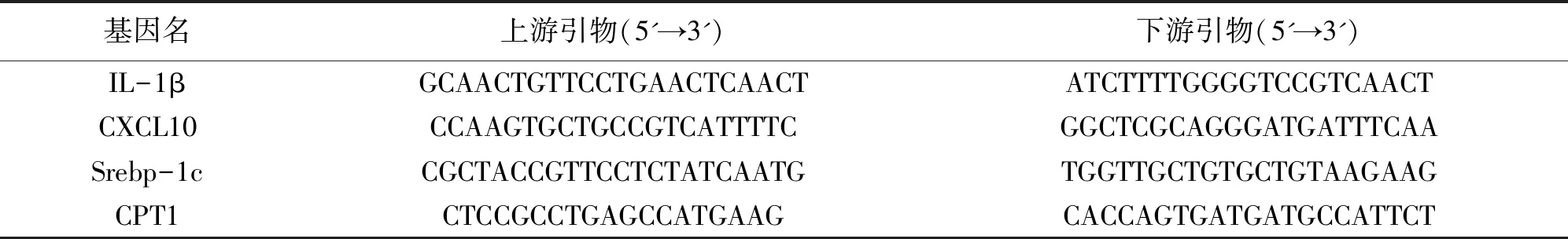
表1 引物序列
2.2.6 小鼠肝组织中PI3K-Akt信号通路蛋白表达测定 切取每个小鼠约等质量的肝组织,加入预冷的组织裂解液,进行匀浆,冰上裂解30 min,于4 ℃条件下离心10 min,13 000 r·min-1,取上清液,用BCA法测定蛋白浓度,计算出上样体积。根据各样品上样体积进行电泳、PVDF膜转膜,转膜后用脱脂奶粉配置的溶液封闭,封闭完成后按照分子量进行裁剪,分别加入一抗p-AKT、AKT、p-mTOR、mTOR、p-P-65、P65和β-actin(稀释倍数1∶1 000),放4 ℃孵化过夜后回收一抗,用TBST稀释液清洗后,加入二抗Rabbit(稀释倍数1∶1 000),于室温摇床孵化1 h,用ECL化学发光液显色,经自动凝胶成像分析系统拍照后以Image J软件分析各组蛋白相对表达水平。

3 结果
3.1 复方鲜石斛颗粒治疗ALD的网络分析结果
3.1.1 复方鲜石斛颗粒中活性成分与作用靶点的获取 以OB≥30%、DL≥0.18为阈值,通过TCMSP、ETCM、BATMAN-TCM数据库对复方鲜石斛颗粒中的葛根、三七的活性成分进行筛选;通过文献报道归纳“铁皮石斛”活性成分。通过Swiss ADME数据库进一步筛选,将获得的信息进行整合,删除重复数据后,共获得73个活性成分。对筛选出的有效成分通过Swiss Target Prediction数据库进行靶点预测,选取出评分高的靶点,得到复方鲜石斛颗粒的靶点共900个。中药-活性成分-作用靶点数目统计信息见表2。
3.1.2 ALD疾病靶点及复方鲜石斛颗粒治疗ALD潜在作用靶点的获取 以“Alcoholic liver disease”为关键词,在GeneCards、OMIM、DrugBank、DisGeNET数据库中进行检索,获取疾病靶点基因信息,共得到ALD的相关靶点9 651个。将上述复方鲜石斛颗粒的900个作用靶点与ALD的9 651个相关靶点导入jvenn绘图平台进行映射,获得720个复方鲜石斛颗粒治疗ALD的潜在作用靶点,绘制韦恩图,见图2。结果显示,复方鲜石斛颗粒可能通过多个潜在作用靶点协同发挥防治ALD的作用。
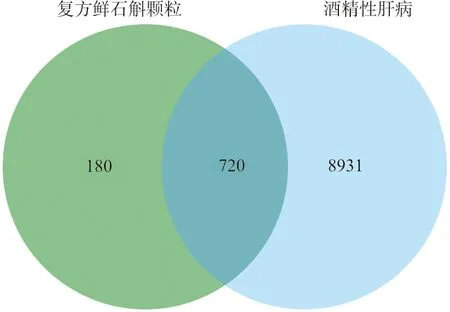
图2 复方鲜石斛颗粒治疗ALD靶点韦恩图
3.1.3 中药-活性成分-靶点-疾病网络图的绘制及分析 利用Cytoscape3.6.0软件对已知的中药、活性成分与潜在作用靶点信息、疾病进行中药-活性成分-靶点-疾病网络图的绘制,见图3。
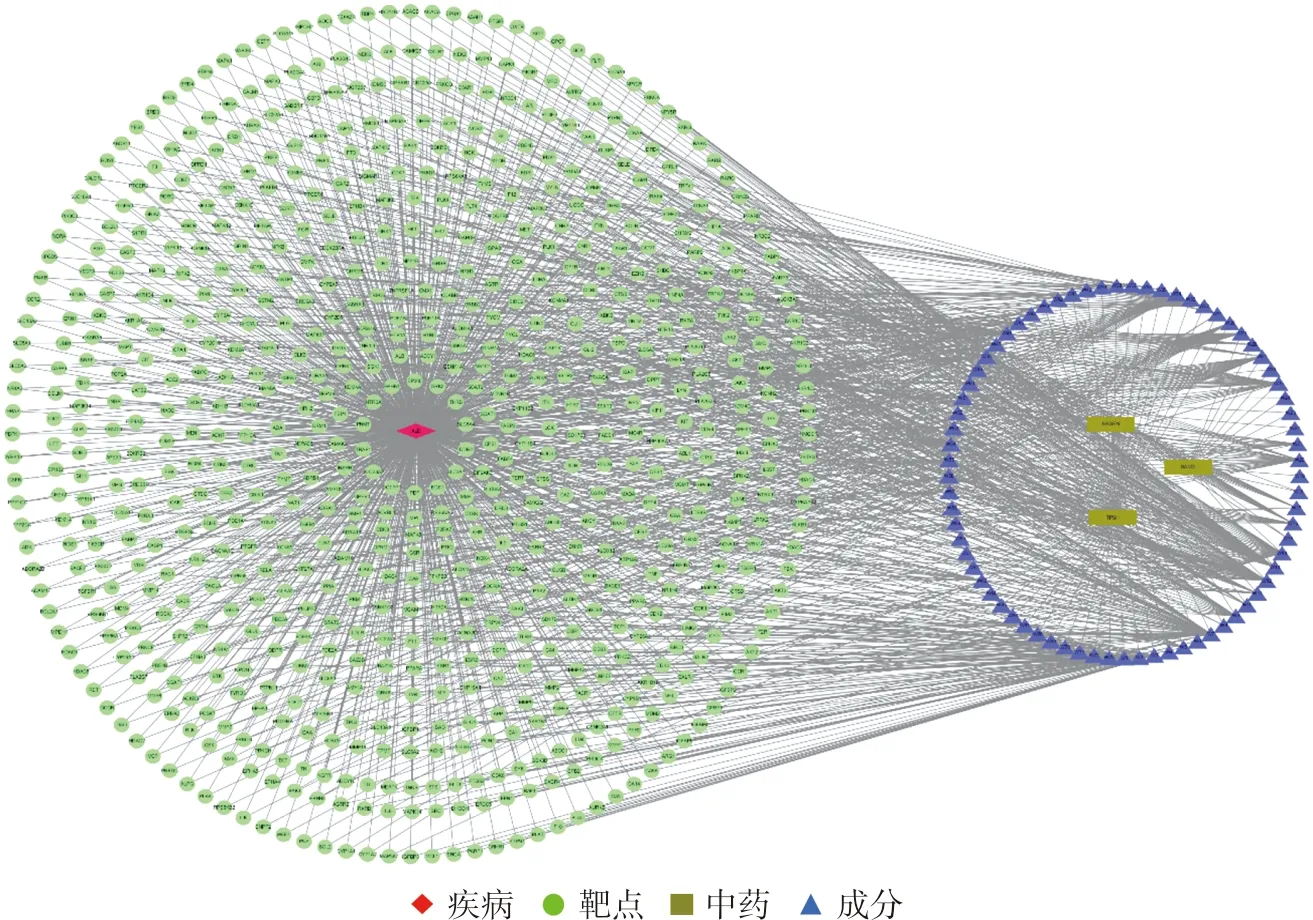
图3 中药-活性成分-靶点-疾病网络图
通过软件自带的Network Analyzer功能对整个网络图进行拓扑分析,计算网络中Degree值和BC值的平均值,分别是10.863和0.071,选择拓扑参数大于两项均值的活性成分,共筛选出23个符合条件的活性成分,如表3所示。推测这些成分可能是复方鲜石斛颗粒治疗ALD的关键活性成分。

表3 复方鲜石斛颗粒治疗ALD的关键药效成分
3.1.4 PPI网络图的绘制 把从Jvenn绘图平台获得的720个潜在作用靶点导入到String数据库当中,设置蛋白物种为“Homo sapiens”进行检索,点击“Continue”,将最小相互作用阈值设置为Highest Confidence(0.9),隐藏彼此间无连接的蛋白,其余设置均为默认,之后将网络数据以TSV文件格式进行下载,之后导入到Cytoscape3.6.0软件中,进行网络拓扑分析与可视化处理,如图4所示。综合Degree值与BC值两方面分析,选取数值最高的20个靶点,如表4与图5所示。在这些靶点中,TP35、PIK3R1、MAPK1、SRC、MAPK3、AKT1有相对较高的数值,可能为复方鲜石斛颗粒治疗ALD的最主要核心靶点,上述网络分析体现了复方鲜石斛颗粒多成分、多靶点的综合调节特点。
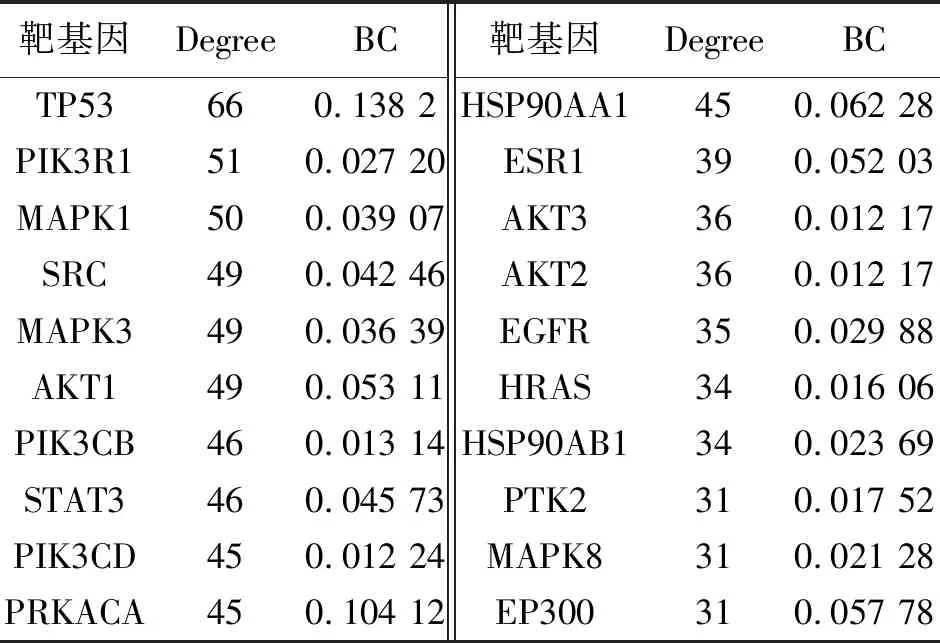
表4 复方鲜石斛颗粒关键靶基因的网络拓扑参数

注:Degree值越大,节点越大,颜色越深。
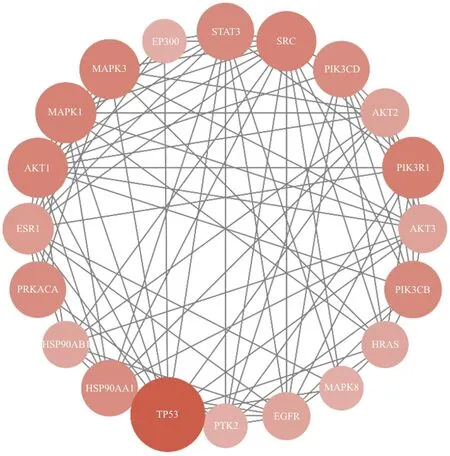
图5 复方鲜石斛颗粒治疗ALD排名前20的关键靶基因网络图
Fig.5 Network diagram of the top 20 key target genes for Compound Fresh Dendrobium Granules in the treatment of ALD
3.1.5 GO功能与KEGG功能富集分析 将获得的720个潜在作用靶点导入DAVID数据库中,获得GO功能与KEGG通路数据,以P<0.05,FDR<0.05为筛选条件,共789个GO BP(生物过程)条目,93个GO CC(细胞组分)条目,204个GO MF(分子功能)条目,194个KEGG通路条目。将BP、CC、MF中靶点富集最多的10个条目及KEGG中排名靠前的通路运用微生信平台以高级气泡图的形式直观地展示出来,GO富集分析见图6。生物过程主要涉及蛋白质磷酸化、信号转导、RNA聚合酶II启动子转录的正调控、炎症反应等;细胞组分主要涉及细胞核、细胞外区域、细胞质、等离子体膜等;分子功能主要涉及ATP结合、蛋白质结合、酶结合等。
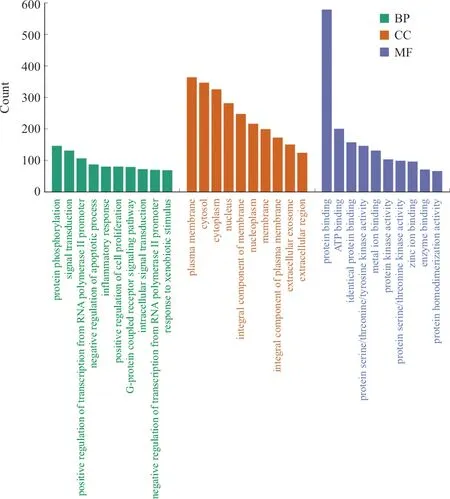
图6 复方鲜石斛颗粒治疗ALD潜在作用靶点的GO富集分析
KEGG通路富集分析见图7,从图中可以看出,P值较小、包含的基因数较多的代谢通路主要包括代谢过程、癌症途径、神经活性配体-受体相互作用、PI3K/Akt信号通路、MAPK信号通路、cAMP信号通路、钙信号通路等。
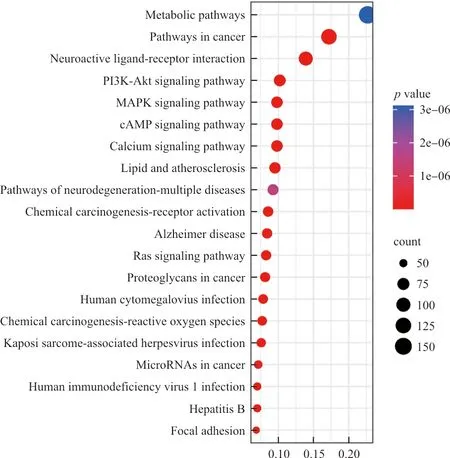
图7 复方鲜石斛颗粒治疗ALD的潜在作用靶点的KEGG通路富集分析
3.2 实验验证结果
3.2.1 实验小鼠行为状况变化 对所有组小鼠进行行为状况观察可见,空白组小鼠毛发光滑整洁,没有脱落现象,活泼好动,精神状态良好。其余4组小鼠在被喂食含乙醇的液体高脂流食后,精神普遍倦怠,行动迟缓,个别小鼠出现轻微的毛发脱落和体质量下降过多。各组小鼠平均体质量变化见图8,模型组平均体质量下降最为严重,空白组体质量趋势相对平稳,阳性药组与给药组体质量下降趋势大致相同,均高于模型组。
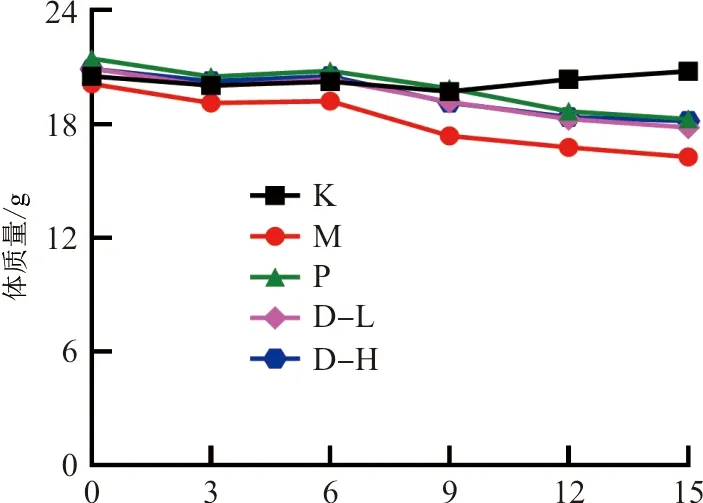
图8 各组小鼠平均体质量变化趋势图
3.2.2 复方鲜石斛颗粒对ALD小鼠肝组织的影响 各组小鼠肝组织切片油红O、HE染色结果如图9所示。油红O染色结果显示,与空白组相比,模型组中有更深的油红O染料附着,有更多脂质浸润及脂滴形成;与模型组相比,阳性药对照组、高低剂量给药组与低剂量给药组油红O染色附着更浅,脂质浸润及脂滴堆积情况较轻,高剂量组的脂质浸润及脂滴堆积情况优于阳性药对照组与低剂量组。从HE染色结果可知,与空白组相比,模型组胞浆中出现大量的脂肪空泡,并且伴有炎症细胞浸润,且有脂滴堆积。与模型组相比,阳性药对照组、高低剂量给药组与对肝组织均起到不同程度的改善作用,肝组织的脂肪空泡及脂滴堆积均减少,炎症细胞浸润情况有所改善。
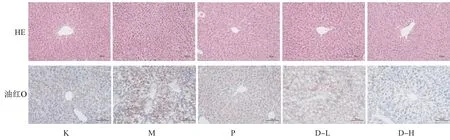
图9 复方鲜石斛颗粒对ALD小鼠肝组织的影响(油红O×100、HE×200)
3.2.3 复方鲜石斛颗粒对ALD小鼠血清ALT、AST及肝组织TG、TCHO含量水平的影响 结果如图10所示,与空白组相比,模型组小鼠血清中ALT与AST活性水平及肝组织中TG、TCHO含量明显升高(P<0.01,P<0.001)。与模型组相比,阳性对照组血清ALT、AST活性水平降低(P<0.05),而其肝组织中TG、TCHO含量显著降低(P<0.01,P<0.001);此外,与模型组相比,高、低剂量组血清ALT、AST活性水平及肝组织中TG、TCHO含量呈不同程度的降低(P<0.05,P<0.01,P<0.001)。
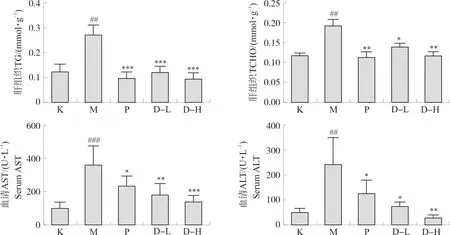
注:与空白组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,
3.2.4 复方鲜石斛颗粒对ALD小鼠肝组织中炎症与脂质代谢相关mRNA表达的影响 IL-1β、CXCL10、Srebp-1c、CPT1 mRNA表达结果如图11所示,与空白组相比,模型组IL-1β、CXCL10、Srebp-1c的基因表达水平显著升高(P<0.01),而CPT1基因表达水平显著降低(P<0.01)。与模型组相比,阳性药组、高、低剂量组的Srebp-1c、IL-1β、CXCL10 mRNA表达水平降低(P<0.05,P<0.01),而CPT1基因表达水平显著升高(P<0.05,P<0.01,P<0.001),表明复方鲜石斛颗粒可以通过抑制炎症和调控脂质代谢改善肝损伤。
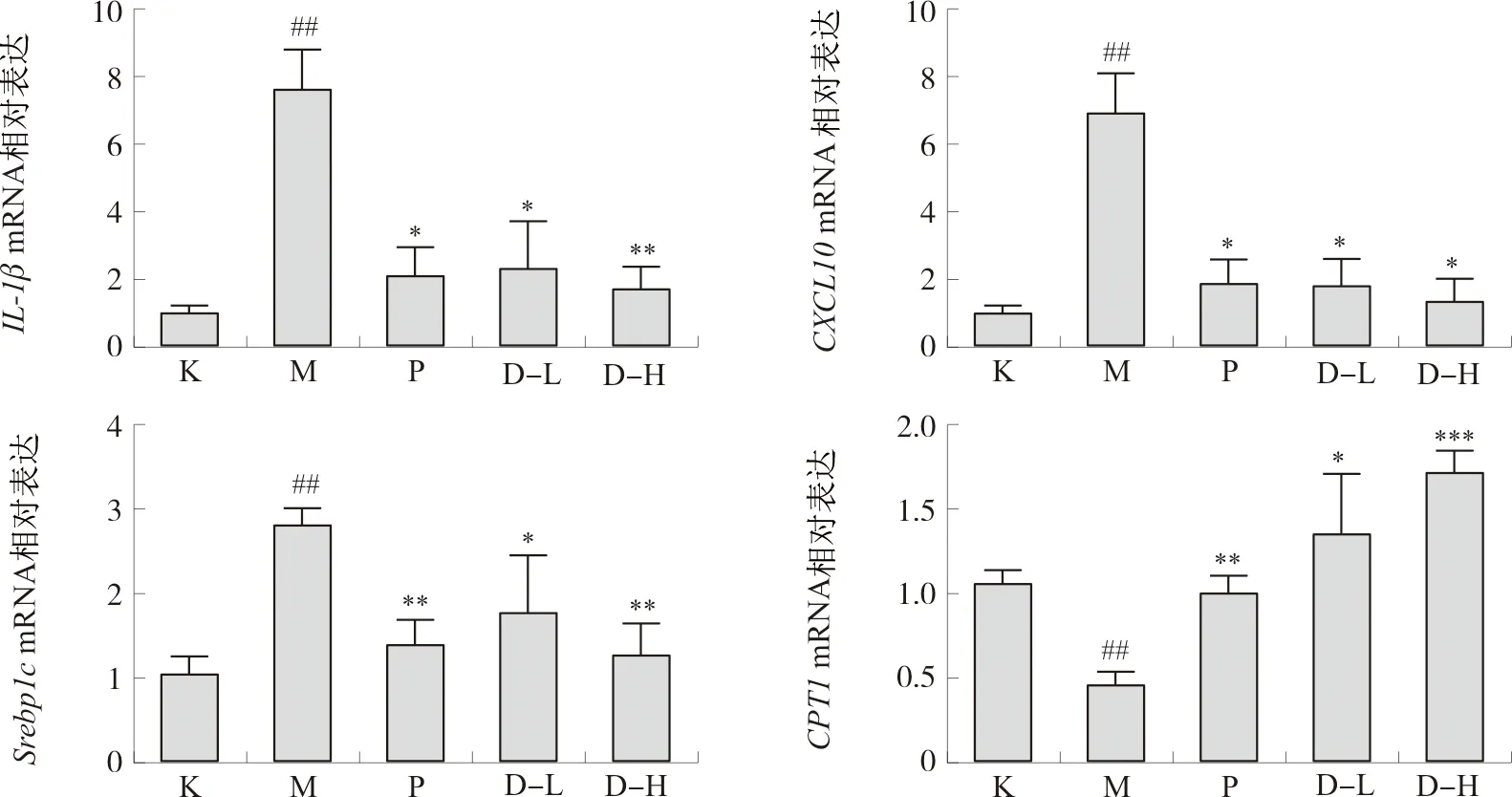
注:与空白组比较,##P<0.01;与模型组比较,
3.2.5 复方鲜石斛颗粒对ALD小鼠肝组织中PI3K/Akt信号通路蛋白表达的影响 经Western blot 检测分析(图12),与对照组相比,模型组p-AKT、p-mTOR、p-p65蛋白表达水平明显上升(P<0.01),经复方鲜石斛颗粒干预后,p-AKT、p-mTOR、p-p65蛋白表达水平明显下降(P<0.05,P<0.01),结果表明,石斛复方制剂能显著调节PI3K/Akt信号通路核心靶点的蛋白表达水平(图13)。
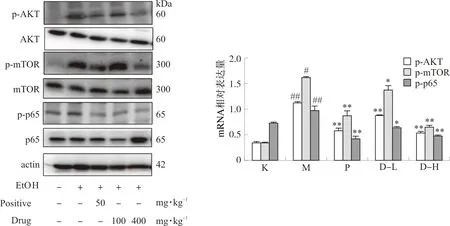
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,
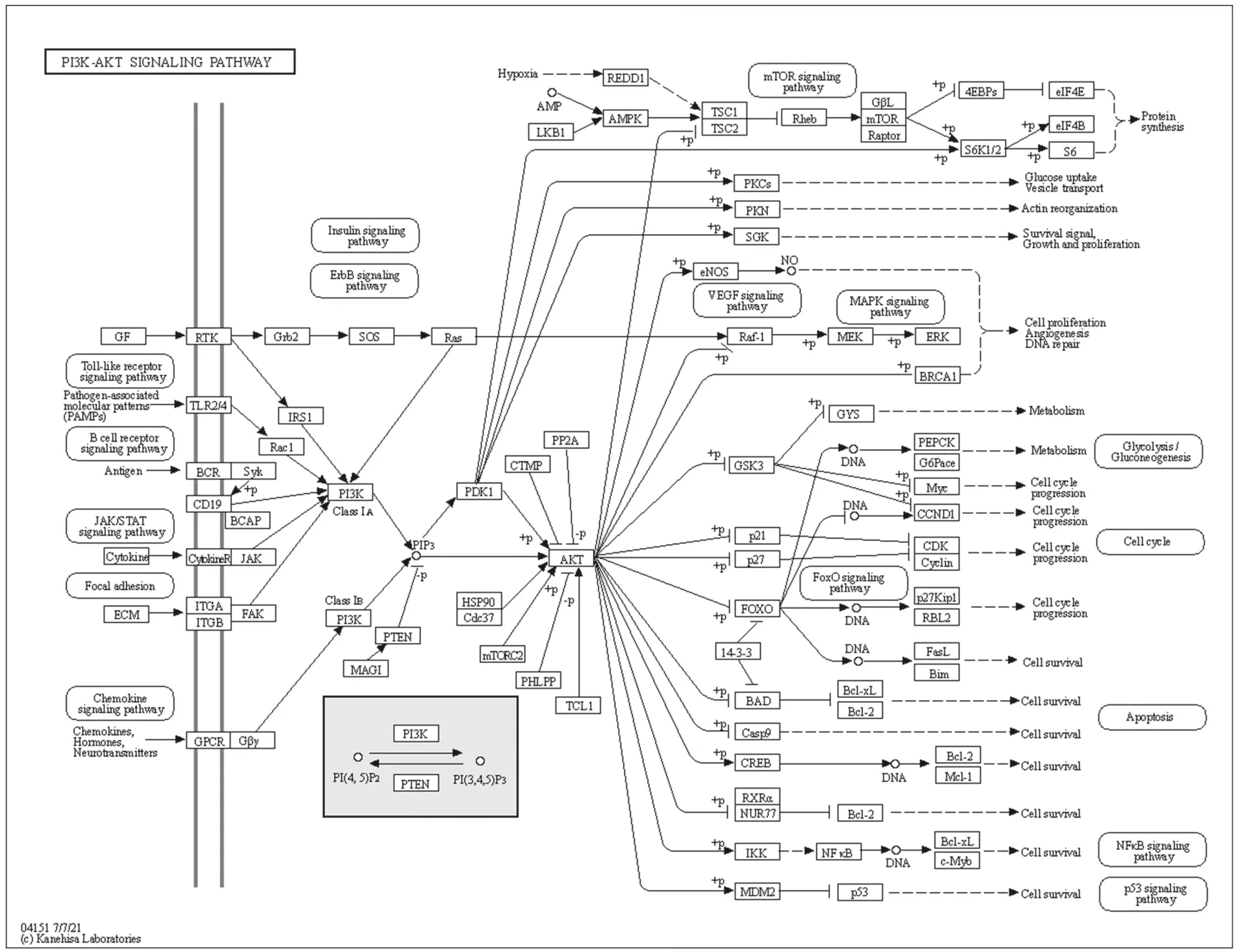
图13 复方鲜石斛颗粒治疗ALD的可能机制(PI3K/AKT信号通路)
4 讨论
本研究利用网络药理学构建“中药-活性成分-靶点-疾病”网络图,从而预测出药食同源石斛复方制剂(复方鲜石斛颗粒)治疗ALD的核心活性成分有Coumingidine、Mandenol、Genistein、Dalbergenone、DFV等。研究表明,Coumingidine对乙酰胆碱酯酶有一定的抑制作用,因此,对心肌的副交感神经有着兴奋作用[14]。Mandenol具有降低血清胆固醇和低密度脂蛋白的作用,主要用于预防和治疗动脉粥样硬化、心绞痛等疾病,刘国栋等研究发现亚油酸乙酯可以通过抑制MAPK和NF-κB信号通路的激活,显著抑制环氧化酶2、肿瘤坏死因子α、白细胞介素6等炎性因子的表达,发挥抗炎作用[15]。Genistein能够显著逆转酒精/乙醛诱导的氧化应激,ER应激,线粒体功能障碍和随后的肝细胞损伤,主要通过抗氧化、抗炎和抗凋亡机制改善酒精性肝损伤[16]。Dalbergenone具有显著的抗炎活性[17]。DFV可通过募集炎症细胞到组织部位,减弱趋化因子基因的表达,抑制相关基因表达的上调,发挥抗炎作用[18]。因而从上述可知,这些活性成分可能是石斛复方制剂治疗ALD的药效物质基础。
随后,我们针对潜在作用靶点进行分析,综合Degree值与BC值两方面分析推测TP35、PIK3R1、MAPK1、SRC、MAPK3、AKT1可能为复方鲜石斛颗粒的主要作用靶点。KEGG信号通路分析结果显示主要涉及代谢过程、PI3K/Akt信号通路、MAPK信号通路、cAMP信号通路、钙信号通路等。根据文献报道,酒精进入肠道后,会直接破坏肠黏膜的各种障碍,使肠黏膜通透性增加,导致寄生微生物群落及其代谢物通过门静脉系统进入肝脏,肠道微生态失衡和病理性细菌易位,它们是ALD发病机制的基础和重要原因。PI3K/AKT/mTOR通路广泛存在于细胞中,并参与调节细胞凋亡、增殖和分化以及新陈代谢等生理活动。PI3K为一种细胞内磷脂酰肌醇激酶,AKT也称蛋白激酶B,为PI3K下游重要的效应物,mTOR为一类丝氨酸/苏氨酸激酶,是细胞内关键的信号调节器,PI3K位于mTOR信号通路上游,通过激活mTOR参与调控细胞增殖、凋亡、免疫、代谢等多个过程。PI3K还可被各种理化因素和细胞因子激活,生成p-PI3K,p-PI3K进一步激活Akt生成p-Akt,p-Akt激活IKK使其磷酸化后,进一步磷酸化IκB,释放并磷酸化NF-κB p65、p50,p-p65与p-p50转移至细胞核,调控炎症相关介质的转录与翻译,增加炎症介质的释放,进而参与肝脏炎症、肝脏纤维化以及细胞凋亡等病理过程的发生[19-20]。
为了证实网络药理学预测结果,本研究选择对PI3K/Akt信号通路进行实验验证,结果显示经复方鲜石斛颗粒干预后,酒精性肝损伤小鼠肝细胞炎性细胞浸润和脂肪空泡数量减少,肝脏恢复正常细胞结构,血清ALT、AST活性水平及肝组织中TG、TCHO含量呈不同程度的降低,炎症与脂质代谢相关基因IL-1β、CXCL10、Srebp-1c的表达水平显著降低,CPT1基因表达水平显著升高;同时,通过对PI3K/Akt信号通路核心靶点的蛋白表达水平进行Western blot实验验证发现,与网络药理学预测的结果基本一致。综上所述,本研究证实复方鲜石斛颗粒能有效改善酒精性肝损伤小鼠的肝脏炎症和脂质代谢,其机制可能是通过调节PI3K/Akt信号通路抑制组织炎症,初步验证了网络药理学的分析结果,肯定了其在防治ALD方面的应用价值,为临床用药和后续研究提供参考依据。

